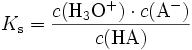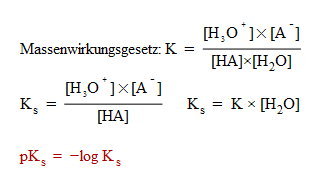Berechnen und Messen des pH-Werts: Unterschied zwischen den Versionen
(→Das Mass für die Stärke von Säuren: Der pKs-Wert) |
(→Die Stärke von Basen) |
||
| Zeile 56: | Zeile 56: | ||
=== Die Stärke von Basen === | === Die Stärke von Basen === | ||
| − | [[Bild:Stärke_von_Base_1. | + | [[Bild:Stärke_von_Base_1.png]] |
Base ⇌ konjugierte Säure | Base ⇌ konjugierte Säure | ||
Version vom 17. Juni 2011, 10:41 Uhr
Inhaltsverzeichnis
pKS- und pKB-Wert
Der pKS gibt Auskunft darüber, wie stark eine Säure ist. Es ist der negative Logarithmus der Gleichgewichtskonstante KS, welche sich folgendermassen berechnet:
Der pKS-Wert ist somit die Stärke der Säure gegenüber Wasser. HA ist hierbei die Säure, welche ihr Proton abgibt. Die Konzentration des Wassers kann hier vernachlässigt werden, da sie beinahe konstant bleibt, weshalb wird sich noch beim Kapitel des pH-Wertes zeigen. Man sieht hier also, dass bei einem hohen KS-Wert die Konzentration an Edukten sehr niedrig ist.
Je tiefer der pKS-Wert (da wie pH-Wert der negative Logarithmus verwendet wird), desto stärker die Säure. Dasselbe gilt auch für den pKB-Wert, je tiefer dieser ist, desto stärker die Base. Bei einem konjugierten Säure-Base-Paar gilt: pKS+pKB=14. Hier sieht man auch wieder, dass eine starke Säure eine schwache konjugierte Base hat. In diesem Thema wird das Messen und Berechnen des pH-Werts behandelt.
Das Messen von pH-Werten
SIB-Indikatoren
Prinzip: H Ind ⇌ Ind- + H+
Die Wirkung des Indikators als Säure oder als Base soll vernachlässigbar sein.
In einer stark sauren Lösung (viele H+-Ionen) dominiert Farbe 1 auf Grund einer hohen H3O+ -Konzentration. Aus dem Massenwirkungsgesetzt wird ersichtlich, dass ein grosser Protonendruck herrscht (alles wird protoniert), wodurch ein Farbumschlag stattfindet. Bei einer stark basischen Lösung herrscht hingegen ein Protonensog.
Mit diesem Prinzip der Farbänderung funktionieren Universalindikator-Stäbchen. Auf diesen Stäbchen sind verschiedene Indikatoren, welche alle einen anderen Farbumschlag sichtbar machen, angeordnet. Zur genauen Bestimmung des pH-Wertes wird also nicht nur eine Farbänderung erreicht. Die unterschiedlichen Farbanordnungen lassen eine Spezifischere Bestimmung zu, als beispielsweise pH-Papier.
pH-Meter
Ein pH-Meter ist ein Gerät, welches die elektrische Leitfähigkeit misst.
Die elektrische Leitfähigkeit einer Säure oder Base hängt von der Konzentration der geladenen Teilchen ab: Je mehr geladene Teilchen, welche in diesem Fall H3O+ -Teilchen sind, umso höher ist die Leitfähigkeit und umso tiefer ist der pH-Welt.
So sieht auf jeden Fall die Theorie aus. In Wirklichkeit gibt es aber noch mehr Ionen, welche das genaue Messen stören. Des Weiteren gehen bei der Digitalisierung der Daten durch Auflösen und Runden von Werten Informationen über genaue Messdaten verloren.
Das Berechnen von pH-Werten
Die Information der Art und Menga von Säuren ist grundlegend für die Berechnung (bei Indikatoren nicht nötig) Wenn starke Säuren vorhanden sind, reagiert jedes Teilchen mit Wasser.
Das Mass für die Stärke von Säuren: Der pKs-Wert
Durch das Lösen einer best. Menge Säure in Wasser überprüft man die Lage des Gleichgewichts der Reaktion.
Reaktionsgleichung: HA + H2O ⇌ H3O+ + A-
Der maximale Wert strebt gegen ∞ → Je positiver, desto schwächer die Säure
Der minimale Wert strebt gegen -∞ → Je negativer, desto stärker die Säure
Also: Eine starke Säure hat pKs-Wert mit negativem Vorzeichen
Die Stärke von Basen
Base ⇌ konjugierte Säure
Je stärker die konjugierte Säure, umso schwächer ist die Base.
Quellen
- Chemieunterlagen
- Wikipedia
Weblinks
- [1] – Bilder