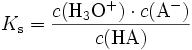Berechnen und Messen des pH-Werts: Unterschied zwischen den Versionen
| Zeile 14: | Zeile 14: | ||
== Das Messen von pH - Werten == | == Das Messen von pH - Werten == | ||
| − | '''SIB - Indikatoren''' | + | '''SIB - Indikatoren''' <p><div style="float: right;">[[Bild:800px-Säuren_und_Laugen_-_Farbspektrum_verschiedener_Indikatoren.svg.png]]</div></p> |
| − | Prinzip: H Ind | + | Prinzip: <font color="red">H Ind</font> ⇌ <font color="blue">Ind<sup>-</sup></font> + H<sup>+</sup> |
| − | + | ||
| + | Die Wirkung des Indikators als Säure oder als Base soll vernachlässigbar sein. | ||
| + | |||
| + | In einer stark sauren Lösung (viele H+-Ionen) dominiert Farbe 1 auf Grund einer hohen H3O+ -Konzentration. Aus dem Massenwirkungsgesetzt wird ersichtlich, dass ein grosser Protonendruck herrscht (alles wird protoniert), wodurch ein Farbumschlag stattfindet. Bei einer stark basischen Lösung herrscht hingegen ein Protonensog. | ||
| + | |||
| + | Mit diesem Prinzip der Farbänderung funktionieren Universalindikator-Stäbchen. Auf diesen Stäbchen sind verschiedene Indikatoren, welche alle einen anderen Farbumschlag sichtbar machen, angeordnet. Zur genauen Bestimmung des pH-Wertes wird also nicht nur eine Farbänderung erreicht. Die unterschiedlichen Farbanordnungen lassen eine Spezifischere Bestimmung zu, als beispielsweise pH-Papier. | ||
Version vom 13. Juni 2011, 16:55 Uhr
pKS- und pKB-Wert
Der pKS gibt Auskunft darüber, wie stark eine Säure ist. Es ist der negative Logarithmus der Gleichgewichtskonstante KS, welche sich folgendermassen berechnet:
Der pKS-Wert ist somit die Stärke der Säure gegenüber Wasser. HA ist hierbei die Säure, welche ihr Proton abgibt. Die Konzentration des Wassers kann hier vernachlässigt werden, da sie beinahe konstant bleibt, weshalb wird sich noch beim Kapitel des pH-Wertes zeigen. Man sieht hier also, dass bei einem hohen KS-Wert die Konzentration an Edukten sehr niedrig ist.
Je tiefer der pKS-Wert (da wie pH-Wert der negative Logarithmus verwendet wird), desto stärker die Säure. Dasselbe gilt auch für den pKB-Wert, je tiefer dieser ist, desto stärker die Base. Bei einem konjugierten Säure-Base-Paar gilt: pKS+pKB=14. Hier sieht man auch wieder, dass eine starke Säure eine schwache konjugierte Base hat. __________________________
Das Messen von pH - Werten
SIB - Indikatoren
Prinzip: H Ind ⇌ Ind- + H+
Die Wirkung des Indikators als Säure oder als Base soll vernachlässigbar sein.
In einer stark sauren Lösung (viele H+-Ionen) dominiert Farbe 1 auf Grund einer hohen H3O+ -Konzentration. Aus dem Massenwirkungsgesetzt wird ersichtlich, dass ein grosser Protonendruck herrscht (alles wird protoniert), wodurch ein Farbumschlag stattfindet. Bei einer stark basischen Lösung herrscht hingegen ein Protonensog.
Mit diesem Prinzip der Farbänderung funktionieren Universalindikator-Stäbchen. Auf diesen Stäbchen sind verschiedene Indikatoren, welche alle einen anderen Farbumschlag sichtbar machen, angeordnet. Zur genauen Bestimmung des pH-Wertes wird also nicht nur eine Farbänderung erreicht. Die unterschiedlichen Farbanordnungen lassen eine Spezifischere Bestimmung zu, als beispielsweise pH-Papier.