Zwischenmolekulare Kräfte: Unterschied zwischen den Versionen
(Die Seite wurde neu angelegt: Die zwischenmolekularen Kräfte (ZMK) basieren im Grunde auf der elektrostatischen Anziehung zwischen positiven und negativen Ladungen, der so genannten Coloumbkraft. B...) |
K |
||
| Zeile 1: | Zeile 1: | ||
| − | Die zwischenmolekularen Kräfte (ZMK) basieren im Grunde auf der elektrostatischen Anziehung zwischen positiven und negativen Ladungen, der so genannten | + | Die zwischenmolekularen Kräfte (ZMK) basieren im Grunde auf der elektrostatischen Anziehung zwischen positiven und negativen Ladungen, der so genannten Coulombkraft. Bei ihnen handelt es sich nicht um Kräfte, die zur Bildung von Verbindungen zwischen einzelnen Atomen führen (wie kovalente Bindungen, Ionenbindungen sowie Metallbindung). Nur bei den Edelgasen haben die zwischenmolekularen Kräfte Wirkung zwischen einzelnen Atomen, da diese Elemente keine Moleküle bilden. |
Schmelz- und Siedepunkt sowie die Löslichkeit von Stoffen werden von diesen Kräften beeinflusst. | Schmelz- und Siedepunkt sowie die Löslichkeit von Stoffen werden von diesen Kräften beeinflusst. | ||
Es gibt drei Arten der zwischenmolekularen Kräfte, sie unterscheiden sich in ihrer Stärke. Namentlich sind dies Van-der-Waals-Kräfte, Dipol-Dipol-Kräfte und Wasserstoffbrücken. | Es gibt drei Arten der zwischenmolekularen Kräfte, sie unterscheiden sich in ihrer Stärke. Namentlich sind dies Van-der-Waals-Kräfte, Dipol-Dipol-Kräfte und Wasserstoffbrücken. | ||
Version vom 25. Mai 2010, 07:58 Uhr
Die zwischenmolekularen Kräfte (ZMK) basieren im Grunde auf der elektrostatischen Anziehung zwischen positiven und negativen Ladungen, der so genannten Coulombkraft. Bei ihnen handelt es sich nicht um Kräfte, die zur Bildung von Verbindungen zwischen einzelnen Atomen führen (wie kovalente Bindungen, Ionenbindungen sowie Metallbindung). Nur bei den Edelgasen haben die zwischenmolekularen Kräfte Wirkung zwischen einzelnen Atomen, da diese Elemente keine Moleküle bilden. Schmelz- und Siedepunkt sowie die Löslichkeit von Stoffen werden von diesen Kräften beeinflusst. Es gibt drei Arten der zwischenmolekularen Kräfte, sie unterscheiden sich in ihrer Stärke. Namentlich sind dies Van-der-Waals-Kräfte, Dipol-Dipol-Kräfte und Wasserstoffbrücken.
Inhaltsverzeichnis
Die Van-der-Waals-Kräfte
Die Schwächsten der drei zwischenmolekularen Kräfte sind die so genannten Van-der-Waals-Kräfte (VdW-Kräfte). Die VdW- Kräfte wirken zwischen allen Molekülen, unpolaren wie polaren und den Edelgasatomen. Abhängig sind sie von der Masse des Moleküls (Molekülmasse). Je grösser diese ist, desto stärker sind die VdW-Kräfte. Sie sind die einzigen zwischenmolekularen Kräfte, die auch zwischen unpolaren Molekülen wirken.
Entstehung der VdW-Kräfte
Wie aber entstehen nun die VdW- Kräfte? (siehe Abb.1)
Einen Aspekt darf man bei der graphischen Darstellung von Molekülen nicht vergessen, der bei Grafiken nicht oder nur ungenügend dargestellt wird. Die Elektronen der Atome innerhalb der Moleküle sind nicht absolut bewegungslos. Durch die Brownsche Bewegung kommt es andauernd zu Kollisionen der Moleküle, wodurch sich vorübergehende Polarisierungen ergeben. Durch diese Polarisierung kommt es zu einer Anziehung zwischen den Molekülen, da nun ja ebenfalls vorübergehende Partialladungen vorhanden sind. Da die Polarisierung nur vorübergehend ist sind die VdW-Kräfte schwach und ebenfalls nur vorrübergehend, allerdings kommt es auch stetig zu neuen Kollisionen. Diese Kräfte sind also nicht nur von der Molekülmasse abhängig sondern auch von der Verformbarkeit (Polarisierbarkeit) und der Grösse der Oberfläche des Moleküls. Diese beiden Faktoren hängen aber direkt mit der Masse des Moleküls zusammen. Je grösser die Molekülmasse, desto grösser die Oberfläche, desto grösser die Verformbarkeit und desto grösser sind somit auch die Van-der-Waals-Kräfte.
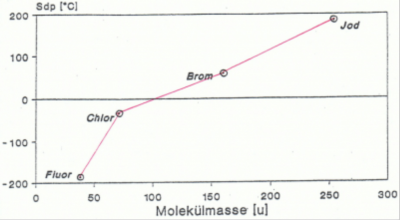
Die Veränderung des Schmelz- und Siedepunktes durch die VdW-Kräfte
Je grösser die VdW- Kräfte sind, desto höher sind Schmelz- und Siedepunkt des Stoffes, wie in der Abb.2 zu sehen ist. In der Abbildung kann man sehen, dass gilt: Je höher der Schmelz – und Siedepunkt sind, desto grösser ist auch die Molekülmasse. (Fluor [F2] bis Iod[I2])
Die Dipol-Dipol- Kräfte
Ein polares Molekül wird Dipol genannt, wenn es einen positiven und negativen Pol aufweist. Zwischen diesen polaren Molekülen wirken die so genannten Dipol-Dipol-Kräfte, die durch die elektrostatische Wechselwirkung zwischen den verschiedenen Polen zustande kommen. Es kommt zu einer Anziehung zwischen den Dipolen und sie ordnen sich in einem elektrischen Feld an. Die Dipol-Dipolkräfte sind die zweitstärksten zwischenmolekularen Kräfte, die es gibt.
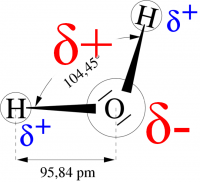

Dipol?
Um festzustellen, ob ein polares Molekül ein Dipol ist oder nicht, müssen der positive und der negative Pol des Moleküls lokalisiert werden. In einem Molekül mit mehreren Bindungen befindet sich der positive Pol in der Mitte aller positiv polarisierten Atome des Moleküls, mit dem negativen Pol verhält es sich analog. (Abb.3) Fallen nun der positive und der negative Pol des Moleküls zusammen, wie es beim Beispiel CO2 (siehe Abb.4)zu sehen ist, so handelt es sich nicht um einen Dipol, d.h. es sind keine Dipol-Dipol-Kräfte vorhanden und daher sind der Schmelz – und Siedepunkt sehr niedrig.
Um die Polarität eines Moleküls bestimmen zu können, muss man jedoch nicht nur die Polaritäten der einzelnen Bindungen innerhalb des Moleküls kennen, sondern auch auf die geometrische Struktur des Moleküls und freie Elektronenpaare achten. Die Struktur eines Moleküls kann mit Hilfe des EPA-Modells (Elektronenpaar-Abstossungs-Modell) ermittelt werden.
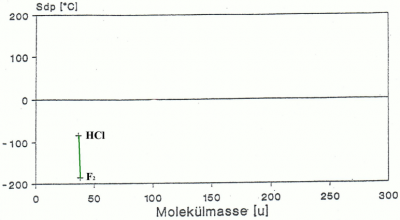
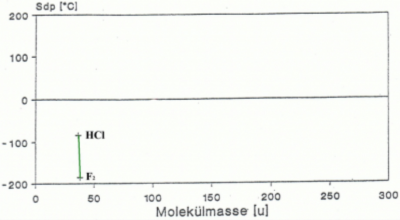
Die Veränderung des Schmelz- und Siedepunktes durch die Dipol-Dipol-Kräfte
Bei den Dipol-Dipol-Kräften spielt die Masse der Moleküle keine Rolle, dies sieht man sehr schön daran, dass HCl zwar eine geringere Molekülmasse hat als F2 aber einen bedeutend höheren Schmelz- und Siedepunkt aufweist (siehe Abb.5). HCL ist polar im Gegensatz zu F2 und weist Dipol-Dipol-Kräfte auf. Es gilt also auch bei den Dipol-Dipol-Kräften: Je stärkere Dipol-Dipol-Kräfte ein Molekül aufweist, desto höher ist der Schmelz- und Siedepunkt des Stoffes.
Wasserstoffbrücken
Wasserstoffbrücken (H-Brücken) sind die stärksten zwischenmolekularen Kräfte. Für ihre Bildung müssen beide Moleküle stark polare Bindungen besitzen, d.h. eine Asymmetrie muss vorhanden sein, entweder stark positiv oder stark negativ. Die Moleküle müssen aber keineswegs Dipole sein. Das positiv geladene H-Atom des einen Moleküls und das freie /die freien Elektronenpaar/e des negativ geladenen Atoms des anderen Moleküls ziehen einander an. H-Brücken sind als einzige ZMK über längere Zeit stabil.
Positive und negative Brückenköpfe
Positiver Brückenkopf
Immer(!) ein stark polarisiertes H-Atom
negativer Brückenkopf
negativ polarisierte Atome
H-Brücken nur bei F, O und N
Ist es möglich eine Wasserstoffbrücke zu bilden, so wird dies auch immer(!) getan. Sie können nur sehr schwer aufgehoben werden und dominieren bei vergleichbar grossen Molekülen über die anderen ZMK-Kräfte. Dennoch sind Wasserstoffbrücken schwächer als Elektronenpaarbindungen.
Die Veränderung des Schmelz- und Siedepunktes durch die Wasserstoffbrücken
Wie bei allen ZMK-Kräfte gilt auch bei den Wasserstoffbrücken, je mehr Wasserstoffbrücken gebildet werden desto höher sind Schmelz – und Siedepunkt des Stoffes(siehe Abb.6). Dies ist auch der Grund weshalb Wasser (mit 4 H-Brücken pro Molekül) einen vergleichbar hohen Schmelz – und Siedepunkt hat (100°C).
Beispiele
Funktionsweise von Frostschutzmittel
Ethylenglycol
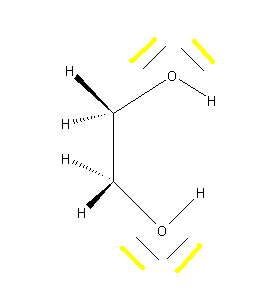 Es erfolgt eine Erniedrigung des Schmelzpunktes, da Ethylenglycol im Vergleich zu Wasser weniger H-Brücken bildet.
Es erfolgt eine Erniedrigung des Schmelzpunktes, da Ethylenglycol im Vergleich zu Wasser weniger H-Brücken bildet.
Zucker
Zucker besitzt lange Moleküle und kann viele Wasserstoffbrücken bilden durch stark positiv geladene H-Atome sowie einem stark negativ-polarisierten O-Atom, daraus ergibt sich in Verbindung mit Wasser die hohe Klebrigkeit von Zucker. Je mehr H-Brücken gebildet werden können desto klebriger ist ein Stoff.
Siehe auch
Die Bedeutung der ZMK
Im Kapitel der Bedeutung der ZMK wird darauf eingegangen, welche spezielle Eigenschaften Wasser durch die ZMK besitzt und welchen Einfluss die ZMK; insbesondere die H-Brücken bei den Proteinen hat, die Proteine werden mitunter auch durch H-Brücken zusammen gehalten.
Die Löslichkeit und die ZMK
Bei der Löslichkeit spielt es eine Rolle ob ein Stoff wasserlöslich (hydrophil) ist oder nicht (lipophil), dabei spielen die H-Brücken eine wichtige Rolle. Je mehr H-Brücken vorhanden sind, desto wasserlöslicher ist ein Stoff. Näheres dazu kann man im Kapitel der Löslichkeit nachlesen.
Quellen
Allgemein
- Unterlagen aus dem Unterricht von Herr Deuber
- "Chemie", Charles E. Mortimer & Ulrich Müller, erschienen 2007 bei Thieme (9. Auflage)
- [1]
