Molmasse und Molvolumen: Unterschied zwischen den Versionen
| Zeile 34: | Zeile 34: | ||
=== Berechnen der Anzahl Teilchen === | === Berechnen der Anzahl Teilchen === | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| Zeile 55: | Zeile 45: | ||
'''III''' Berechnen der Anzahl Teilchen durch Multiplizieren mit der Avogadro-Zahl. | '''III''' Berechnen der Anzahl Teilchen durch Multiplizieren mit der Avogadro-Zahl. | ||
| + | |||
| + | |||
[[Bild:Papiertaschentuch.jpg ]] | [[Bild:Papiertaschentuch.jpg ]] | ||
Version vom 30. Mai 2010, 15:33 Uhr
Um für bestimmte Reaktionen ausgehend von den Edukten und Produkten die Mengen der einzelnen Stoffe zu berechnen (siehe Chemisches Rechnen), muss man natürlich zuerst wissen, wie man von einer bestimmten Menge eines Stoffes die Anzahl Teilchen berechnen kann. In diesem Kapitel wird beschrieben, wie man mit der Masse bzw. dem Volumen eines Stoffs diese Anzahl berechnen kann. Eine sehr entscheidende Rolle spielt dabei das Mol.
Inhaltsverzeichnis
Molmasse
Experiment: Eisen + Schwefel
Teilchen sind:
Atome --> Bei Gasen
Ione --> Bei Salzen
Moleküle --> Bei Nichtmetal-Verbindungen
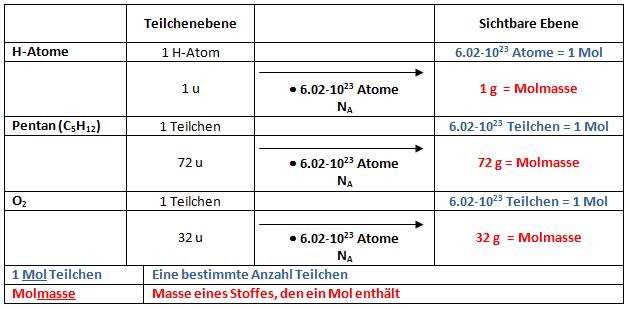
Die Zahl 6,02 · 1023 ist die Avogadro-Zahl. Sie wird mit der Teilchenebene multipliziert, um die sichtbare Ebene zu erhalten. Die Avogadro-Zahl wird ausserdem zur Umrechnung von Unit in Gramm benutzt:
- 6,02 · 1023 Unit entsprechen 1 Gramm
Def.: Ein Mol entspricht der Menge eines Stoffs, die NA (=Avogadro-Zahl), d.h. 6,02 · 1023 Teilchen enthält
1 mol ist also eine Teilchenanzahl wie z.B. 1 Dutzend = 12 Teilchen. 1 mol = 6,02 · 1023 (Avogadro-Zahl!)Teilchen
Def.: Molmasse entspricht einer Stoffmenge, welche 1 Mol Teilchen enthält. Die Einheit der Molmasse ist g/Mol. Die Molmasse entspricht, der in g ausgedrückten Teilchenmasse eines Stoffes.
Berechnen der Anzahl Teilchen
Mit diesen Informationen können wir jetzt die Antwort auf die zentrale Frage finden. Man geht dabei in drei Schritten vor:
I Bestimmen der Molmasse
II Berechnen der Anzahl Mol
III Berechnen der Anzahl Teilchen durch Multiplizieren mit der Avogadro-Zahl.
Beispiel
Wir ermitteln jetzt die Anzahl der Teilchen, die in einem Gramm H2 enthalten sind.
I Molmasse H2 ⇒ 2g/mol
II 1g = n · 2g/mol
n = 0.5 mol
III 1 mol → 6.02 · 1023 Teilchen
0.5 mol → 3.01 · 1023 Teilchen
Somit wissen wir jetzt, dass in einem Gramm H2 3.01 · 1023 Teilchen enthalten sind.
Molvolumen
Da es bei Gasen keinen Sinn macht, die Masse anzuschauen, benutzt man für diese das Volumen. Das Molvolumen gilt nur bei Gasen. Die zentrale Frage ist hierfür leicht abgeändert: Wieviele Teilchen sind in einem bestimmten Volumen eines Gases?
Das Volumen eines Gases ist nicht immer gleich, es ist abhängig von Druck und Temperatur. Um nicht jedesmal ein anderes Molvolumen zu bekommen, hat man sich auf Normalbedingungen (nicht zu verwechseln mit den Standardbedingungen!) geeinigt. Diese lauten wie folgt:
Druck (p) = 1,013 bar
Temperatur (T) = 0°C = 273°K
Bei diesen Bedingungen wird ein Gas als ideal bezeichnet und hat das Molvolumen von ≈ 22,4 l/mol.
Umrechnung:
- VNB · pNB / TNB = Vx · px / Tx
- Vx = VNB · pNB · Tx / TNB · px = VNB · pNB / TNB · Tx / px
- (VNB = Volumen bei Normalbedingungen; Vx = Volumen bei jeweiliger Situation etc.)
Eine Frage stellt sich aber noch, diese lautet: "Hängt das Molvolumen von der Art der Teilchen ab?"
Nehmen wir einmal an, dass die wichtigen Faktoren bei einem Teilchen die Geschwindigkeit v und die Masse m sind. Beide Faktoren fassen wir jetzt als eines zusammen, und zwar ersetzen wir sie durch den Begriff Platzbedarf, wobei Platzbedarf = f ist.
In der Gleichung für die Kinetische Energie Ekin erfahren wir zusätlich, dass der Platzbedarf multipliziert mit der Geschwindigkeit, die doppelte Ekin ergibt:
- Ekin = (f · v)/2 = (m · v2)/2
Somit lässt sich klarstellen, dass bei konstanter kinetischer Energie und Temperatur auch der Platzbedarf gleich bleibt:
- Kinetische Energie = const. ⇒ Temperatur = const. ⇒ Platzbedarf = const.
In Worten gefasst kann man also sagen, dass Teilchen mit kleiner Masse zwar winziger sind, doch durch ihre erhöhte Geschwindigkeit gleich viel Platz brauchen als grosse Teilchen, welche sich langsamer fortbewegen und durch ihre Masse den gleichen Bedarf an Platz decken.
Der Satz von Avogadro

Die vorherige Erkenntnis über den Platzbedarf stammte von dem italienischen Physiker und Chemiker Amadeo Avogadro, der auch die Avogadro-Zahl einführte. Sein Satz lautet wie folgt:
"Gleiche Volumen verschiedener Gase enthalten bei konstanten Bedingungen die gleiche Anzahl Teilchen."
Mit diesem Satz wurden auch die Standardbedingungen festgelegt, da man jetzt wusste, dass jedes Gas bei gleicher Temperatur und Druck das gleiche Molvolumen haben musste. Die Standardbedingungen setzen voraus, dass die Temperatur bei 25°C (298 K) und der Druck bei 1013 hPa liegen. Bei dieser speziellen Situation beträgt das Molvolumen ≈ 25l/mol.
Experimentelle Bestimmung des Molvolumens
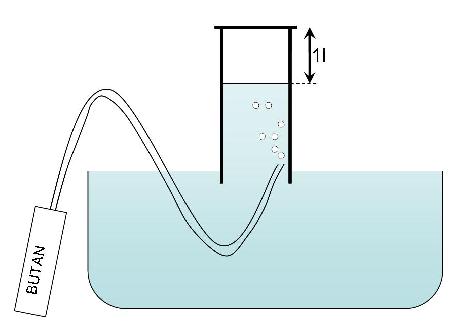
In diesem Experiment versuchen wir das Molvolumen von Butan (C4H10) aus einem Nachfüllbehälter zu bestimmen, indem wir ein mit Wasser gefülltes Glas in ein Wasserbecken tauchen, 1l Butangas hineinfliessen lassen und schliesslich mit den ermittelten Angaben das Molvolumen bestimmen. Dazu brauchen wir das in diesem Kapitel erworbene Wissen.
- Gewicht des Nachfüllbehälters: Vor dem Einflössen des Gases: 55.52g
- Nach dem Einflössen des Gases: 53.10g
Berechnen des Gewichts, welches ein Liter Butan hat:
- m (Menge des Stoffs) = 55.52g - 53.10g = 2.42g Butangas entsprechen 1l
Berechnen der Anzahl Teilchen, welche darin vorhanden sind:
- Butan C4H10: 58g = 1 mol
- 2.42g = x
- x = 0.0417 mol
- 2.42g = x
2.42g entsprechen 0.0417 mol
Bestimmen des Molvolumens von Butan:
- 0.0417 mol = 1l
- 1 mol = xl
- 1 mol =23.9l
Somit schliessen wir diese Aufgabe mit einem Molvolumen von 23.9l ab.
Quellen
- Chemieunterlagen
- Wikipedia
Weblinks
- Swisseduc – Unterrichtsserver für Chemie