Die Reaktionsenthalpie ΔH: Unterschied zwischen den Versionen
| Zeile 51: | Zeile 51: | ||
Bei einer exothermen Reaktion ist ΔH negativ (ΔH<0), das heisst die Wärme wird an die Umgebung abgegeben. | Bei einer exothermen Reaktion ist ΔH negativ (ΔH<0), das heisst die Wärme wird an die Umgebung abgegeben. | ||
Bei einer endothermen Reaktion ist ΔH positiv (ΔH>0), weil die Energiedifferenz mit der Wärme aus der Umgebung ausgeglichen wird, das heisst die Umgebung verliert an Wärme. | Bei einer endothermen Reaktion ist ΔH positiv (ΔH>0), weil die Energiedifferenz mit der Wärme aus der Umgebung ausgeglichen wird, das heisst die Umgebung verliert an Wärme. | ||
| + | |||
| + | == Messung der Reaktionsenthalpie == | ||
| + | |||
| + | Die Enthalpie einer Reaktion ist zum Unterschied zu den Enthalpien von Einzelstoffen mit Hilfe eines Kalorimeters messbar. Da bei exothermen Reaktionen Wärme an die Umgebung abgegeben wird, misst der Kaloriemeter diese Wärme und kann so auf die Reaktionenthalpie schliessen. Bei der endothermen Reaktion ist es genau umgekehrt. Da Energie aufgebracht werden muss, damit die chemische Reaktion ablaufen kann, nehmen die Stoffe Wärme vom Kaloriemeter auf. Mit dieser Wärme lässt sich auf die Reaktionsenthalpie schliessen. | ||
| + | |||
| + | |||
=Die Reaktionsenthalpie ΔH bei Verbindungen= | =Die Reaktionsenthalpie ΔH bei Verbindungen= | ||
Version vom 30. Mai 2010, 14:54 Uhr
Die Reaktionsenthalpie ∆H ist der Energieumsatz bei einer mit konstantem Druck durchgeführten chemischen Reaktion. Sie ist also diejenige Energie, die freigesetzt (exotherme Reaktion) bzw. aufgebracht (endotherme Reaktion) werden muss, damit zwischen den Molekülen zweier Stoffe neue chemische Bindungen gebildet werden.
Inhaltsverzeichnis
Lebewesen
Offene Systeme wie Lebewesen tauschen mit ihrer Umwelt ständig Energie und Stoffe aus. Bei den zahllosen chemischen Reaktionen z.B. im Körper werden ständig Edukte in Produkte umgewandelt. Hierbei spielt der Energieumsatz eine wichtige Rolle, da wir Energie zum Überleben benötigen und es entscheidend ist wie viel bei einer Reaktion verbraucht wird und wie viel noch in den Produkten vorhanden ist.
Technik
In der Technik kommt der Temperatur der Reaktionsprodukte eine wichtige Bedeutung zu. Bei Verbrennungen (Motor, Gasturbine) wird immer Energie in Form von Wärme frei. Hierbei möchte man wissen mit welcher Temperatur die Produkte zur Verfügung stehen um z.B. herauszufinden, wie viel Wärme (Energie) man gewinnen kann.
Berechnung der Reaktionsenthalpie
Wie oben genannt, ist die Reaktionsenthalpie ∆HR als Differenz der Enthalpien der Endstoffe und Enthalpien der Ausgangsstoffe zu verstehen.
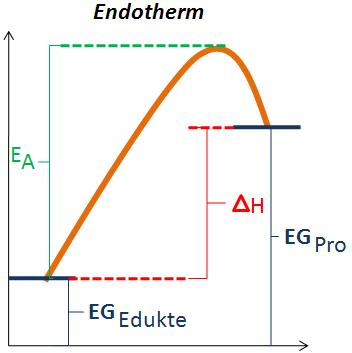
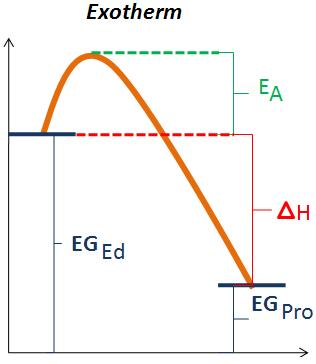
Endotherm und Exotherm
Auf diesen Skizzen ist eine Exotherme und eine Endotherme Reaktion dargestellt. Wobei (EA) der Aktivierungsenergie entspricht, welche aufgewendet werden muss, damit die Reaktion überhaupt abläuft. Wenn man die Aktivierungsenergie auf der Teilchenebene anschaut entspricht sie dem Zusammenstoss zwischen zwei Teilchen. Die Reaktionsgeschwindigkeit ist abhängig von der Aktivierungsenergie. Ist die Aktivierungsenergie klein so läuft die Reaktion schnell ab, ist sie jedoch gross läuft sie langsam ab.
(EGEd)bedeutet Energiegehalt der Edukte und steht für die potenzielle Energie der Edukte. Sowie (EGPro) für die potenzielle Energie der Produkte steht.
Bei einer exothermen Reaktion ist ΔH negativ (ΔH<0), das heisst die Wärme wird an die Umgebung abgegeben.
Bei einer endothermen Reaktion ist ΔH positiv (ΔH>0), weil die Energiedifferenz mit der Wärme aus der Umgebung ausgeglichen wird, das heisst die Umgebung verliert an Wärme.
Messung der Reaktionsenthalpie
Die Enthalpie einer Reaktion ist zum Unterschied zu den Enthalpien von Einzelstoffen mit Hilfe eines Kalorimeters messbar. Da bei exothermen Reaktionen Wärme an die Umgebung abgegeben wird, misst der Kaloriemeter diese Wärme und kann so auf die Reaktionenthalpie schliessen. Bei der endothermen Reaktion ist es genau umgekehrt. Da Energie aufgebracht werden muss, damit die chemische Reaktion ablaufen kann, nehmen die Stoffe Wärme vom Kaloriemeter auf. Mit dieser Wärme lässt sich auf die Reaktionsenthalpie schliessen.
Die Reaktionsenthalpie ΔH bei Verbindungen
Bei Verbindung ist (ΔH0f)die Energie, die frei wird oder die aufgewendet werden muss wenn 1 Mol einer Verbindung aus den Elementen hergestellt wird, aus denen die Verbindung besteht. ΔH = Summe der Produkte - Summe der Edukte (sonst wird ΔH bei einer exothermen Reaktion nicht negativ) Das Berechnen der Reaktionsenthalpie und dasAbschätzen der Reaktionsenthalpie geben uns Auskunft über die Grösse von ΔH.
Beispiel: Verbrennen von Methan CH4
CH4 + 2CO2 → CO2 + 2H2O ΔH = ∑ΔH0f Produkte - ∑ΔH0f Edukte ΔH = [-393+2*(-242)]-[-75+2*(0)]
= [-393(-484)]-[-75] = [-877+75] = -802 kj/Fu
So wird eine chemische Formel geschrieben: (H2SO42-).
Weblinks
Swisseduc– Unterrichtsserver für Chemie Mediawiki Hilfeseite – So kann der Link näher beschrieben werden