Bedeutung der ZMK: Unterschied zwischen den Versionen
(→Wasser als Molekül) |
|||
| (129 dazwischenliegende Versionen von 3 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
== Die seltsamen Eigenschaften von Wasser == | == Die seltsamen Eigenschaften von Wasser == | ||
| − | + | Besondere Eigenschaften von Wasser sind: | |
* Dichteanomalie (Dichtemaximum bei 4°C) | * Dichteanomalie (Dichtemaximum bei 4°C) | ||
| Zeile 10: | Zeile 10: | ||
=== Wasser als Molekül === | === Wasser als Molekül === | ||
| − | Das Wassermolekül H<sub>2</sub>O enthält polare Atombindungen. | + | Das Wassermolekül H<sub>2</sub>O enthält polare Atombindungen. Da der "Elektronenräuber" Sauerstoff das Elektron des Wasserstoffs zu sich herüberzieht entstehen die Partialladung negativ (-) beim Sauerstoffatom und die Partialladung positiv (+) bei den beiden Wasserstoffatomen. Es ist jedoch wichtig, auch die geometrische Struktur des Moleküls zu betrachten. Zwischen den beiden Wasserstoffatomen finden wir einen Winkel von 104.45°. Anders als bei Methan oder Kohlenstoffdioxid, wo die positiven und negativen Pole des Moleküls zusammenfallen, sind die unterschiedlichen Ladungen im Wassermolekül somit räumlich getrennt (Siehe unter "Die Dipol-Dipol- Kräfte" bei [[Zwischenmolekulare Kräfte]]). Diese unsymmetrische Verteilung der Partialladungen führt zu einem permanenten Dipol. |
| + | |||
| + | Die Wasserstoffbrücken, welche noch viel stärker sind, als die Dipol-Dipol-Kräfte verstärken natürlich die ZMK der Wassermoleküle. Es entstehen nämlich Wasserstoffbrücken zwischen den Wasserstoffatomen des einen Moleküls mit einem Elektronenpaar des Sauerstoffs des anderen Moleküls. | ||
| + | |||
| + | === Dichteanomalie des Wassers === | ||
| + | |||
| + | Wasser hat ein Dichtemaximum bei 4°C. Die Dichte nimmt dann also beim Erwärmen, wie auch beim Abkühlen ab. | ||
| + | |||
| + | ==== Gefrorenens Wasser ==== | ||
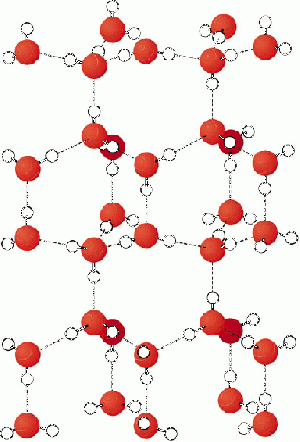
| + | [[image:Eismolekuele.gif|thumb|right|Anordnung der Wassermoleküle im Eiskristall]] | ||
| + | Da im Eis die Wärmeenergie und somit auch die Bewegungsenergie sehr klein sind, sind die H<sub>2</sub>O - Moleküle den Zwischenmolekularen Kräften schutzlos ausgeliefert. Sie werden durch die ZMK möglichst nahe beieinander gehalten. Ein H<sub>2</sub>O - Molekül geht also genau vier H - Brücken ein (Die beiden eigenen Elektronenpaare des Sauerstoffs mit anderen Wasserstoffatomen und die beiden eigenen Wasserstoffatome mit je einem Elektronenpaar eines anderen Sauerstoffes). Durch diese exakte geometrische Anordnung entstehen viele Zwischenräume zwischen den einzelnen Molekülen. Eis "nutzt" sein Volumen also nicht optimal mit Masse. | ||
| + | |||
| + | ==== Flüssiges Wasser ==== | ||
| + | Wenn Eis schmilz, bewegen sich die H<sub>2</sub>O - Moleküle intensiver, da Wärmeenergie und somit auch Bewegungsenergie hinzugeführt werden muss. Viele ZMK können überwunden werden und die Moleküle können sich somit auch in den Zwischenräume der oben erklärten Eisstruktur aufhalten. Dies führt dazu, dass sich das Volumen verkleinert und sich folglich die Dichte erhöht(bis 4°C). | ||
| + | |||
| + | ==== Gasförmiges Wasser ==== | ||
| + | Wir die Temperatur weiterhin erhöht, brauchen die H<sub>2</sub>O - Moleküle mehr Platz. Wenn sich das Volumen vergrössert, nimmt danach auch die Dichte wieder ab. | ||
| + | |||
| + | ==== Bedeutung der Dichteanomalie des Wassers ==== | ||
| + | |||
| + | ===== Überwintern von Lebewesen im Wasser ===== | ||
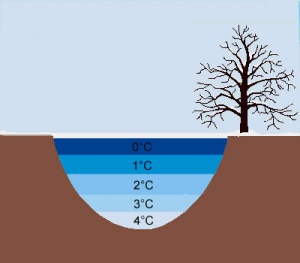
| + | [[image:Teich_gefroren.jpg|thumb|right|Temperaturverteilung bei einem gefrorenen Teich.]] | ||
| + | Besonders für Fische und andere Teich-, See- oder Flussbewohner (auch Amphibien) spielt diese Eigenschaft von Wasser eine grosse Rolle. Im Winter kühlt die kalte Luft das Wasser auf der Oberfläche eines Sees nähmlich ab. Ist das Wasser 4°C kühl, ist die Dichte am grössten und es sinkt nach unten. Auf der Oberfläche kann das Wasser jedoch gefrieren. Durch diese Eisschicht werden die unteren Wasserschichten von noch stärkerer Kühlung der Luft abgeschirmt. Die Lebewesen müssen also keine Angst haben, dass sie in der Winterstarre einfrieren könnten. Da kaltes Wasser viel Sauerstoff speichern kann, können die Tiere am Grunde des Sees überwintern. | ||
| + | |||
| + | ===== Erosion von Gestein/Wüstenbildung ===== | ||
| + | Sand- und Kieswüsten entstanden durch Erosion von grossen Gesteinen und Felsen. Am Tag kann das flüssige Wasser in kleine Ritze des Gesteins eindringen. Da in der Wüste grosse Temperaturschwankungen herrschen, gefriert das Wasser in der Nacht und sein Volumen dehnt sich aus. Ein kleiner Teil des Gesteins wird gesprengt. Geschieht dieser Vorgang über Jahrtausende, kann daraus eine Wüste entstehen. | ||
| + | |||
| + | === Hoher Schmelz- und Siedepunkt === | ||
| + | |||
| + | Wasser schmilz bei 0°C und siedet bei 100°C. Verglichen mit chemisch ähnlich aufgebauten Molekülen ohne Dipol-Dipol-Kräfte und somit auch mit sehr geringen ZMK (Schwefelwasserstoff) ist der Schmelz- und Siedepunkt relativ hoch. Es muss mehr Energie hineingesteckt werden, um den ZMK entgegenzuwirken. | ||
| + | |||
| + | ==== Beteutung des hohen Schmelz- und Siedepunktes bei Wasser ==== | ||
| + | |||
| + | ===== Ohne flüssiges Wasser? Kein Leben! ===== | ||
| + | Hätte Wasser einen tieferen Siedepunkt, gäbe es kein Leben auf der Erde. Wir Menschen bestehen nämlich zu 70% aus flüssigem Wasser. Würde Wasser sieden, würden natürlich unsere Proteine denaturieren und Funktionen wie z.B. der Transport von Stoffen mit Wasser wären natürlich unmöglich. | ||
| + | |||
| + | === Breiter flüssiger Bereich === | ||
| + | Wasser kommt in unserem Umfeld hauptsächlich im flüssigem Aggregatszustand vor. Es ist jedoch die einzige Natürliche Substanz, die auf der Erde im gefrorenen, flüssigen und gasförmigen Zustand vorkommt. | ||
| + | |||
| + | ==== Beteutung des breiten flüssigen Bereiches von Wasser ==== | ||
| + | Wie im obigen Unterkapitel "Ohne Wasser? - Kein Leben!" beschrieben, hängt unser Leben davon ab, dass Wasser auf der Erde auch in flüssiger Form vorkommt. Dadurch, dass Wasser einen breiten flüssigen Bereich von etwa 100°C hat, ist es uns Lebewesen möglich, zwar unter Energieaufwand, jedoch immerhin, unsere Körpertemperaturkonstant zu halten und somit auch immer flüssiges Wasser in uns zu haben. | ||
| + | |||
| + | Wir haben Temperaturschwankungen von etwa 30°C im Sommer auf - 15°C im Winter. Trotzdem bleibt das Wasser in den Flüssen immer noch flüssig und somit können wir Strom mithilfe von Wasserkraft zu jeder Jahreszeit produzieren. | ||
| + | |||
| + | === Wasser als gutes Lösungsmittel für permanente Dipole und Ionen === | ||
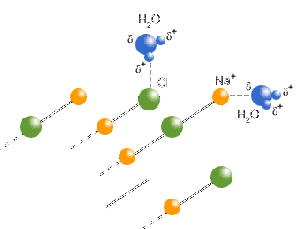
| + | [[image:Ionengitter wird geloest.gif|thumb|right|Ein Ionengitter löst sich im Wasser.]] | ||
| + | Löst sich ein Ionengitter im Wasser auf, so drehen sich die Wassermoleküle so, dass der Sauerstoff (Partialladung -) zum positiven Kation ausgerichtet wird. Kommt ein Wassermolekül in die Nähe eines negativen Anions, so dreht sich das Molekül so, dass der Wasserstoff (Partialladung +) zum Anion hin gerichtet wird (Elektrische Anziehungs- und Abstossungsräfte). Viele Wassermoleküle können somit die Ionen umschliessen und sich danach verteilen und wieder die frühere Struktur mit den Wasserstoffbrücken bilden. Die ZMK werden jedoch schwächer, als am Anfang, da die Ionenladungen den Aufbau von Wasserstoffbrücken zum Teil stören. | ||
| + | |||
| + | ==== Bedeutung des Wassers als gutes Lösungsmittel für permanente Dipole und Ionen ==== | ||
| + | |||
| + | ===== Gewinnung von Salz aus Meerwasser ===== | ||
| + | Salze bestehen aus Ionen. Wer schon einmal Meerwasser geschmeckt hat, weiss, dass das Wassr viele Salze auflösen und speichern kann. Lassen wir Meerwasser verdampfen, bleibt das Salz zurück. Wir können somit quasi gratis Salz gewinnen, um es als Nahrungsmittel oder Dünger zu verwenden. | ||
| + | |||
| + | ===== Bedeutung in unserem Körper ===== | ||
| + | Viele Vitamine(C, B1,B2, H ...) und Mineralien sind wasserlöslich. Obwohl wir sie somit einfach aufnehmen können, werden sie jedoch mit dem Urin wieder ausgeschieden. Die Speicherung ist deshalb nicht gut möglich, sodass wir diese Vitamine täglich zu uns nehmen sollten. | ||
== DNS == | == DNS == | ||
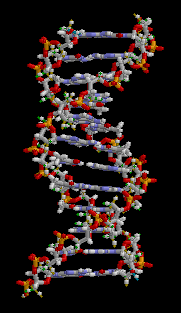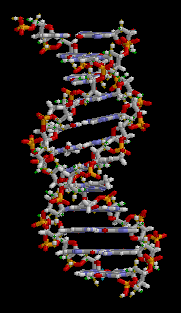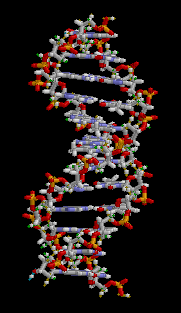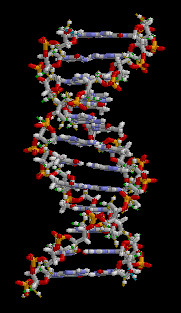
| + | [[Bild:Doppelhelix.gif|right|Doppelhelix-Struktur als 3D]] | ||
| + | Die DNS (Desoxynukleoidsäure) ist der Informationsspeicher unseres Körpers. Sie kommt in jeder Zelle unseres Körpers vor und hat viele lebenswichtige Funktionen für den Körper: | ||
| + | * Bauplan für Proteine | ||
| + | * Weitergeben von Erbeigenschaften an die nächste Generation | ||
| + | * Steuerung der Entwicklung des Körpers(z.B. Geschlechtsreife und Wachstum) | ||
| + | Analogie: Wenn man ein Haus bauen muss, braucht man einen Bauplan,der die Struktur und Entwicklung des Baues enthält. Diese Rolle übernimmt die DNS. Um dann das Haus zu bauen, braucht es natürlich Helfer. Diese Rolle übernehmen die verschiedenen Proteine. | ||
| + | |||
| + | ===Aufbau=== | ||
| + | |||
| + | Die DNS ist ein langes kettenförmiges Molekül, das aus Einzelstücken besteht, die sogenannten Nukleotiden. Solch ein Stück(Stränge) besteht chemisch gesehen aus einem Phosphat und Zucker(bilden zusammen das Rückgrat) und einer von den vier Basen(Adenin, Guanin, Cytosin, Thymin). Die DNS kommt im Normalzustand als schraubenförmige Doppelhelix vor. Zwei Stränge sind dabei in entgegengesetzter Richtung aneinandergebunden. Dadurch stehen sich in der Mitte dieser Doppelhelix stets zwei bestimmte Basen gegenüber. Die Stabilität dieser Struktur wird vor allem durch die Bindung dieser bestimmten Basenpaaren gehalten. Für genauere Erklärungen gehen Sie auf diesen Video[http://www.youtube.com/watch?v=qy8dk5iS1f0&feature=related]. | ||
| + | [[Bild:Basenstruktur.gif|left]] | ||
| + | |||
| + | ===Wasserstoffbrücke zwischen den DNA- Basen=== | ||
| + | |||
| + | Es paaren sich Adenin(A) und Thymin(T), die mit zwei Wasserstoffbrücken verbunden sind, oder Cytosin(C) mit Guanin(G), die über drei Wasserstoffbrücken miteinander verbunden sind. Durch die willkürliche Anordnung dieser Basenpaare in der Doppelhelix kann der Körper diese als Code auffassen. Dieser Code entspricht sozusagen dem Bauplan unseres Körpers, mit dem der Körper die Proteine herstellt. | ||
| + | |||
| + | ===Funktion der Wasserstoffbrücke=== | ||
| + | Die Wasserstoffbrücken spielen eigentlich keine wichtige Rolle bei der Informationsspeicherung. Da aber die Desoxynukleoidsäure leicht chemisch reagieren kann, dienen diese Brücken, die zur Doppelhelix-Struktur führen, als Schutzfunktion vor unbeabsichtigten chemischen Reaktionen.<br><br><br><br><br><br><br> | ||
== Proteine == | == Proteine == | ||
| Zeile 69: | Zeile 141: | ||
=== Strukturen eines Proteins === | === Strukturen eines Proteins === | ||
| − | [[ | + | [[bild:Ueberblick.jpg|thumb|right|220px|[[Bedeutung_der_ZMK#Quellen|Abb. 3]] Überblick über die Strukturen]] |
Die '''Funktion eines Proteins''' ist abhängig von dessen '''3D-Struktur'''. Diese sorgt für die Erfüllung einer für das Protein spezifischen Funktion. '''Dieses Grundprinzip sollte bei allen Überlegungen zu Proteinen berücksichtigt werden.''' | Die '''Funktion eines Proteins''' ist abhängig von dessen '''3D-Struktur'''. Diese sorgt für die Erfüllung einer für das Protein spezifischen Funktion. '''Dieses Grundprinzip sollte bei allen Überlegungen zu Proteinen berücksichtigt werden.''' | ||
| Zeile 102: | Zeile 174: | ||
Das '''fertige Protein in seiner 3D-Form. Die Strukturen entstehen aufgrund intra- und intermolekularer Kräfte durch Wasserstoffbrückenbindungen (und Wechselwirkungen der Aminosäuren).''' Andere Faktoren bestimmen ebenfalls die spezifische Anordnung im Raum: | Das '''fertige Protein in seiner 3D-Form. Die Strukturen entstehen aufgrund intra- und intermolekularer Kräfte durch Wasserstoffbrückenbindungen (und Wechselwirkungen der Aminosäuren).''' Andere Faktoren bestimmen ebenfalls die spezifische Anordnung im Raum: | ||
| − | [[image: | + | [[image:Brueckenbindungen.jpg|thumb|right|220px|[[Bedeutung_der_ZMK#Quellen|Abb. 6]] Übersicht aller Brücken]] |
| Zeile 124: | Zeile 196: | ||
==== Quartärstruktur ==== | ==== Quartärstruktur ==== | ||
| − | [[Bild: | + | [[Bild:Haemoglobin.jpg|thumb|250px|[[Bedeutung_der_ZMK#Quellen|Abb. 7]] Hämoglobin: Ein Komplex aus vier Myoglobin-Proteinen. Andere Visualisierung [http://www.umass.edu/molvis/tutorials/hemoglobin/heme.htm hier (JMol)] ]] |
Mehrere fertige Proteine lagern sich zu einem '''grösseren Proteinkomplex''' aneinander, der aus Untereinheiten besteht. | Mehrere fertige Proteine lagern sich zu einem '''grösseren Proteinkomplex''' aneinander, der aus Untereinheiten besteht. | ||
| Zeile 138: | Zeile 210: | ||
===== Beispiel für Nutzen der Quartärstruktur: Hämoglobin ===== | ===== Beispiel für Nutzen der Quartärstruktur: Hämoglobin ===== | ||
| − | [[Bild: | + | [[Bild:Haembindung.gif|thumb|310px|[[Bedeutung_der_ZMK#Quellen|Abb. 8]] Bindung des Sauerstoffs an das Eisenion]] |
Dass ein Hämoglobin aus vier Hämen und vier Globinen besteht, verschafft einen weiteren Vorteil. | Dass ein Hämoglobin aus vier Hämen und vier Globinen besteht, verschafft einen weiteren Vorteil. | ||
| Zeile 207: | Zeile 279: | ||
== Quellen == | == Quellen == | ||
| + | '''Video''' | ||
| + | * [http://www.youtube.com/watch?v=qy8dk5iS1f0&feature=related, Video zur Strukur des DNS] | ||
'''Medienspezifisch:''' | '''Medienspezifisch:''' | ||
| + | * Abb. Moleküle im Eiskristall: http://www.hamm-chemie.de/images/k9/abb/wbb_eis.gif | ||
| + | * Abb. Gefrorener Teich: http://www.uni-duesseldorf.de/MathNat/Biologie/Didaktik/Wasserhaushalt/dateien/3_transp/3_wasser/bilder/5_dstart.jpg | ||
| + | * Abb. Ionengitter löst sich im Wasser: http://www.chemgapedia.de/vsengine/media/vsc/de/ch/13/pc/praktikum1/loesungswaerme/images/abb1.gif | ||
| + | * Abb. Doppelhelix-Struktur in 3D: http://de.academic.ru/pictures/dewiki/65/ADN_animation.gif | ||
| + | * Abb. Die roten Linien zeigen die Wasserstoffbrücken zwischen den Basenpaaren: http://www.zum.de/Faecher/Materialien/beck/bilder/!dna0000.gif | ||
* Abb. 1: Erstellt von Merlin Schär | * Abb. 1: Erstellt von Merlin Schär | ||
* Abb. 2: http://www.chem.wisc.edu/~newtrad/CurrRef/AIDStopic/AIDSfig/2_06b.gif | * Abb. 2: http://www.chem.wisc.edu/~newtrad/CurrRef/AIDStopic/AIDSfig/2_06b.gif | ||
| Zeile 224: | Zeile 303: | ||
* Überwiegend Chemieunterlagen (c. Proteine; 28.6.06 bis 11.9.2006 Abteilung 05D) | * Überwiegend Chemieunterlagen (c. Proteine; 28.6.06 bis 11.9.2006 Abteilung 05D) | ||
| + | * Chemieunterlagen (DNS; 19.08.2008 Abteilung 07H) | ||
'''''Als zusätzliche Stütze haben uns gedient:''''' | '''''Als zusätzliche Stütze haben uns gedient:''''' | ||
| Zeile 239: | Zeile 319: | ||
Erstellt von Merlin Schär und Giuseppe Spinella im Juni 2007, revidiert im Sommer 2008. | Erstellt von Merlin Schär und Giuseppe Spinella im Juni 2007, revidiert im Sommer 2008. | ||
| − | Für eine optimale Darstellung des Artikels empfehlen wir '''Firefox 3'''. | + | Für eine optimale Darstellung des Artikels empfehlen wir '''Firefox 3'''. |
== Weblinks == | == Weblinks == | ||
Aktuelle Version vom 18. Mai 2020, 19:47 Uhr
Inhaltsverzeichnis
- 1 Die seltsamen Eigenschaften von Wasser
- 2 DNS
- 3 Proteine
- 4 Quellen
- 5 Weblinks
Die seltsamen Eigenschaften von Wasser
Besondere Eigenschaften von Wasser sind:
- Dichteanomalie (Dichtemaximum bei 4°C)
- hoher Schmelz- und Siedepunkt
- breiter flüssiger Bereich
- gutes Lösungsmittel für permanente Dipole und Ionen
Wasser als Molekül
Das Wassermolekül H2O enthält polare Atombindungen. Da der "Elektronenräuber" Sauerstoff das Elektron des Wasserstoffs zu sich herüberzieht entstehen die Partialladung negativ (-) beim Sauerstoffatom und die Partialladung positiv (+) bei den beiden Wasserstoffatomen. Es ist jedoch wichtig, auch die geometrische Struktur des Moleküls zu betrachten. Zwischen den beiden Wasserstoffatomen finden wir einen Winkel von 104.45°. Anders als bei Methan oder Kohlenstoffdioxid, wo die positiven und negativen Pole des Moleküls zusammenfallen, sind die unterschiedlichen Ladungen im Wassermolekül somit räumlich getrennt (Siehe unter "Die Dipol-Dipol- Kräfte" bei Zwischenmolekulare Kräfte). Diese unsymmetrische Verteilung der Partialladungen führt zu einem permanenten Dipol.
Die Wasserstoffbrücken, welche noch viel stärker sind, als die Dipol-Dipol-Kräfte verstärken natürlich die ZMK der Wassermoleküle. Es entstehen nämlich Wasserstoffbrücken zwischen den Wasserstoffatomen des einen Moleküls mit einem Elektronenpaar des Sauerstoffs des anderen Moleküls.
Dichteanomalie des Wassers
Wasser hat ein Dichtemaximum bei 4°C. Die Dichte nimmt dann also beim Erwärmen, wie auch beim Abkühlen ab.
Gefrorenens Wasser
Da im Eis die Wärmeenergie und somit auch die Bewegungsenergie sehr klein sind, sind die H2O - Moleküle den Zwischenmolekularen Kräften schutzlos ausgeliefert. Sie werden durch die ZMK möglichst nahe beieinander gehalten. Ein H2O - Molekül geht also genau vier H - Brücken ein (Die beiden eigenen Elektronenpaare des Sauerstoffs mit anderen Wasserstoffatomen und die beiden eigenen Wasserstoffatome mit je einem Elektronenpaar eines anderen Sauerstoffes). Durch diese exakte geometrische Anordnung entstehen viele Zwischenräume zwischen den einzelnen Molekülen. Eis "nutzt" sein Volumen also nicht optimal mit Masse.
Flüssiges Wasser
Wenn Eis schmilz, bewegen sich die H2O - Moleküle intensiver, da Wärmeenergie und somit auch Bewegungsenergie hinzugeführt werden muss. Viele ZMK können überwunden werden und die Moleküle können sich somit auch in den Zwischenräume der oben erklärten Eisstruktur aufhalten. Dies führt dazu, dass sich das Volumen verkleinert und sich folglich die Dichte erhöht(bis 4°C).
Gasförmiges Wasser
Wir die Temperatur weiterhin erhöht, brauchen die H2O - Moleküle mehr Platz. Wenn sich das Volumen vergrössert, nimmt danach auch die Dichte wieder ab.
Bedeutung der Dichteanomalie des Wassers
Überwintern von Lebewesen im Wasser
Besonders für Fische und andere Teich-, See- oder Flussbewohner (auch Amphibien) spielt diese Eigenschaft von Wasser eine grosse Rolle. Im Winter kühlt die kalte Luft das Wasser auf der Oberfläche eines Sees nähmlich ab. Ist das Wasser 4°C kühl, ist die Dichte am grössten und es sinkt nach unten. Auf der Oberfläche kann das Wasser jedoch gefrieren. Durch diese Eisschicht werden die unteren Wasserschichten von noch stärkerer Kühlung der Luft abgeschirmt. Die Lebewesen müssen also keine Angst haben, dass sie in der Winterstarre einfrieren könnten. Da kaltes Wasser viel Sauerstoff speichern kann, können die Tiere am Grunde des Sees überwintern.
Erosion von Gestein/Wüstenbildung
Sand- und Kieswüsten entstanden durch Erosion von grossen Gesteinen und Felsen. Am Tag kann das flüssige Wasser in kleine Ritze des Gesteins eindringen. Da in der Wüste grosse Temperaturschwankungen herrschen, gefriert das Wasser in der Nacht und sein Volumen dehnt sich aus. Ein kleiner Teil des Gesteins wird gesprengt. Geschieht dieser Vorgang über Jahrtausende, kann daraus eine Wüste entstehen.
Hoher Schmelz- und Siedepunkt
Wasser schmilz bei 0°C und siedet bei 100°C. Verglichen mit chemisch ähnlich aufgebauten Molekülen ohne Dipol-Dipol-Kräfte und somit auch mit sehr geringen ZMK (Schwefelwasserstoff) ist der Schmelz- und Siedepunkt relativ hoch. Es muss mehr Energie hineingesteckt werden, um den ZMK entgegenzuwirken.
Beteutung des hohen Schmelz- und Siedepunktes bei Wasser
Ohne flüssiges Wasser? Kein Leben!
Hätte Wasser einen tieferen Siedepunkt, gäbe es kein Leben auf der Erde. Wir Menschen bestehen nämlich zu 70% aus flüssigem Wasser. Würde Wasser sieden, würden natürlich unsere Proteine denaturieren und Funktionen wie z.B. der Transport von Stoffen mit Wasser wären natürlich unmöglich.
Breiter flüssiger Bereich
Wasser kommt in unserem Umfeld hauptsächlich im flüssigem Aggregatszustand vor. Es ist jedoch die einzige Natürliche Substanz, die auf der Erde im gefrorenen, flüssigen und gasförmigen Zustand vorkommt.
Beteutung des breiten flüssigen Bereiches von Wasser
Wie im obigen Unterkapitel "Ohne Wasser? - Kein Leben!" beschrieben, hängt unser Leben davon ab, dass Wasser auf der Erde auch in flüssiger Form vorkommt. Dadurch, dass Wasser einen breiten flüssigen Bereich von etwa 100°C hat, ist es uns Lebewesen möglich, zwar unter Energieaufwand, jedoch immerhin, unsere Körpertemperaturkonstant zu halten und somit auch immer flüssiges Wasser in uns zu haben.
Wir haben Temperaturschwankungen von etwa 30°C im Sommer auf - 15°C im Winter. Trotzdem bleibt das Wasser in den Flüssen immer noch flüssig und somit können wir Strom mithilfe von Wasserkraft zu jeder Jahreszeit produzieren.
Wasser als gutes Lösungsmittel für permanente Dipole und Ionen
Löst sich ein Ionengitter im Wasser auf, so drehen sich die Wassermoleküle so, dass der Sauerstoff (Partialladung -) zum positiven Kation ausgerichtet wird. Kommt ein Wassermolekül in die Nähe eines negativen Anions, so dreht sich das Molekül so, dass der Wasserstoff (Partialladung +) zum Anion hin gerichtet wird (Elektrische Anziehungs- und Abstossungsräfte). Viele Wassermoleküle können somit die Ionen umschliessen und sich danach verteilen und wieder die frühere Struktur mit den Wasserstoffbrücken bilden. Die ZMK werden jedoch schwächer, als am Anfang, da die Ionenladungen den Aufbau von Wasserstoffbrücken zum Teil stören.
Bedeutung des Wassers als gutes Lösungsmittel für permanente Dipole und Ionen
Gewinnung von Salz aus Meerwasser
Salze bestehen aus Ionen. Wer schon einmal Meerwasser geschmeckt hat, weiss, dass das Wassr viele Salze auflösen und speichern kann. Lassen wir Meerwasser verdampfen, bleibt das Salz zurück. Wir können somit quasi gratis Salz gewinnen, um es als Nahrungsmittel oder Dünger zu verwenden.
Bedeutung in unserem Körper
Viele Vitamine(C, B1,B2, H ...) und Mineralien sind wasserlöslich. Obwohl wir sie somit einfach aufnehmen können, werden sie jedoch mit dem Urin wieder ausgeschieden. Die Speicherung ist deshalb nicht gut möglich, sodass wir diese Vitamine täglich zu uns nehmen sollten.
DNS
Die DNS (Desoxynukleoidsäure) ist der Informationsspeicher unseres Körpers. Sie kommt in jeder Zelle unseres Körpers vor und hat viele lebenswichtige Funktionen für den Körper:
- Bauplan für Proteine
- Weitergeben von Erbeigenschaften an die nächste Generation
- Steuerung der Entwicklung des Körpers(z.B. Geschlechtsreife und Wachstum)
Analogie: Wenn man ein Haus bauen muss, braucht man einen Bauplan,der die Struktur und Entwicklung des Baues enthält. Diese Rolle übernimmt die DNS. Um dann das Haus zu bauen, braucht es natürlich Helfer. Diese Rolle übernehmen die verschiedenen Proteine.
Aufbau
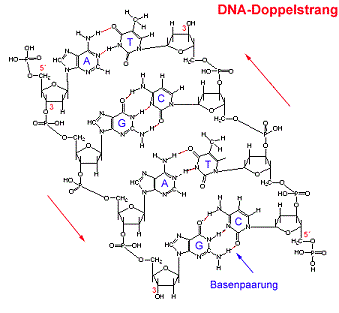
Die DNS ist ein langes kettenförmiges Molekül, das aus Einzelstücken besteht, die sogenannten Nukleotiden. Solch ein Stück(Stränge) besteht chemisch gesehen aus einem Phosphat und Zucker(bilden zusammen das Rückgrat) und einer von den vier Basen(Adenin, Guanin, Cytosin, Thymin). Die DNS kommt im Normalzustand als schraubenförmige Doppelhelix vor. Zwei Stränge sind dabei in entgegengesetzter Richtung aneinandergebunden. Dadurch stehen sich in der Mitte dieser Doppelhelix stets zwei bestimmte Basen gegenüber. Die Stabilität dieser Struktur wird vor allem durch die Bindung dieser bestimmten Basenpaaren gehalten. Für genauere Erklärungen gehen Sie auf diesen Video[1].
Wasserstoffbrücke zwischen den DNA- Basen
Es paaren sich Adenin(A) und Thymin(T), die mit zwei Wasserstoffbrücken verbunden sind, oder Cytosin(C) mit Guanin(G), die über drei Wasserstoffbrücken miteinander verbunden sind. Durch die willkürliche Anordnung dieser Basenpaare in der Doppelhelix kann der Körper diese als Code auffassen. Dieser Code entspricht sozusagen dem Bauplan unseres Körpers, mit dem der Körper die Proteine herstellt.
Funktion der Wasserstoffbrücke
Die Wasserstoffbrücken spielen eigentlich keine wichtige Rolle bei der Informationsspeicherung. Da aber die Desoxynukleoidsäure leicht chemisch reagieren kann, dienen diese Brücken, die zur Doppelhelix-Struktur führen, als Schutzfunktion vor unbeabsichtigten chemischen Reaktionen.
Proteine
Gesamtüberblick
Definition
Proteine sind durch die Verkettung von Aminosäuren gebildete Makromoleküle und Grundbausteine aller Zellen.
Die AS-Ketten erreichen eine Länge von bis zu mehreren tausend AS, wobei solche mit einer Länge bis zu 100 AS als Peptide bezeichnet werden.
Die Abfolge für die Aminosäuren für ein bestimmtes Protein ist in Form von Genen in der DNS codiert.
Vielfalt
Die Funktion eines Proteins wird durch dessen räumliche Struktur bestimmt. Diese resultiert aus der Abfolge der AS und Länge der Aminosäureketten. Da die Kombinationsmöglichkeiten der AS-Verkettung - schon alleine mit den im menschlichen Körpervorkommenden Aminosäuren - sehr gross sind und somit auch die räumliche Struktur, können Proteine entsprechend ihrer Form die verschiedensten Funktionen erfüllen. Die Aminosäuren untereinander haben wiederum unterschiedliche chemische Eigenschaften, woraus eine weitere Variabilität der AS-Ketten und somit der Form und Funktion von Proteinen entsteht.
Funktion
Proteine erfüllen vielfältige lebenswichtige Funktionen und sind Hauptbestandteil aller Zellen - ob in der Körperabwehr, beim Transport von Stoffen, als Signal-, Membran- und Strukturproteine oder auch Enzyme. Es ist deshalb auch entscheidend, welche Proteine in welcher Konzentration in einer Zelle vorkommen; denn sie bestimmen auch deren Form (Aussehen) und Funktion. Manche spezialisierte Proteine, sogenannte Transkriptionsfaktoren, können sogar die Ablesehäufigkeit bestimmter Gene regulieren und somit die Konzentration eines bestimmten Proteins in einer Zelle verändern.
Peptidbindung
Proteine sind aufgebaut aus - durch Peptidbindung vernetzten - Aminosäuren.
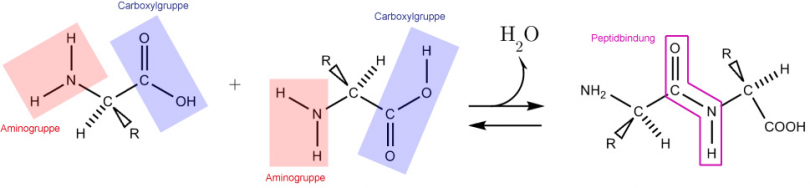
Bindungsschema (Siehe Abb. 1)
Schema der Reaktion (Vernetzung zweier Aminosäuren):
Aminogruppe (NH2) der 1. AS + Carboxylgruppe (COOH) (Säuregruppe) 2. AS
Aminogruppe (NH2) 2. AS + Carboxylgruppe (COOH) (Säuregruppe) 1. AS
Das strukturtypische Merkmal eines Peptids ist die Peptidbindung. Eine Peptidbindung (-CO-NH-) ist eine Bindung zwischen der Carboxylgruppe einer Aminosäure und der Aminogruppe einer zweiten.
Bei der Verbindung der beiden Aminosäuren läuft eine Kondensationsreaktion ab (es findet eine Abspaltung von H2O statt). Die Umkehrung dieser Reaktion wäre eine Hydrolyse. Die treibende Kraft dabei ist ein Abschied; nämlich das Weggehen einesenergiearmen H2O-Moleküls. Das entstandene Peptid besitzt wiederum eine Carboxylgruppe, welche erneut mit einer weiteren Aminosäure eine weitere Peptidbindung eingehen kann. Auf diese Weise entstehen längere Peptide und schliesslich grössere Proteine.
Ein analoges Prinzip zur Peptidbindung bietet die "Brio-Eisenbahn". Aminosäuren werden wie die Wagons aneinandergehängt und kombiniert.
Insgesamt gibt es 20 verschiedene AS, die sich durch ihre Reste (R) unterscheiden. Wenn die Reste gross werden, stören sich diejenigen zweier Aminosäuren. Sind Reste

polar/unpolar (H-Brücken-fähig/-unfähig), so kann entschieden werden, ob sie hydrophil oder hydrophob sind: polare Reste sind hydrophil, unpolare Reste hydrophob (Zur Erinnerung: Wasser ist ein polarer Stoff).
Im Körper wird die Reaktion durch Enzyme - ebenfalls Proteine! - beschleunigt.
Das Grundgerüst der Proteine bildet das Backbone ("Rückgrat mit Füsschen").
Strukturen eines Proteins
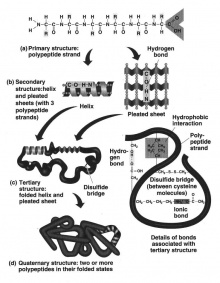
Die Funktion eines Proteins ist abhängig von dessen 3D-Struktur. Diese sorgt für die Erfüllung einer für das Protein spezifischen Funktion. Dieses Grundprinzip sollte bei allen Überlegungen zu Proteinen berücksichtigt werden.
Bei der Proteinfaltung während und nach der Proteinbiosynthese erhält das Protein die 3D-Struktur. Zusätzlich helfen Chaperones-Proteine ("Anstandsdamen") den neuen Proteinen, sich korrekt zu falten (die Bezeichnung "Chaperone" wurde gewählt, weil diese unreife Proteine "vor schädlichen Kontakten bewahren"). Zur Veranschaulichung der Strukturen empfehlen wir diese Seite (Voraussetzungen: Internet Explorer + Chime PlugIn).
Oft herrscht Verwirrung über die Einteilung der Kräfte in inter- und intramolekulare Kräfte, die in Sekundär-, Tertiär-, und Quartärstrukturen wirken. Intramolekulare Kräfte wirken innerhalb eines einzelnen Moleküls, intermolekulare Kräfte zwischen zwei Molekülen. Hier ein Überblick der Strukturen:
Primärstruktur
Als Primärstruktur wird die Abfolge der einzelnen Aminosäuren eines Proteins bezeichnet.
Sekundärstruktur
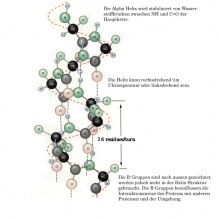
Die Anordnung der Aminosäuresequenzen im Molekül. Die Aminosäuresequenzen werden mit H-Brücken verbunden. Daraus resultieren folgende zwei wichtigen lokalen Struktureinheiten:
α-Helix
Die α-Helix wird durch intramolekulare H-Brücken zwischen den NH- und den CO-Gruppen der Hauptkette stabilisiert. Die CO-Gruppe jeder Aminosäure bildet eine H-Brücke zur NH-Gruppe der Aminosäure.
β-Faltblatt (engl.: β-Sheet)

Zwei AS-Ketten liegen parallel zueinander. Dadurch wird die Bildung intermolekularer (=zwischenmolekularer) H-Brücken zwischen NH- und CO-Gruppen der Peptidbindungen möglich. Eine faltblattartige Struktur entsteht durch diese Kräfte. β-Faltblätter liegen intermolekular oder intramolekular vor. Sie können intermolekular auftreten, wenn zwei AS-Ketten nebeneinander liegen.
Tertiärstruktur
Das fertige Protein in seiner 3D-Form. Die Strukturen entstehen aufgrund intra- und intermolekularer Kräfte durch Wasserstoffbrückenbindungen (und Wechselwirkungen der Aminosäuren). Andere Faktoren bestimmen ebenfalls die spezifische Anordnung im Raum:
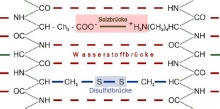
Disulfidbrücken: Stärkste Klammern, die das Protein zusammenhalten. Können durch Enzyme geöffnet werden (Abbau Proteine im Magen und Darm). Unpolare Bindung, schwache EPB. ZMK-Kategorie, intramolekulare Kräfte!
Salzbrücken: Ionenbindungen, welche das Protein ebenfalls sehr stark stabilisieren.
Wasserstoffbrücken:Sind zahlenmässig am wichtigsten.
Hydrophobe Wechselwirkungen: Ausschlusskräfte. Umgeben von Wasser werden Bereiche ausgeschlossen, die keine H-Brücken bilden können, von denen, die es können [2]. Nicht H-Brücken- fähige Teile des Proteins bleiben durch Ausschluss zusammen. Intermolekular werden H-Brücken mit dem Wasser gebildet. Wenn ein Protein mit H2O umgeben ist und es eine Kugel bildet, sind die hydrophoben AS innen und hydrophile (weiter) draussen. Die AS-Kette formt sich so, dass unpolare (hydrophobe, H-Brücken-unfähige) Teile möglichst nicht mit dem Wasser in Kontakt kommen, also in der Mitte verbleiben. Es gilt: lipophil = hydrophob = H-Brücken-unfähig und hydrophil = lipophob = H-Brücken-fähig.
So vielfältig die Funktionen der Proteine durch ihre 3D-Struktur sind, so gross ist auch die Formenvielfalt der Tertiärstrukturen [3].
Quartärstruktur
Mehrere fertige Proteine lagern sich zu einem grösseren Proteinkomplex aneinander, der aus Untereinheiten besteht.
Vier Myoglobin-Proteine bilden den Proteinkomplex Hämoglobin (eine Quartärstruktur). Durch die Entwicklung einer Quartärstruktur kann die O2-Versorgung mittels Hämoglobin noch effektiver verlaufen. Hämoglobin wird in roten Blutkörperchen verpackt, welche verschwenderisch verwendet werden, da die O2-Versorgung sehr wichtig ist.
Das Hämoglobin enthält vier Scheiben (Häme). Ein Häm beinhaltet ein Eisenion (Fe2+), an welches sich Sauerstoff (Elektronen-"Gierschlund") binden kann. Ebenfalls enthält das Hämoglobin vier Globine. Die Bindung C-O ist stärker als Fe-O (das Zellgift Kohlenmonoxid würde irreversibel an Hämoglobin gebunden). Das Globin verschiebt die Bindungsstärke zugunsten von Sauerstoff und zu Ungunsten von Kohlenmonoxid (Schutzfunktion). Das Hämoglobin resp. das Myoglobin nimmt O2 von der Lunge auf [4] und transportiert ihn zu den verbrauchenden Geweben. Mehr Hämoglobin führt zu schnellerer O2-Versorgung. Bei Rauchern ist ein Prozentsatz des Hämoglobins bereits "kaputt", da eine CO-Bindung stattgefunden hat. Häme können also O2 (starke Bindung) und CO (noch stärkere Bindung) binden.
Beispiel für Nutzen der Quartärstruktur: Hämoglobin

Dass ein Hämoglobin aus vier Hämen und vier Globinen besteht, verschafft einen weiteren Vorteil. Die Bindung von O2 an eine Untereinheit erhöht das Mass für die Bindungsstärke für das O2 der übrigen Untereinheiten (zwischen den Bindungspartnern). Der letzte Sauerstoff wird also am stärksten gebunden. Die anfängliche Steigung der Kurve ist tief, da die Untereinheiten des Hämoglobins unabhängig voneinander um das erste O2 kämpfen. Ein gebundenes O2 Molekül an einer Untereinheit erhöht das Mass für die Bindungsstärke der anderen, was dann zu einer grösseren Steigung führt. Die Quartärstruktur macht Sinn genau dieses Tricks wegen. Wenn alle vier gebunden sind, sind die räumlichen Verhältnisse optimal (Abstände!).
Protein-Denaturierung
Verlust der 3D-Struktur führt unweigerlich zum Verlust der Funktion. Wenn zwei Proteine nach der Denaturierung mit lipophilen Aminosäuren aussen zusammenkommen, können sie verkleben. Verklebung (Klumpen, Verklumpung); es entsteht eine neue Einheit. Viele Krankheiten hängen damit zusammen (Alzheimer, Parkinson, BSE).
Faktoren, die Denaturierung bewirken
Temperatur
Aufgrund der zunehmenden Teilchenbewegung reichen die Kräfte irgendwann nicht mehr aus, um die Struktur beizubehalten. Beispiel: Hat ein Säugling hohes Fieber, so sollte man ihn kühlen. Bei hohen Temperaturen nimmt die Fe-Versorgung ab, was zueiner kleineren Fe-Konzentration führt. Der Körper hat Vorräte, doch die Bakterien werden so ausgehungert. Der Körper hält mehr aus, Bakterien profitieren mehr von höherer Temperatur, da sie schneller wachsen, die Eisenzufuhr jedoch wird aber mit Fieber eingedämmt. Am besten man lässt dem Körper Zeit. Ab einer bestimmten Temperatur aber werden die Proteine im Körper denaturiert! Dies führt oft bei viralen Infekten zum Tode.
Änderung des pH-Wertes (z.B. durch Säuren) und daraus resultierende Veränderung der Eigenschaften von Wasser
Hintergrund zu pH-Wert: Es gibt AS, die durch Basen ihre Eigenschaft ändern (von lipophil zu hydrophil, oder umgekehrt). Wenn das passiert, kehren sich zum Teil Teile von innen nach aussen oder umgekehrt. Wiederum ist eine Verklumpung zu beobachten. Bsp.: Pepsin (Verdauungsenzym), das Proteine zerschneidet. Die Form des Proteins ist bei neutralem pH-Wert nicht im Einsatz, erst wenn es in saure Umgebung kommt, wird es aktiviert (wie Sicherung einer Pistole). Wenn der pH-Wert stimmt, beginnen bestimmte Proteine erst zu wirken und nehmen ihre aktive Form an. Milch denaturiert (Flocken), indem sie sauer wird. Säure kann Proteine denaturieren, nachher sind sie verklebt. Wenn Alkohol zur Milch gegeben wird, werden die H-Brücken zwischen Protein und Wasser zu stark gelockert, wiederum findet eine Verklumpung statt. Alkohol (und andere Lösungsmittel) führt dazu, dass weniger H-Brücken eingegangen werden (H-Brücken ausserhalb werden abgeschwächt (lipophiler Fleck kann beispielsweise mit Alkohol gereinigt werden).
Krankheiten durch Protein-Denaturierung: BSE

Zelluläre Prionen und infektiöse Prionen
Prionen sind Proteine, die auf der Aussenseite der Nervenzellen des Gehirns sitzen. Wenn sie durch infektiöse Prionen in schädliche Prionen (PRPsc) umgewandelt werden, können sie Krankheiten auslösen.
PRPsc: Protease resistant protein, sc: scrapie (scrapie-Form)
PRPc: Protease resistant protein, c: cellular (zelluläre Form)
Die Primärstruktur von beiden Prionen ist gleich, doch ihre 3D-Struktur ist verschieden (siehe Abb. 9).
Von Scrapie zu BSE
Scrapie ist eine Krankheit von Schafen, bei welcher diese beginnen, sich blutig zu kratzen und zu torkeln. Ausserdem weisen sie eigenartige Verhaltensweisen auf und sterben schliesslich. Scrapie gibt es schon sehr lange und ist keine Gefahr für uns. Tote Tiere werden aber anschliessend vermahlen und anderen verabreicht (z.B. Kühen als Kraftfutter). Man gibt Rindern also mehlartiges Zusatzfutter tierischen Ursprungs; auch tote Schafe, die an „scrapie“ gestorben sind. Beim Essen von Schafen mit Scrapie geschieht nichts (höhere Säugetiere haben Prionen, die unterschiedlich sind, einige AS anders). Prionen der Rinder sind unseren jedoch ähnlicher. Die infektiösen Proteine können nicht wie andere in unserem Magen durch Prothease bis auf die Aminosäuren zerschnitten werden; diese Eigenschaft macht sie gefährlich. Sie sind resistent gegen Hitze von über 100° C und Säure; dies aufgrund ihrer äusserst stabilen Struktur. Nun übertrug sich das infektiöse Prion von Schafen auf Rinder. Die Krankheit, welche durch PRPsc bei Rindern ausgelöst wird, nennen wir BSE (Bovine Sponpngorme Enzephalopathie). BSE verursacht Nervensystem- und Gehirnschäden. Krankheiten können allgemein drei Ursachenhaben, nämlich Bakterien, Viren oder Stoffwechsel. Es wurden aber bei BSE-Befallenen keine Bakterien oder Viren gefunden. Esmuss aber einen Organismus geben, der sich reproduziert und dem Körper Schaden zufügt. Vermutung: Proteine (angefeindete Hypothese, früher als ketzerisch angeschaut). Die Suche hat tatsächlich eine vierte Ursache, nämlich ein Protein, ergeben - PRPsc.
Aufnahme und Vervielfältigung
Da das PRPsc sehr stabile Strukturen aufweist, ist es "prothease resistant", wird also von den Protheasen im Magen nicht in die AS zerlegt. Somit überbesteht es den Verdauungstrakt unbeschadet. Proteine sind grosse Teilchen; damit ein Stoff wirklich aufgenommen wird, muss es auch durch die Membrane ins Blut. Trick: Das infektiöse Prion ist einem Protein ähnlich, das aktiv aufgenommen wird.
Dass die Reise bis ins Gehirn führt, ist sehr unwahrscheinlich, da das grosse Teilchen, das Prion, durch Sicherheitsschranken gelangen muss, so z.B. die Blut-Gehirn-Schranke (bewahrt vor Schadstoffen aus dem Blut), welche toxikologische Relevanz besitzt. Der Weg durch den Körper sieht folgendermassen aus: (1) Verdauungstrakt (2) Resorption (vom Verdauungstrakt ins Blut) und (3)Wanderung ins Gehirn.
Wenn das grosse Protein diese Schranke überwindet, kann es zu einer Vermehrung kommen: Das falsche infektiöse Prion vom Rind kommt in Kontakt mit dem richtigen Prion des Menschen. Dabei wird das richtige ebenfalls falsch (die Kräfte werden durch denKontakt so, dass das richtige in die falsche 3D-Form fällt). Schema: richtig – falsch → falsch – falsch. Ein Prion, das „falsch wurde“, ist aber noch nicht weiter schlimm. Die Ansteckung/Vermehrung besteht darin, dass viele „richtige“ Proteine in „falsche“umgeformt werden.
PRPc (Mensch) → Kontakt mit PRPsc (Mensch) → wird auch zu PRPsc
Der Vermehrungsvorgang beschleunigt sich selbst und wird als Katalyse bezeichnet. Die kranken Prionen wirken dabei wie ein Katalysator. "Der Körper löscht sich sozusagen selbst aus."

Es kommt zu einer Verklebung von Proteinen bei der Denaturierung. Dies führt zu Ablagerungen im Gehirn. Andere Zellen werden am Wachsen gehindert. Sie sterben ab, weil der Abfall nicht entsorgt wird, es findet keine Versorgung statt. Transportvorgänge der Zellen gestört! „Löcher“ entstehen im Gehirn (schwammartig, "spongiform"). Das Verhalten wird verändert, Erinnerungen gehen verloren, etc. Ein Paradebeispiel dafür, dass eine kleine Änderung der Form massive Auswirkungen haben kann!
Bei Alzheimer werden ebenfalls Proteine verformt, genauso bei Multipler Sklerose. Es kommt auch dort zu Ablagerungen. Veränderte Form führt zur Denaturierung, welche wiederum zu Ablagerungen führt. Dies ist bei vielen Krankheiten so. Viren und Bakterien sind leicht zu bekämpfen, doch körpereigene Stoffe nur sehr mühsam.
Quellen
Video
Medienspezifisch:
- Abb. Moleküle im Eiskristall: http://www.hamm-chemie.de/images/k9/abb/wbb_eis.gif
- Abb. Gefrorener Teich: http://www.uni-duesseldorf.de/MathNat/Biologie/Didaktik/Wasserhaushalt/dateien/3_transp/3_wasser/bilder/5_dstart.jpg
- Abb. Ionengitter löst sich im Wasser: http://www.chemgapedia.de/vsengine/media/vsc/de/ch/13/pc/praktikum1/loesungswaerme/images/abb1.gif
- Abb. Doppelhelix-Struktur in 3D: http://de.academic.ru/pictures/dewiki/65/ADN_animation.gif
- Abb. Die roten Linien zeigen die Wasserstoffbrücken zwischen den Basenpaaren: http://www.zum.de/Faecher/Materialien/beck/bilder/!dna0000.gif
- Abb. 1: Erstellt von Merlin Schär
- Abb. 2: http://www.chem.wisc.edu/~newtrad/CurrRef/AIDStopic/AIDSfig/2_06b.gif
- Abb. 3: http://cropandsoil.oregonstate.edu/classes/css430/lecture%209-07/figure-09-03.JPG
- Abb. 4: Molecular Biology of the Cell by Garland Science, vereinfacht und übersetzt von Merlin Schär und Giuseppe Spinella
- Abb. 5: Molecular Biology of the Cell by Garland Science
- Abb. 6: http://www.filzlexikon.de/fillex/wolle/chemie/gif/brueckbind.gif, verändert und vereinfacht
- Abb. 7: http://fig.cox.miami.edu/~cmallery/150/protein/Hb-scan.jpg
- Abb. 8: Erstellt von Merlin Schär und Giuseppe Spinella
- Abb. 9: Elektronische Unterlagen zu Proteinen von Hr. Deuber, verändert von Merlin Schär
- Abb. 10: http://www.scheffel.og.bw.schule.de/faecher/science/biologie/proteine_enzyme/7prionen/prion4.gif
Allgemeine Informationen:
- Überwiegend Chemieunterlagen (c. Proteine; 28.6.06 bis 11.9.2006 Abteilung 05D)
- Chemieunterlagen (DNS; 19.08.2008 Abteilung 07H)
Als zusätzliche Stütze haben uns gedient:
- Microsoft Encarta Enzyklopädie Professional 2005
- http://www.tgs-chemie.de/proteine.htm [5]
- http://www.chemgapedia.de/vsengine/topics/de/vlu/index.html[6]
- http://www.bioc.unizh.ch/nanowelt/[7]
- http://www.swisseduc.ch/chemie/[8]
- http://www.vetmed.uni-giessen.de/biochem/Folien/Folie3-4.png[9]
- http://instruct1.cit.cornell.edu/courses/biog105/pages/demos/105/unit1/media/folding-protein.jpg [10]
- http://n.ethz.ch/student/meierdan/download/Bio1B/Voet/proteinfunktion.doc[11]
- http://flexikon.doccheck.com/Peptidbindung[12]
Erstellt von Merlin Schär und Giuseppe Spinella im Juni 2007, revidiert im Sommer 2008.
Für eine optimale Darstellung des Artikels empfehlen wir Firefox 3.
Weblinks
- Swisseduc – Unterrichtsserver für Chemie
- Molecular Modelling, Einführung in die Biochemie [13]
- Für die Klasse 05D die nützlichen Animationen auf dem BSCW [14]
- Seite des Biochemischen Institutes Zürich, mit 3D-Modellen von Proteinen und Informationen zu 3D-Modellierungs-Programmen [15]
- Chime PlugIn-Download für ältere Web-Animationen (Internet Explorer) [16]