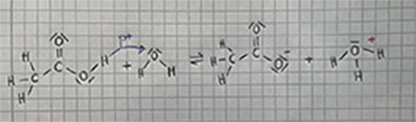Grundlagen: Unterschied zwischen den Versionen
Cyril (Diskussion | Beiträge) |
(→Einige Säuren und ihre konjugierten Basen) |
||
| (167 dazwischenliegende Versionen von 3 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
== Säure-Base-Reaktion == | == Säure-Base-Reaktion == | ||
| − | Eine Säure-Base-Reaktion ist eine | + | Eine Säure ist ein (H<sup>+</sup>) Protonenspender und eine Base ist ein (H<sup>+</sup>) Protonenempfänger. |
| + | Eine Säure-Base-Reaktion ist eine Protonenübertragungsreaktion zwischen einer Säure und einer Base, auch <b>Protolyse</b> genannt. Dabei gibt die Säure ein Proton (H<sup>+</sup>), ab während die Base dieses Proton aufnimmt. | ||
| + | |||
| + | Anhand dieser Säure-Base-Reaktion sieht man, wie der Protonenübergang verläuft: | ||
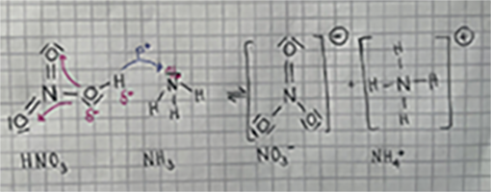
Säure: HNO<sub>3</sub> + Base: NH<sub>3</sub> ⇌ Base: NO<sub>3</sub><sup>-</sup> + Säure: NH<sub>4</sub><sup>+</sup> | Säure: HNO<sub>3</sub> + Base: NH<sub>3</sub> ⇌ Base: NO<sub>3</sub><sup>-</sup> + Säure: NH<sub>4</sub><sup>+</sup> | ||
| − | + | [[Datei:Kräfteverhältniss.png]] | |
| − | |||
| − | Säure | + | Sauerstoff gehört zu der Elektronenräuberbande. In der starken O-H-Bindung des Moleküls besitzt das H-Atom eine stark positive Partialladung, somit kann das Proton leicht von der Säure getrennt werden. Ausserdem steht ein freies Elektronenpaar im Molekül NH<sub>3</sub> zur Verfügung. Das Proton (H<sup>+</sup>) lagert sich an das naheliegende freie Elektronenpaar (das negativ geladen ist) an. Dadurch wird das Proton beim Zusammenstossen von dem Ammoniak-Molekül aufgenommen. Die Säure wird nach Abgabe eines Protons zu einer Base, die Base hingegen nach der Aufnahme eben dieses Protons wieder zu einer Säure. Zudem ist HNO<sub>3</sub> durch die höhere Elektronegativität und stärkere Bindungen polarer als NH<sub>3</sub>. |
| − | + | Protolysen sind Gleichgewichtsreaktionen. Je nach Konzentration der Stoffe liegt das Gleichgewicht stärker bei den Edukten bzw. Produkten. Zudem sind Säuren und Basen häufig in Wasser gelöst, dies bezeichnet man mit dem Kürzel <sub>(aq)</sub>. | |
| − | + | ==== Definitionen ==== | |
| + | <b>Säure</b>: Protonenspender | ||
| + | <b>Base</b>: Protonenempfänger | ||
| − | === | + | <b>Säure-Base-Reaktion</b>: Protonenübergang |
| + | |||
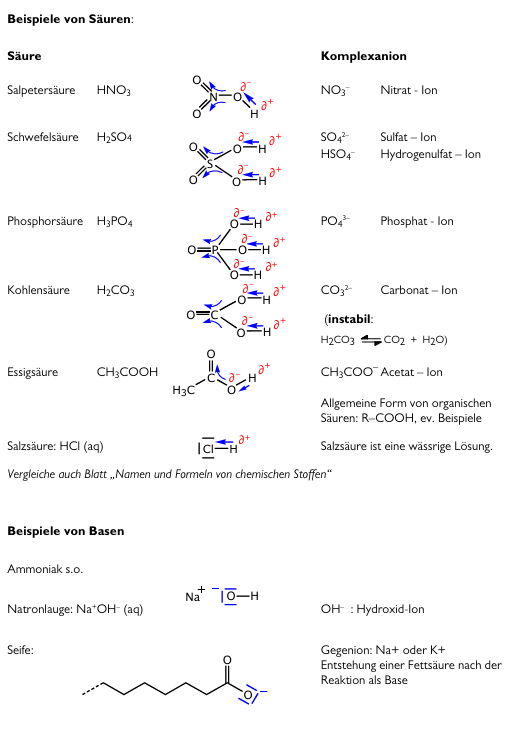
| + | === Beispiele von Säure und Basen mit Lewisformel=== | ||
| + | In der Lewisformel werden noch die jeweiligen Partialladungen und Kräfteverhältnisse demonstriert. Die Komplexanionen sind Basen. Hier werden nochmals die OH-Bindungen durch die Räuberbande (O-Atome) demonstriert. | ||
| + | [[Datei:S-B Lewisformeln-Bindungspolarität.png]] | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
Die Essigsäure gehört zu der Gruppe der <b>organischen Säuren</b>, welche jeweils eher schwach sind. Praktisch immer ist eine Carboxylgruppe vorhanden (COOH), der Rest variiert. Schwache organische Säuren finden auch zur Bestimmung des pH-Wertes eine Funktion, wenn die konjugierte Base eine andere Farbe hat als die Säure. | Die Essigsäure gehört zu der Gruppe der <b>organischen Säuren</b>, welche jeweils eher schwach sind. Praktisch immer ist eine Carboxylgruppe vorhanden (COOH), der Rest variiert. Schwache organische Säuren finden auch zur Bestimmung des pH-Wertes eine Funktion, wenn die konjugierte Base eine andere Farbe hat als die Säure. | ||
| − | Wenn eine Base (oder auch ein Ampholyt) negativ geladen ist, können sie auch mit einem Metall binden und dadurch zu einem Salz werden, z.B. Kalk (Ca<sup>2+</sup>CO<sub>3</sub><sup>2-</sup>). | + | Wenn eine Base (oder auch ein Ampholyt) negativ geladen ist, können sie auch mit einem Metall binden und dadurch zu einem Salz werden, z.B. Kalk (Ca<sup>2+</sup>CO<sub>3</sub><sup>2-</sup>). |
| + | |||
| + | === Beweis für die Protonenübergabe bei Säure-Base-Reaktionen === | ||
| + | |||
| + | Damit ein Stoff leitfähig ist, muss folgende Bedingung erfüllt sein: Es müssen frei bewegliche, geladene Teilchen vorhanden sein. Damit also dieses Gemisch leitfähig ist, müssen entweder frei bewegliche Elektronen oder Protonen verfügbar sein. In diesem Experiment wird reine Essigsäure mit Wasser gemischt und die Leitfähigkeit der jeweiligen Stoffe geprüft: | ||
| + | |||
| + | CH<sub>3</sub>COOH + H<sub>2</sub>O ⇌ CH<sub>3</sub>COO<sup>-</sup> + H<sub>3</sub>O<sup>+</sup> | ||
| + | |||
| + | [[Datei:Leitfähig?.png]] | ||
| − | + | [[Datei:PROTONENUEBERGANG EXP.png]] | |
| − | + | Reine Essigsäure und Wasser haben jeweils keine frei beweglichen geladenen Teilchen sind daher nicht leitfähig. Jedoch ist das Acetat-Ion leitfähig. Es ist somit ein Beweis dafür, dass in einer Säure-Base-Reaktion die Protonen den Besitzer wechseln, denn hier wird das H<sup>+</sup> von der Essigsäure an die freie Elektronenwolke von Wasser übertragen, damit das Acetat-Ion mit dem Oxonium-Ion entsteht. | |
| − | + | Wasser selbst ist auch leicht leitfähig: | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | 2 H<sub>2</sub>O ⇌ H<sub>3</sub>O<sup>+</sup> + OH<sup>-</sup> | |
| + | |||
| + | Hierbei wird durch den Protonenübergang aus zwei Wassermoleküle 1 Oxonium-Ion und 1 Hydroxid-Ion. | ||
=== Reaktionstypen === | === Reaktionstypen === | ||
| + | Es gibt vier Säure-Base-Reaktionstypen: | ||
| + | ==== Neutralisationsreaktionen ==== | ||
| − | + | HCl (starke Säure) + Na<sup>+</sup>OH<sup>-</sup> (starke Base) ⇌ H<sub>2</sub>O + Na<sup>+</sup>Cl<sup>-</sup> | |
| + | Bei einer Neutralisationsreaktion neutralisieren sich eine starke Säure und eine starke Base gegenseitig. Typisch hierfür ist die Reaktion von OH<sup>-</sup>-Ionen im Komplex einer Base mit starken Säuren. Somit entstehen Wasser und ein Salz, in diesem Fall Natriumchlorid. | ||
| − | Eine | + | Eine allgemeine Formel für eine typische Neutralisationsreaktion: |
| − | + | Starke Säure + Starke Base ⇌ Wasser + Salz | |
| + | ==== "Die starke Säure vertreibt die schwächere Säure aus ihrem Salz" ==== | ||
| − | + | K<sup>+</sup>CN<sup>-</sup> (Kaliumcyanid, schwache Säure) + HCl<sub>aq</sub> (Salzsäure, starke Säure) ⇌ K<sup>+</sup>Cl<sub>aq</sub><sup>-</sup> (Blausäure) + HCN (Kaliumchlorid) | |
| − | + | Ein Salz besteht aus einem Anion (negativ geladenes Atom) und Kation (positiv geladenes Atom). Daher sagt man nicht, dass z.B. in diesem Fall Kaliumcyanid die Base ist, sondern Cyanid-Ion(CN<sup>-</sup>). Hier vertreibt HCl-Molekül das K<sup>+</sup> von seinem Salz. Damit entsteht eine neue Säure und ein Salz. | |
Kalknachweis: | Kalknachweis: | ||
| − | + | Aus Carbonat-Ion (CO<sub>3</sub><sup>2-</sup>) kann Kohlensäure (H<sub>2</sub>CO<sub>3</sub>) entstehen. Dies kann man auch in der Geologie verwenden. CO<sub>3</sub><sup>2-</sup> kann mit Ca<sup>2+</sup> reagieren und es entsteht Kalk Ca<sup>2+</sup>CO<sub>3</sub><sup>2-</sup>. Dies kann man dann mit einer starken Säure reagieren lassen, zum Beispiel HCl: | |
| + | |||
| + | Ca<sup>2+</sup>CO<sub>3</sub><sup>2-</sup> + 2HCl<sub>aq</sub> ⇌ H<sub>2</sub>O + CO<sub>2</sub> + Ca<sup>2+</sup>Cl<sub>2</sub><sup>-</sup> | ||
| − | + | H<sub>2</sub>CO<sub>3</sub> ist die schwache Säure (durch den Zerfall wegen der Gasbildung entsteht H<sub>2</sub>O + CO<sub>2</sub>) und HCl die starke. Daraus entsteht die neue Säure Kohlensäure und das Salz Calciumchlorid. | |
==== Basen im Wasser ==== | ==== Basen im Wasser ==== | ||
| − | NH<sub>3</sub>+H<sub>2</sub> | + | NH<sub>3</sub> + H<sub>2</sub>O ⇌ NH<sub>4</sub><sup>+</sup> + OH<sup>-</sup> |
| + | |||
| + | Hierbei wird das H<sup>+</sup> vom Wasser durch das Zusammenstossen mit Ammoniak an die freie Elektronenwolke vom N-Atom übergeben. Also wird eine Basen in Wasser gelöst, entstehen <b>OH<sup>-</sup> (Hydroxid-Ionen</b>). | ||
| + | |||
| + | Weitere Beispiele: | ||
| + | |||
| + | HSO<sub>4</sub><sup>-</sup> + H<sub>2</sub>O ⇌ H<sub>2</sub>SO<sub>4</sub> + OH<sup>-</sup> (Schwefelsäure) | ||
| + | |||
| + | F<sup>-</sup> + H<sub>2</sub>O ⇌ HF + OH<sup>-</sup> (Fluorwasserstoff) | ||
| + | |||
| + | ==== Säuren im Wasser ==== | ||
| + | HCl + H<sub>2</sub>O ⇌ Cl<sup>+</sup> + H<sub>3</sub>O<sup>+</sup> | ||
| + | |||
| + | Wenn eine Säure mit Wasser reagiert, wird das H<sup>+</sup> an die freie Elektronenwolke von O im Molekül H<sub>2</sub>O übergeben. Also wenn eine Säure in Wasser gelöst wird, entstehen <b>H<sub>3</sub>O<sup>+</sup> (Oxonium-Ionen)</b>. | ||
| + | |||
| + | Weitere Beispiele: | ||
| + | |||
| + | HI + H<sub>2</sub>O ⇌ I<sup>-</sup> + H<sub>3</sub>O<sup>+</sup> (Iodwasserstoff). | ||
| + | |||
| + | H<sub>2</sub>S + H<sub>2</sub>O ⇌ HS<sup>-</sup> + H<sub>3</sub>O<sup>+</sup> (Schwefelwasserstoff). | ||
| + | |||
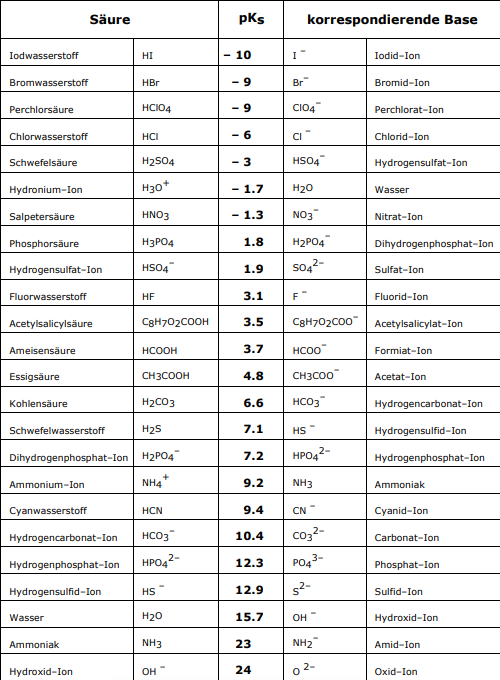
| + | === Einige Säuren und ihre konjugierten Basen === | ||
| + | |||
| + | Säuren werden nach der Abgabe eines Protons zu einer Base, und Basen werden nach der Aufnahme dieses Protons zu einer Säure. Dadurch wird auch klar, dass jede Säure eine sogenannte konjugierte Base hat, und jede Base eine konjugierte Säure besitzt. Daher sind Protolysen auch Gleichgewichtsreaktionen. Hier sind einige Säuren mit ihren jeweiligen konjugierten Basen | ||
| + | |||
| + | [[Datei:S-B Paare.png]] | ||
| + | |||
| + | === Ampholyten === | ||
| + | Ampholyten sind Stoffe, die ein H<sup>+</sup> Proton abgeben, aber auch aufnehmen können. Das heisst sie können als Säure sowie auch als Base reagieren. Diese Tabelle zeigt Ampholyten und ihre korrespondierende Stoffe, die entweder ein H<sup>+</sup> mehr oder weniger besitzen: | ||
| + | |||
| − | + | [[Datei:S-B- Ampholyten.png]] | |
| + | === Video von the Simple Chemics === | ||
| + | Link: [https://www.youtube.com/watch?v=FxXISwuj9Rc&list=PLlxOW5VSfflNe3lzbGYNywU2WI0xzTgtF&index=13 Säure-Base Paare REMAKE] | ||
| + | Besonders nützlich: Das Video eignet sich sehr gut als Einführung in das Thema. Es erklärt das Prinzip der Säure-Base-Reaktion einfach und gut verständlich. | ||
=== Quellen === | === Quellen === | ||
<ul> | <ul> | ||
<li>Text: eigene Notizen</li> | <li>Text: eigene Notizen</li> | ||
| − | <li>Bild: [ | + | <li>Bild: eigene Abbildungen, Dokument von Unterrichtsunterlagen |
| + | <li> Video: [https://www.youtube.com/user/TheSimpleChemics The Simple Chemics] </li> | ||
</ul> | </ul> | ||
Aktuelle Version vom 16. Juni 2024, 09:38 Uhr
Inhaltsverzeichnis
Säure-Base-Reaktion
Eine Säure ist ein (H+) Protonenspender und eine Base ist ein (H+) Protonenempfänger. Eine Säure-Base-Reaktion ist eine Protonenübertragungsreaktion zwischen einer Säure und einer Base, auch Protolyse genannt. Dabei gibt die Säure ein Proton (H+), ab während die Base dieses Proton aufnimmt.
Anhand dieser Säure-Base-Reaktion sieht man, wie der Protonenübergang verläuft:
Säure: HNO3 + Base: NH3 ⇌ Base: NO3- + Säure: NH4+
Sauerstoff gehört zu der Elektronenräuberbande. In der starken O-H-Bindung des Moleküls besitzt das H-Atom eine stark positive Partialladung, somit kann das Proton leicht von der Säure getrennt werden. Ausserdem steht ein freies Elektronenpaar im Molekül NH3 zur Verfügung. Das Proton (H+) lagert sich an das naheliegende freie Elektronenpaar (das negativ geladen ist) an. Dadurch wird das Proton beim Zusammenstossen von dem Ammoniak-Molekül aufgenommen. Die Säure wird nach Abgabe eines Protons zu einer Base, die Base hingegen nach der Aufnahme eben dieses Protons wieder zu einer Säure. Zudem ist HNO3 durch die höhere Elektronegativität und stärkere Bindungen polarer als NH3.
Protolysen sind Gleichgewichtsreaktionen. Je nach Konzentration der Stoffe liegt das Gleichgewicht stärker bei den Edukten bzw. Produkten. Zudem sind Säuren und Basen häufig in Wasser gelöst, dies bezeichnet man mit dem Kürzel (aq).
Definitionen
Säure: Protonenspender
Base: Protonenempfänger
Säure-Base-Reaktion: Protonenübergang
Beispiele von Säure und Basen mit Lewisformel
In der Lewisformel werden noch die jeweiligen Partialladungen und Kräfteverhältnisse demonstriert. Die Komplexanionen sind Basen. Hier werden nochmals die OH-Bindungen durch die Räuberbande (O-Atome) demonstriert.
Die Essigsäure gehört zu der Gruppe der organischen Säuren, welche jeweils eher schwach sind. Praktisch immer ist eine Carboxylgruppe vorhanden (COOH), der Rest variiert. Schwache organische Säuren finden auch zur Bestimmung des pH-Wertes eine Funktion, wenn die konjugierte Base eine andere Farbe hat als die Säure. Wenn eine Base (oder auch ein Ampholyt) negativ geladen ist, können sie auch mit einem Metall binden und dadurch zu einem Salz werden, z.B. Kalk (Ca2+CO32-).
Beweis für die Protonenübergabe bei Säure-Base-Reaktionen
Damit ein Stoff leitfähig ist, muss folgende Bedingung erfüllt sein: Es müssen frei bewegliche, geladene Teilchen vorhanden sein. Damit also dieses Gemisch leitfähig ist, müssen entweder frei bewegliche Elektronen oder Protonen verfügbar sein. In diesem Experiment wird reine Essigsäure mit Wasser gemischt und die Leitfähigkeit der jeweiligen Stoffe geprüft:
CH3COOH + H2O ⇌ CH3COO- + H3O+
Reine Essigsäure und Wasser haben jeweils keine frei beweglichen geladenen Teilchen sind daher nicht leitfähig. Jedoch ist das Acetat-Ion leitfähig. Es ist somit ein Beweis dafür, dass in einer Säure-Base-Reaktion die Protonen den Besitzer wechseln, denn hier wird das H+ von der Essigsäure an die freie Elektronenwolke von Wasser übertragen, damit das Acetat-Ion mit dem Oxonium-Ion entsteht.
Wasser selbst ist auch leicht leitfähig:
2 H2O ⇌ H3O+ + OH-
Hierbei wird durch den Protonenübergang aus zwei Wassermoleküle 1 Oxonium-Ion und 1 Hydroxid-Ion.
Reaktionstypen
Es gibt vier Säure-Base-Reaktionstypen:
Neutralisationsreaktionen
HCl (starke Säure) + Na+OH- (starke Base) ⇌ H2O + Na+Cl-
Bei einer Neutralisationsreaktion neutralisieren sich eine starke Säure und eine starke Base gegenseitig. Typisch hierfür ist die Reaktion von OH--Ionen im Komplex einer Base mit starken Säuren. Somit entstehen Wasser und ein Salz, in diesem Fall Natriumchlorid.
Eine allgemeine Formel für eine typische Neutralisationsreaktion:
Starke Säure + Starke Base ⇌ Wasser + Salz
"Die starke Säure vertreibt die schwächere Säure aus ihrem Salz"
K+CN- (Kaliumcyanid, schwache Säure) + HClaq (Salzsäure, starke Säure) ⇌ K+Claq- (Blausäure) + HCN (Kaliumchlorid)
Ein Salz besteht aus einem Anion (negativ geladenes Atom) und Kation (positiv geladenes Atom). Daher sagt man nicht, dass z.B. in diesem Fall Kaliumcyanid die Base ist, sondern Cyanid-Ion(CN-). Hier vertreibt HCl-Molekül das K+ von seinem Salz. Damit entsteht eine neue Säure und ein Salz.
Kalknachweis:
Aus Carbonat-Ion (CO32-) kann Kohlensäure (H2CO3) entstehen. Dies kann man auch in der Geologie verwenden. CO32- kann mit Ca2+ reagieren und es entsteht Kalk Ca2+CO32-. Dies kann man dann mit einer starken Säure reagieren lassen, zum Beispiel HCl:
Ca2+CO32- + 2HClaq ⇌ H2O + CO2 + Ca2+Cl2-
H2CO3 ist die schwache Säure (durch den Zerfall wegen der Gasbildung entsteht H2O + CO2) und HCl die starke. Daraus entsteht die neue Säure Kohlensäure und das Salz Calciumchlorid.
Basen im Wasser
NH3 + H2O ⇌ NH4+ + OH-
Hierbei wird das H+ vom Wasser durch das Zusammenstossen mit Ammoniak an die freie Elektronenwolke vom N-Atom übergeben. Also wird eine Basen in Wasser gelöst, entstehen OH- (Hydroxid-Ionen).
Weitere Beispiele:
HSO4- + H2O ⇌ H2SO4 + OH- (Schwefelsäure)
F- + H2O ⇌ HF + OH- (Fluorwasserstoff)
Säuren im Wasser
HCl + H2O ⇌ Cl+ + H3O+
Wenn eine Säure mit Wasser reagiert, wird das H+ an die freie Elektronenwolke von O im Molekül H2O übergeben. Also wenn eine Säure in Wasser gelöst wird, entstehen H3O+ (Oxonium-Ionen).
Weitere Beispiele:
HI + H2O ⇌ I- + H3O+ (Iodwasserstoff).
H2S + H2O ⇌ HS- + H3O+ (Schwefelwasserstoff).
Einige Säuren und ihre konjugierten Basen
Säuren werden nach der Abgabe eines Protons zu einer Base, und Basen werden nach der Aufnahme dieses Protons zu einer Säure. Dadurch wird auch klar, dass jede Säure eine sogenannte konjugierte Base hat, und jede Base eine konjugierte Säure besitzt. Daher sind Protolysen auch Gleichgewichtsreaktionen. Hier sind einige Säuren mit ihren jeweiligen konjugierten Basen
Ampholyten
Ampholyten sind Stoffe, die ein H+ Proton abgeben, aber auch aufnehmen können. Das heisst sie können als Säure sowie auch als Base reagieren. Diese Tabelle zeigt Ampholyten und ihre korrespondierende Stoffe, die entweder ein H+ mehr oder weniger besitzen:
Video von the Simple Chemics
Link: Säure-Base Paare REMAKE
Besonders nützlich: Das Video eignet sich sehr gut als Einführung in das Thema. Es erklärt das Prinzip der Säure-Base-Reaktion einfach und gut verständlich.
Quellen
- Text: eigene Notizen
- Bild: eigene Abbildungen, Dokument von Unterrichtsunterlagen
- Video: The Simple Chemics