Die Löslichkeit von Salzen: Unterschied zwischen den Versionen
Armax (Diskussion | Beiträge) (→Lösungsvorgang von Salzen) |
Armax (Diskussion | Beiträge) (→A) Die Löslichkeit von Salzen) |
||
| (203 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 3: | Zeile 3: | ||
Siehe [[Löslichkeit]] | Siehe [[Löslichkeit]] | ||
| − | == | + | == A) Die Löslichkeit von Salzen == |
| + | |||
| + | |||
| + | |||
| + | '''Exp.:''' | ||
| + | |||
| + | Wie lösen sich verschiedene Salze in Wasser? | ||
| + | |||
'''Vorgehen:''' | '''Vorgehen:''' | ||
| − | Von den drei Salzen Cu(NO₃)₂, K₂CrO₄ und CaCO₃ wird je gleich viel (ein Löffel) in eine dreigeteilte Petrischale gegeben. Diese Petrischale ist mit Wasser gefüllt. | + | Von den drei Salzen Cu(NO₃)₂, K₂CrO₄ und CaCO₃ wird je gleich viel (ein Löffel) in eine dreigeteilte Petrischale gegeben. Diese Petrischale ist mit Wasser gefüllt. |
| − | [[Datei:Salze.png| | + | |
| + | '''Fragestellung:''' | ||
| + | |||
| + | Welches Salz löst sich wie gut? | ||
| + | |||
| + | [[Datei:Salze.png|650px|thumb|left|Abb. 1: Lösen von Cu(NO₃)₂, K₂CrO₄ und CaCO₃ in Wasser in einer dreigeteilten Petrischale auf einem Projektor. | ||
]] | ]] | ||
| Zeile 51: | Zeile 63: | ||
CaCO₃ : hat sich fast nicht aufgelöst. | CaCO₃ : hat sich fast nicht aufgelöst. | ||
| + | |||
| + | |||
| + | Bei diesem Experiment erkennt man sehr grosse Unterschiede in der Löslichkeit von Salzen. | ||
| − | Das heisst: Salze lösen sich verschieden gut in Wasser | + | '''Das heisst:''' Salze lösen sich verschieden gut in Wasser. |
| − | '''Ausgangslage | + | '''A) Löslichkeit: Ausgangslage''' |
| + | |||
Salze sind unterschiedlich gut löslich. Wir benötigen ein Mass für die Löslichkeit ! | Salze sind unterschiedlich gut löslich. Wir benötigen ein Mass für die Löslichkeit ! | ||
| Zeile 65: | Zeile 81: | ||
'''Definition:''' | '''Definition:''' | ||
| − | Bei der Löslichkeit handelt es sich um die Eigenschaft, welche beschreibt ob und in welchem Umfang sich ein Salz in | + | Bei der Löslichkeit handelt es sich um die Eigenschaft, welche beschreibt ob und in welchem Umfang sich ein Salz in einem Lösungsmittel maximal löst. |
| + | |||
| + | Wenn die maximale Menge eines Salzes in einer Lösung gelöst ist, spricht man von einer gesättigten Lösung. Überschüssiges Salz wird als Bodensatz sichtbar. | ||
| + | |||
| + | Falls über die Löslichkeitsgrenze hinaus ein weiteres Salz hinzugefügt wird, kann dieses sich nicht mehr lösen und bildet ebenfalls einen Bodensatz. | ||
| Zeile 71: | Zeile 91: | ||
Gramm pro Liter (g/L) oder Mol pro Liter (mol/L). | Gramm pro Liter (g/L) oder Mol pro Liter (mol/L). | ||
| − | |||
| Zeile 78: | Zeile 97: | ||
1. Molare Masse: | 1. Molare Masse: | ||
| − | Um die Umrechnung durchführen zu können, braucht man die molare Masse. Diese gibt an, wie viel Gramm ein Mol des Stoffes wiegt und hat die Einheit Gramm pro Mol (g/mol).Diese findet man im Periodensystem, in dem man die Atommasse | + | Um die Umrechnung durchführen zu können, braucht man die molare Masse. Diese gibt an, wie viel Gramm ein Mol des Stoffes wiegt und hat die Einheit Gramm pro Mol (g/mol).Diese findet man im Periodensystem, in dem man die Atommasse der gelösten Stoffes addiert. |
| Zeile 84: | Zeile 103: | ||
Die Konzentration in mol/L ist gesucht. | Die Konzentration in mol/L ist gesucht. | ||
| − | Gegeben ist die | + | Gegeben ist die Löslichkeit eines Salzes in g/L. |
| − | |||
| + | Um die Löslichkeit eines Salzes in M aus der Löslichkeit in g/L zu berechnen, gehen wir wie folgt vor: | ||
| − | + | Zuerst rechnen wir die molare Masse aus: | |
| − | |||
| − | + | (MOLARE MASSE AUSRECHNEN !) | |
| + | |||
| + | |||
| + | '''Bsp.:''' Molmasse Kupfer(II)-nitrat ( Cu(NO₃)₂ ): 187.55g/mol | ||
| + | |||
| + | |||
| + | Über eine Dreisatz Rechnung kann man die Molanzahl der gewünschten Menge berechnen. Angenommen wir hätten 10 Gramm Kupfer(II)-nitrat gelöst. | ||
| + | |||
| + | 187.55 g = 1 Mol | ||
| + | |||
| + | 1 : 187.5 = | ||
| + | |||
| + | 1 g = 0.00533191 Mol | ||
| + | |||
| + | 0.00533191 Mol x 10 | ||
| + | |||
| + | 10 g = 0.0533191 Mol | ||
| + | |||
| + | |||
| + | |||
| + | Dieses Ergebnis muss man jetzt noch durch die Anzahl an Volumen teilen, also in diesem Beispiel wären es 1 Liter, da mol/L immer auf 1 Liter geht. | ||
| + | |||
| + | |||
| + | 0.0533191/1 Mol = 0.0533191 mol/L | ||
| + | |||
| + | |||
| + | |||
| + | Dies ist nun die Konzentration von Kupfer(II)-nitrat in einem Liter Wasser. | ||
| − | |||
| − | |||
'''Schlussfolgerung:''' | '''Schlussfolgerung:''' | ||
| − | 1. Warum lösen sich Salze überhaupt? | + | '''1.''' Warum lösen sich Salze überhaupt? |
| − | 2. Welche Faktoren bestimmen die Löslichkeit? | + | '''2.''' Welche Faktoren bestimmen die Löslichkeit? |
| − | == Lösungsvorgang von Salzen == | + | == B) Lösungsvorgang von Salzen == |
| − | ''' | + | '''Fragestellung:''' |
1. Warum lösen sich Salze überhaupt? | 1. Warum lösen sich Salze überhaupt? | ||
| Zeile 114: | Zeile 157: | ||
Folgende drei Aspekte spielen bei der Lösung von Salzen in Wasser entscheidende Rollen: | Folgende drei Aspekte spielen bei der Lösung von Salzen in Wasser entscheidende Rollen: | ||
| − | - Die Wahrscheinlichkeit - Entropie | + | - Die Wahrscheinlichkeit der Teilchenbewegung - Entropie. |
| − | - Das Zusammenspiel der Gitterenergie, welche überwunden werden muss | + | - Das Zusammenspiel der Gitterenergie, welche überwunden werden muss. |
- Die Hydrationsenergie, welche mithilft. | - Die Hydrationsenergie, welche mithilft. | ||
| Zeile 123: | Zeile 166: | ||
'''Beispiel: Lösen von NaCl (Kochsalz) in Wasser:''' | '''Beispiel: Lösen von NaCl (Kochsalz) in Wasser:''' | ||
| − | Hier sehen Sie eine Abbildung von einem NaCl | + | Hier sehen Sie eine Abbildung von einem NaCl Ionengitter: |
| − | [[Datei:Ionengitter NaCl.png|200px|thumb|left|Beispiel eines Ionengitters: Anordnung von Natrium-Kationen und Chlorid-Anionen]] | + | [[Datei:Ionengitter NaCl.png|200px|thumb|left|Abb. 2: Beispiel eines Ionengitters: Anordnung von Natrium-Kationen und Chlorid-Anionen]] |
| Zeile 160: | Zeile 203: | ||
Zusammen bilden sie ein Ionengitter. | Zusammen bilden sie ein Ionengitter. | ||
| + | |||
| + | |||
| + | '''Wichtig zu wissen:''' | ||
| + | |||
| + | Das Ionengitter ist kein starrer, sondern ein '''kinetischer Zustand''' und die Ionen bewegen sich ständig. Sie "stossen" sich ständig gegenseitig und werden auch von den Wassermolekülen angeregt. | ||
| Zeile 165: | Zeile 213: | ||
'''Nun geben wir das NaCl in Wasser:''' | '''Nun geben wir das NaCl in Wasser:''' | ||
| − | [[Datei:Lösungsvorgang.png|600px|thumb|left| | + | [[Datei:Lösungsvorgang.png|600px|thumb|left|Abb. 3: Lösungsvorgang von NaCl in Wasser auf Teilchenebene.]] |
| Zeile 188: | Zeile 236: | ||
'''a''' | '''a''' | ||
| − | Hier sieht man, wie sich die | + | Hier sieht man, wie sich die Wassermoleküle an das Ionengitter von NaCl haften. Das passiert, weil Wasser polar geladen ist und Dipole hat, also positiv und negativ geladene Bereiche innerhalb des Moleküls. |
Das heisst aber noch nicht, dass sich das Ionengitter nun löst. | Das heisst aber noch nicht, dass sich das Ionengitter nun löst. | ||
| + | |||
'''b''' | '''b''' | ||
| − | Hier sieht man, wie sich ein | + | Hier sieht man, wie sich ein Chlorid-Ion von dem Gitter löst. Das passiert durch die zufällige Teilchenbewegung und die Wahrscheinlichkeit: Entropie. |
| + | |||
| + | Von all den Bewegungsmöglichkeiten, welche das Chlorid-Ion hat, sind die meisten Möglichkeiten weg vom Gitter. Die Wahrscheinlichkeit, dass das Chlorid-Ion sich nachher wieder genau an die Ausgangsposition bewegt ist sehr unwahrscheinlich. | ||
| + | |||
| + | Entropie = "Es geschieht, was wahrscheinlich ist". | ||
| + | |||
| + | So wird die Gitterenergie überwunden. | ||
| + | |||
| + | Nun sieht man, wie sich die positiven Sauerstoff (O) Pole des Wassers sich an die negativ geladenen Chlorid-Ionen kleben. Das passiert, weil sich negativ und positiv anzieht. So entstehen hydratisierte Ionen. | ||
| + | |||
| + | Dieser Vorgang heisst: '''Hydration''' | ||
| + | |||
'''c''' | '''c''' | ||
| − | Hier sieht man, wie... | + | Hier sieht man, wie die positiven Wasserstoffatome der Wassermoleküle (H) die negativ geladenen Chlorid-Ionen anziehen. |
| + | |||
| + | Und darunter sieht man, wie sich die negativen Sauerstoffatome der Wassermoleküle (O) an die positiv geladenen Natrium-Ionen anziehen. | ||
| + | |||
| + | Das passiert, weil sich negativ und positiv anzieht. | ||
| + | |||
| + | |||
| + | |||
| + | '''Detaillierter Ablauf vom Lösungsvorgang NaCl (Kochsalz) in Wasser:''' | ||
| + | |||
| + | [[Datei:Ebene 1.png|400px|thumb|left|Abb. 4: Ein Salz (dargestellt als Ionengitter Grün/Grau) wird in einen Behälter gegeben.]] | ||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | '''Abb. 4:''' Hier wird NaCl (Kochsalz) in einen Behälter gegeben. Genauer gesagt: Man sieht das Ionengitter eines NaCl-Moleküls auf Teilchenebene. Die grauen Kreise stellen die Natrium-Ionen dar und die grünen Kreise die Chlorid-Ionen. | ||
| + | |||
| + | |||
| + | [[Datei:Ebene 2.png|400px|thumb|left|Abb. 5: Dieser Behälter wird mit Wasser aufgefüllt und es werden Wassermoleküle (Rot/Grau) dargestellt]] | ||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | '''Abb. 5:''' Hier sieht man, wie Wasser in das Gefäss gefüllt wurde. Die rot-grauen Moleküle sind Wassermoleküle (H₂O). Die grauen Kreise stehen für die H-Atome (Wasserstoffatome) und die roten Kreise stehen für die O-Atome (Sauerstoffatome). | ||
| + | |||
| + | |||
| + | [[Datei:Ebene 3,4,5.png|400px|thumb|left|Abb. 6: Hier wird gezeigt, wie sich die Wassermoleküle anordnen, um die verschiedenen Salz-Ionen zu "binden" bzw. zu hydratisieren.]] | ||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | '''Abb. 6:''' Hier sieht man, wie sich ein negatives und ein positives NaCl-Ion von dem Gitter lösen. Das geschieht wegen der zufälligen Teilchenbewegung und der Entropie. | ||
| + | |||
| + | |||
| + | Repetition - Der Merksatz der Entropie: Es passiert das, was wahrscheinlich ist. Die Wahrscheinlickeit, dass sich die Ionen von dem Gitter weg bewegen, anstatt wieder an ihre Ausgangsposition zurückzukehren, ist höher. | ||
| + | |||
| + | |||
| + | Ausserdem umgeben nun die negativen Ionen des Wassermoleküls das positive Natrium-Ion (Von NaCl). Umgekehrt umgeben die positiven Ionen des Wassermoleküls das negative Chlorid-Ion (Von NaCl). | ||
| + | |||
| + | Das passiert aufgrund der Anziehungskräften von negativ und positiv. | ||
| + | |||
| + | |||
| + | [[Datei:Ebene 6.png|400px|thumb|left|Abb. 7: Detaillierte Beschreibung des Vorgangs und der einzelnen Komponenten]] | ||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| Zeile 205: | Zeile 392: | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| Zeile 238: | Zeile 409: | ||
| + | '''Abb. 7:''' Hier sieht man nun das teil-hydratisierte NaCl in Wasser. | ||
| + | == C) Experiment: Energetische Betrachtung == | ||
| + | '''Vorgehen:''' | ||
| + | Das Vorgehen bei diesem Experiment ist simpel: | ||
| + | '''Schritt 1:''' Man misst die Ursprungstemperatur vom Lösungsmittel (in diesem Fall: Wasser) und schreibt diese auf. | ||
| + | '''Schritt 2:''' Man gibt man das jeweilige Salz ins Wasser und misst die Temperatur, nach der Auflösung des Salzes, nochmals. | ||
| + | '''Schlussfolgerung:''' Wenn sich die Temperatur erhöht, kann man rückschliessen, dass die Reaktion exotherm verlaufen ist und Wärmeenergie an das Wasser abgegeben hat, sodass sich die Wassertemperatur erhöht. | ||
| + | Im Umkehrschluss heisst das auch, wenn sich die Wassertemperatur verringert, ist der Lösungsvorgang des Salzes endotherm. Energie wird, in Form von Wärmeenergie, aus dem Wasser gebraucht, um die Gitterenergie des Salzes zu überwinden. | ||
| + | |||
| + | |||
| + | [[Datei:Tabelle_final.jpg|1250px|thumb|left|Abb. 8: Exp.: Darstellung Delta H.]] | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | ''' | + | '''Ergebnisse:''' |
| − | + | Es gibt sowohl gut lösliche Salze, die sich exotherm wie endotherm lösen. | |
| − | |||
| + | Wenn ΔH > 0 ist, hat das System "Energie" aus dem Wasser aufgenommen, um die Gitterenergie des Salzes zu überwinden und hat somit dessen Temperatur gesenkt. | ||
| + | Wenn es eine exotherme Reaktion ist, dann gibt die Reaktion, die Aufbrechung des Gitters, "Energie" an das umliegende Wasser ab, die Temperatur steigt und ΔH < 0. | ||
| + | Bei schlecht löslichen Salzen ist die Gitterenergie zu gross und kann nicht überwunden werden. | ||
| + | == D) Faktoren, welche die Löslichkeit beeinflussen == | ||
| + | '''Fragestellung:''' | ||
| + | 2. Welche Faktoren bestimmen die Löslichkeit ? | ||
| + | '''Gut lösliche Salze:''' | ||
| + | Die Hydrationsenergie ist höher als die Gitterenergie. | ||
| + | Die Reaktion ist exotherm. | ||
| + | Eine günstige Entropie ist vorhanden. | ||
| + | '''Mittel-Gut lösliche Salze:''' | ||
| + | Die Gitterenergie ist leicht höher als die Hydrationsenergie. | ||
| + | Diese Art von Reaktionen sind oft endotherm | ||
| − | + | Eine günstige Entropie ist vorhanden. | |
| + | Hier kann die Gitterenergie nur durch die '''günstige Entropie''' überwunden werden, da diese der Hydrationsenergie hilft. | ||
| − | |||
| − | + | '''Nicht / kaum lösliche Salze:''' | |
| + | Die Gitterenergie ist sehr gross - viel grösser als die Hydrationsenergie - somit ist es fast unmöglich das Gitter aufzubrechen. | ||
| − | |||
| − | + | '''Siehe Abb. 8 in "C) Experiment: Energetische Betrachtung"''' | |
| − | '''Ionengrösse und -ladung:''' | + | '''Ionengrösse und -ladung: (bestimmen die Gitterenergie)''' |
Kleine Ionen: | Kleine Ionen: | ||
| Zeile 332: | Zeile 512: | ||
Grosse Ionen mit kleinen Ladungen sind also besser löslich als kleine Ionen mit grossen Ladungen. | Grosse Ionen mit kleinen Ladungen sind also besser löslich als kleine Ionen mit grossen Ladungen. | ||
| − | == | + | == E) Kristallwasser == |
| − | + | Unter Kristallwasser versteht man Wasser, welches im Kristallgitter eines Salzes eingebaut ist. | |
| − | + | Viele Salze bilden Hydrate, in denen Wassermoleküle in die Kristallstruktur integriert sind. | |
| − | + | ||
| + | Ein bekanntes Beispiel für ein solches Hydrat ist Cobalt(II)-chlorid-Hexahydrat (Geheimtinte). | ||
| − | |||
| − | + | '''Bsp.: Geheimtinte''' | |
| − | |||
| − | + | Co<sup>2+</sup>Cl<sub>2</sub><sup>1-</sup> * 6H<sub>2</sub>O<sub>(s) | |
| − | |||
| − | |||
| − | + | Cobalt bildet mit 6 Wassermolekülen eine Komplexion: | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | Cobalt bildet mit 6 Wassermolekülen | ||
[CO(6H<sub>2</sub>O)<sub>6</sub>]<sup>2+</sup> | [CO(6H<sub>2</sub>O)<sub>6</sub>]<sup>2+</sup> | ||
| − | Im Cobaltchlorid Hexahydrat ist jetzt | + | Im Cobaltchlorid Hexahydrat ist jetzt diese Komplexion und noch zwei Chlor-Ionen enthalten. |
| − | + | Jedes Cobalt-Ion ist von 8 Gegen-Ionen umgeben, zwei davon Chlor-Ionen und sechs Wassermoleküle. | |
| Zeile 381: | Zeile 552: | ||
{|border="0" | {|border="0" | ||
| − | | width="220" | Cobaltchlorid Hexahydrat | + | | width="220" | Cobaltchlorid Hexahydrat (rosa) |
| width="150" | | | width="150" | | ||
| − | | width="100" | Cobaltchlorid( | + | | width="100" | Cobaltchlorid (blau) |
|} | |} | ||
| + | |||
| + | '''Abbildungen:''' | ||
| + | |||
| + | [[Datei:Geheimtinte Vorher.png|400px|thumb|left|Abb. 9: Geheimtinte vor dem Erhitzen.]] | ||
| + | |||
| + | [[Datei:Geheimtinte Nachher.png|360px|thumb|center|Abb. 10: Geheimtinte nach dem Erhitzen auf einer Herdplatte.]] | ||
| + | |||
| + | |||
| + | |||
| + | '''Abb. 9 (links):''' Hier sieht man das Kristallwasser ( Cobalt(II)-chlorid-Hexahydrat ), welches vor dem Erhitzen auf ein Blatt Papier aufgetragen wurde. | ||
| + | |||
| + | |||
| + | '''Abb. 10 (rechts):''' Hier sieht man das nun sichtbare Kristallwasser (Geheimtinte), nach dem Erhitzen auf einer Herdplatte. | ||
| + | |||
| + | |||
| + | '''Vorgang:''' | ||
Wenn das Kristallwasser im Ionengitter verdampft, bleibt Cobaltchlorid übrig und wird sichtbar. | Wenn das Kristallwasser im Ionengitter verdampft, bleibt Cobaltchlorid übrig und wird sichtbar. | ||
| − | Cobalt(II)-chlorid-Hexahydrat | + | Sobald das Kristallwasser verdampft, verwandelt sich das kaum sichtbare (hell-rosa) Cobalt(II)-chlorid-Hexahydrat in sichtbar blaues Cobalt(II)-chlorid. |
| + | |||
| + | Dadurch wird die "unsichtbare" Schrift sichtbar und daher kommt der Name: Geheimtinte. | ||
| + | |||
| + | |||
| + | |||
| + | |||
| + | '''Exsikkator''' | ||
| + | |||
| + | |||
| + | '''Definition:''' | ||
| + | |||
| + | Ein Exsikkator ist ein Gerät, welches in Laboren zur Aufbewahrung von Proben in einer trockenen Umgebung verwendet wird oder zum Trocknen von Stoffen nach einer Synthese. Es wird eingesetzt, um zu verhindern, dass Feuchtigkeit in die Proben eindringt, was deren Eigenschaften verändern könnte. | ||
| + | |||
| + | |||
| + | '''Hauptbestandteile:''' | ||
| + | |||
| + | Deckel: Oft aus Glas oder Kunststoff, dicht verschliessbar, um die Proben vor Luftfeuchtigkeit zu schützen. | ||
| + | |||
| + | Boden: Ebenfalls aus Glas oder Kunststoff, manchmal mit einem herausnehmbaren Rost oder einer perforierten Platte. | ||
| + | |||
| + | Trockenmittel: In der Regel Blaugel oder andere Substanzen, welche Wasser gut aufnehmen können, die in einem separaten Fach oder direkt am Boden des Exsikkators platziert werden. | ||
| + | |||
| + | Vakuumanschluss (optional): Einige Exsikkatoren sind mit einem Anschluss für eine Vakuumpumpe ausgestattet, um ein Vakuum zu erzeugen und die Feuchtigkeit noch effektiver zu entfernen. | ||
| + | |||
| + | (siehe Abb. 12) | ||
| + | |||
| + | |||
| + | '''Funktionsweise:''' | ||
| + | |||
| + | Probenlagerung: Proben werden auf dem Rost oder der perforierten Platte platziert. | ||
| + | |||
| + | Verschliessen: Der Deckel wird dicht verschlossen, oft mit einem speziellen Fett oder einer Dichtung, um die Abdichtung zu verbessern. | ||
| + | |||
| + | Feuchtigkeitsentzug: Das Trockenmittel absorbiert die Feuchtigkeit aus der Luft im Inneren des Exsikkators. | ||
| + | |||
| + | Vakuum (optional): Bei Exsikkatoren mit Vakuumanschluss kann die Luft entfernt werden, um die Trocknung zu beschleunigen. | ||
| + | |||
| + | |||
| + | |||
| + | [[Datei:Blaugel.png|400px|thumb|left|Abb. 11: Blaugel; Trockenmittel.]] | ||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | '''Abb. 11:''' Hier sieht man: | ||
| + | |||
| + | Rechts: Das Trockenmittel Blaugel vor der Aufnahme von Feuchtigkeit. | ||
| + | |||
| + | Links: Das Trockenmittel Blaugel nach der Aufnahme von Feuchtigkeit. | ||
| + | |||
| + | (Nach der Aufnahme von Feuchtigkeit kann man das Blaugel z.B. mithilfe eines Trockenschranks bei ca. 60° Grad trocknen.) | ||
| + | |||
| + | |||
| + | [[Datei:Exsikkator.png|400px|thumb|left|Abb. 12: Ein Exsikkator: Ein Glasbehälter mit Deckel und Trockenmittel.]] | ||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | '''Abb. 12:''' Hier sieht man einen einfachen Exsikkator. | ||
| + | |||
| + | |||
| + | '''Wichtig:''' Zu beachten ist, dass Blaugel mittlerweile verboten ist. Es besteht aus Cobalt(II)-chlorid und ist krebserregend. | ||
| − | + | Alternativ wird heutzutage '''Orangegel''' verwendet. Orangegel ist Silicagel mit einem anderen Indikator als Kobaltchlorid und somit weniger gefährlich. | |
== Quellen == | == Quellen == | ||
| Zeile 405: | Zeile 713: | ||
* [http://meta.wikimedia.org/wiki/Help:Contents#For_editors Mediawiki Hilfeseite] – So kann der Link näher beschrieben werden</pre> | * [http://meta.wikimedia.org/wiki/Help:Contents#For_editors Mediawiki Hilfeseite] – So kann der Link näher beschrieben werden</pre> | ||
* [https://de.wikipedia.org/wiki/L%C3%B6slichkeit] – Löslichkeit, Wikipedia | * [https://de.wikipedia.org/wiki/L%C3%B6slichkeit] – Löslichkeit, Wikipedia | ||
| + | * [https://de.wikipedia.org/wiki/Cobalt(II)-chlorid] – Cobalt(II)-chlorid, Wikipedia | ||
* [https://studyflix.de/chemie/hydratation-2388] – Hydration, Studyfix | * [https://studyflix.de/chemie/hydratation-2388] – Hydration, Studyfix | ||
* [https://studyflix.de/chemie/salze-3733 ] – Salze, Studyfix | * [https://studyflix.de/chemie/salze-3733 ] – Salze, Studyfix | ||
| Zeile 410: | Zeile 719: | ||
* [https://www.lernort-mint.de/chemie/anorganische-chemie/salze-molekuele/schwer-und-leichtloesliche-salze/] – Salze, Lernort-Mint | * [https://www.lernort-mint.de/chemie/anorganische-chemie/salze-molekuele/schwer-und-leichtloesliche-salze/] – Salze, Lernort-Mint | ||
* [http://www.lenntech.com/deutsch/Element-und-Wasser/Loeslichkeit.htm] – Löslichkeit, Lenntech | * [http://www.lenntech.com/deutsch/Element-und-Wasser/Loeslichkeit.htm] – Löslichkeit, Lenntech | ||
| + | * [https://www.chemie.de/lexikon/Silicagel.html#google_vignette] – Silicagel, Chemie.de | ||
| + | * [https://de.wikipedia.org/wiki/Exsikkator_(Chemie)#:~:text=Ein%20Exsikkator%20(auch%3A%20Exsiccator%20oder,und%20pr%C3%A4parativen%20Chemie%20Verwendung%20findet.] – Exsikkator, Wikipedia | ||
Aktuelle Version vom 22. Juni 2024, 18:54 Uhr
Aufgrund der starken Anziehungskräfte von Ionen sind Salze grundsätzlich nur in hydrophilen Lösungsmitteln löslich. Für die Löslichkeit allgemein: Siehe Löslichkeit
Inhaltsverzeichnis
A) Die Löslichkeit von Salzen
Exp.:
Wie lösen sich verschiedene Salze in Wasser?
Vorgehen:
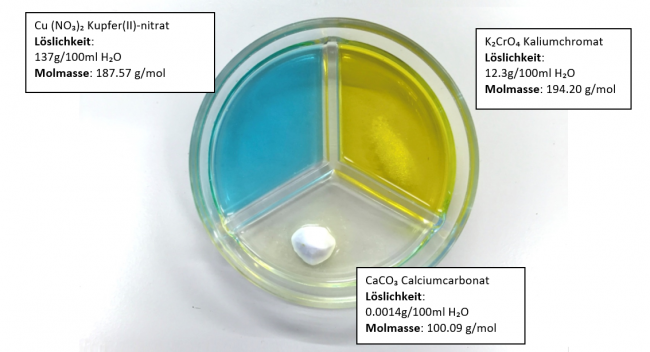
Von den drei Salzen Cu(NO₃)₂, K₂CrO₄ und CaCO₃ wird je gleich viel (ein Löffel) in eine dreigeteilte Petrischale gegeben. Diese Petrischale ist mit Wasser gefüllt.
Fragestellung:
Welches Salz löst sich wie gut?
Ergebnis:
Cu(NO₃)₂ : hat sich komplett aufgelöst.
K₂CrO₄ : hat sich teilweise aufgelöst.
CaCO₃ : hat sich fast nicht aufgelöst.
Bei diesem Experiment erkennt man sehr grosse Unterschiede in der Löslichkeit von Salzen.
Das heisst: Salze lösen sich verschieden gut in Wasser.
A) Löslichkeit: Ausgangslage
Salze sind unterschiedlich gut löslich. Wir benötigen ein Mass für die Löslichkeit !
Definition:
Bei der Löslichkeit handelt es sich um die Eigenschaft, welche beschreibt ob und in welchem Umfang sich ein Salz in einem Lösungsmittel maximal löst.
Wenn die maximale Menge eines Salzes in einer Lösung gelöst ist, spricht man von einer gesättigten Lösung. Überschüssiges Salz wird als Bodensatz sichtbar.
Falls über die Löslichkeitsgrenze hinaus ein weiteres Salz hinzugefügt wird, kann dieses sich nicht mehr lösen und bildet ebenfalls einen Bodensatz.
Einheit:
Gramm pro Liter (g/L) oder Mol pro Liter (mol/L).
Umrechnung: von g/L in mol/L:
1. Molare Masse:
Um die Umrechnung durchführen zu können, braucht man die molare Masse. Diese gibt an, wie viel Gramm ein Mol des Stoffes wiegt und hat die Einheit Gramm pro Mol (g/mol).Diese findet man im Periodensystem, in dem man die Atommasse der gelösten Stoffes addiert.
2. Dreisatz Rechnung:
Die Konzentration in mol/L ist gesucht. Gegeben ist die Löslichkeit eines Salzes in g/L.
Um die Löslichkeit eines Salzes in M aus der Löslichkeit in g/L zu berechnen, gehen wir wie folgt vor:
Zuerst rechnen wir die molare Masse aus:
(MOLARE MASSE AUSRECHNEN !)
Bsp.: Molmasse Kupfer(II)-nitrat ( Cu(NO₃)₂ ): 187.55g/mol
Über eine Dreisatz Rechnung kann man die Molanzahl der gewünschten Menge berechnen. Angenommen wir hätten 10 Gramm Kupfer(II)-nitrat gelöst.
187.55 g = 1 Mol
1 : 187.5 =
1 g = 0.00533191 Mol
0.00533191 Mol x 10
10 g = 0.0533191 Mol
Dieses Ergebnis muss man jetzt noch durch die Anzahl an Volumen teilen, also in diesem Beispiel wären es 1 Liter, da mol/L immer auf 1 Liter geht.
0.0533191/1 Mol = 0.0533191 mol/L
Dies ist nun die Konzentration von Kupfer(II)-nitrat in einem Liter Wasser.
Schlussfolgerung:
1. Warum lösen sich Salze überhaupt?
2. Welche Faktoren bestimmen die Löslichkeit?
B) Lösungsvorgang von Salzen
Fragestellung:
1. Warum lösen sich Salze überhaupt?
Folgende drei Aspekte spielen bei der Lösung von Salzen in Wasser entscheidende Rollen:
- Die Wahrscheinlichkeit der Teilchenbewegung - Entropie.
- Das Zusammenspiel der Gitterenergie, welche überwunden werden muss.
- Die Hydrationsenergie, welche mithilft.
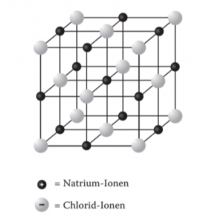
Beispiel: Lösen von NaCl (Kochsalz) in Wasser:
Hier sehen Sie eine Abbildung von einem NaCl Ionengitter:
Die schwarzen Punkte stellen die positiv geladenen Natrium-Kationen dar.
Die grauen Punkte stellen die negativ geladenen Chlorid-Anionen dar.
Kationen = Positiv geladenes Ion
Anionen = Negativ geladenes Ion
Zusammen bilden sie ein Ionengitter.
Wichtig zu wissen:
Das Ionengitter ist kein starrer, sondern ein kinetischer Zustand und die Ionen bewegen sich ständig. Sie "stossen" sich ständig gegenseitig und werden auch von den Wassermolekülen angeregt.
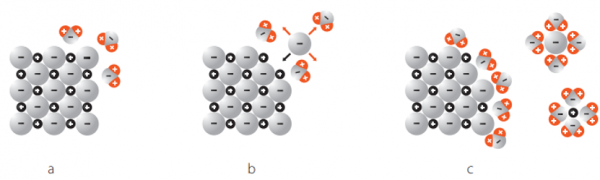
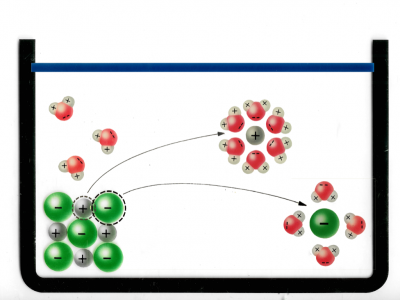
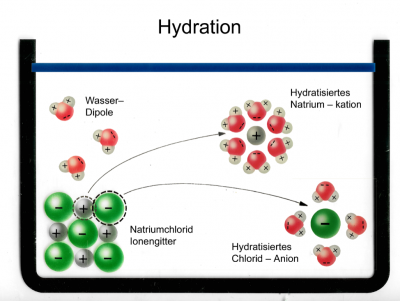
Nun geben wir das NaCl in Wasser:
a
Hier sieht man, wie sich die Wassermoleküle an das Ionengitter von NaCl haften. Das passiert, weil Wasser polar geladen ist und Dipole hat, also positiv und negativ geladene Bereiche innerhalb des Moleküls.
Das heisst aber noch nicht, dass sich das Ionengitter nun löst.
b
Hier sieht man, wie sich ein Chlorid-Ion von dem Gitter löst. Das passiert durch die zufällige Teilchenbewegung und die Wahrscheinlichkeit: Entropie.
Von all den Bewegungsmöglichkeiten, welche das Chlorid-Ion hat, sind die meisten Möglichkeiten weg vom Gitter. Die Wahrscheinlichkeit, dass das Chlorid-Ion sich nachher wieder genau an die Ausgangsposition bewegt ist sehr unwahrscheinlich.
Entropie = "Es geschieht, was wahrscheinlich ist".
So wird die Gitterenergie überwunden.
Nun sieht man, wie sich die positiven Sauerstoff (O) Pole des Wassers sich an die negativ geladenen Chlorid-Ionen kleben. Das passiert, weil sich negativ und positiv anzieht. So entstehen hydratisierte Ionen.
Dieser Vorgang heisst: Hydration
c
Hier sieht man, wie die positiven Wasserstoffatome der Wassermoleküle (H) die negativ geladenen Chlorid-Ionen anziehen.
Und darunter sieht man, wie sich die negativen Sauerstoffatome der Wassermoleküle (O) an die positiv geladenen Natrium-Ionen anziehen.
Das passiert, weil sich negativ und positiv anzieht.
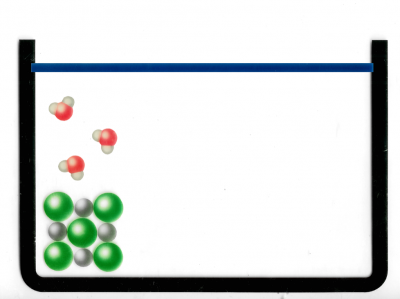
Detaillierter Ablauf vom Lösungsvorgang NaCl (Kochsalz) in Wasser:
Abb. 4: Hier wird NaCl (Kochsalz) in einen Behälter gegeben. Genauer gesagt: Man sieht das Ionengitter eines NaCl-Moleküls auf Teilchenebene. Die grauen Kreise stellen die Natrium-Ionen dar und die grünen Kreise die Chlorid-Ionen.
Abb. 5: Hier sieht man, wie Wasser in das Gefäss gefüllt wurde. Die rot-grauen Moleküle sind Wassermoleküle (H₂O). Die grauen Kreise stehen für die H-Atome (Wasserstoffatome) und die roten Kreise stehen für die O-Atome (Sauerstoffatome).
Abb. 6: Hier sieht man, wie sich ein negatives und ein positives NaCl-Ion von dem Gitter lösen. Das geschieht wegen der zufälligen Teilchenbewegung und der Entropie.
Repetition - Der Merksatz der Entropie: Es passiert das, was wahrscheinlich ist. Die Wahrscheinlickeit, dass sich die Ionen von dem Gitter weg bewegen, anstatt wieder an ihre Ausgangsposition zurückzukehren, ist höher.
Ausserdem umgeben nun die negativen Ionen des Wassermoleküls das positive Natrium-Ion (Von NaCl). Umgekehrt umgeben die positiven Ionen des Wassermoleküls das negative Chlorid-Ion (Von NaCl).
Das passiert aufgrund der Anziehungskräften von negativ und positiv.
Abb. 7: Hier sieht man nun das teil-hydratisierte NaCl in Wasser.
C) Experiment: Energetische Betrachtung
Vorgehen:
Das Vorgehen bei diesem Experiment ist simpel:
Schritt 1: Man misst die Ursprungstemperatur vom Lösungsmittel (in diesem Fall: Wasser) und schreibt diese auf.
Schritt 2: Man gibt man das jeweilige Salz ins Wasser und misst die Temperatur, nach der Auflösung des Salzes, nochmals.
Schlussfolgerung: Wenn sich die Temperatur erhöht, kann man rückschliessen, dass die Reaktion exotherm verlaufen ist und Wärmeenergie an das Wasser abgegeben hat, sodass sich die Wassertemperatur erhöht.
Im Umkehrschluss heisst das auch, wenn sich die Wassertemperatur verringert, ist der Lösungsvorgang des Salzes endotherm. Energie wird, in Form von Wärmeenergie, aus dem Wasser gebraucht, um die Gitterenergie des Salzes zu überwinden.
Ergebnisse:
Es gibt sowohl gut lösliche Salze, die sich exotherm wie endotherm lösen.
Wenn ΔH > 0 ist, hat das System "Energie" aus dem Wasser aufgenommen, um die Gitterenergie des Salzes zu überwinden und hat somit dessen Temperatur gesenkt.
Wenn es eine exotherme Reaktion ist, dann gibt die Reaktion, die Aufbrechung des Gitters, "Energie" an das umliegende Wasser ab, die Temperatur steigt und ΔH < 0.
Bei schlecht löslichen Salzen ist die Gitterenergie zu gross und kann nicht überwunden werden.
D) Faktoren, welche die Löslichkeit beeinflussen
Fragestellung:
2. Welche Faktoren bestimmen die Löslichkeit ?
Gut lösliche Salze:
Die Hydrationsenergie ist höher als die Gitterenergie.
Die Reaktion ist exotherm.
Eine günstige Entropie ist vorhanden.
Mittel-Gut lösliche Salze:
Die Gitterenergie ist leicht höher als die Hydrationsenergie.
Diese Art von Reaktionen sind oft endotherm
Eine günstige Entropie ist vorhanden.
Hier kann die Gitterenergie nur durch die günstige Entropie überwunden werden, da diese der Hydrationsenergie hilft.
Nicht / kaum lösliche Salze:
Die Gitterenergie ist sehr gross - viel grösser als die Hydrationsenergie - somit ist es fast unmöglich das Gitter aufzubrechen.
Siehe Abb. 8 in "C) Experiment: Energetische Betrachtung"
Ionengrösse und -ladung: (bestimmen die Gitterenergie)
Kleine Ionen:
Kleinere Ionen haben höhere Ladungsdichten (Ladung pro Volumeneinheit), was zu stärkeren elektrostatischen Anziehungskräften zwischen den Ionen führt. Diese stärkeren Kräfte machen es schwieriger, das Ionengitter zu brechen und die Ionen in Lösung zu bringen.
Höhere Ladungen:
Ionen mit höherer Ladung (z.B. Al³⁺ oder Fe³⁺) haben ebenfalls stärkere elektrostatische Anziehungskräfte im Ionengitter, was die Löslichkeit verringert. Dies ist darauf zurückzuführen, dass mehr Energie erforderlich ist, um diese starken Anziehungskräfte zu überwinden und die Ionen in Lösung zu bringen.
Grosse Ionen mit kleinen Ladungen sind also besser löslich als kleine Ionen mit grossen Ladungen.
E) Kristallwasser
Unter Kristallwasser versteht man Wasser, welches im Kristallgitter eines Salzes eingebaut ist.
Viele Salze bilden Hydrate, in denen Wassermoleküle in die Kristallstruktur integriert sind.
Ein bekanntes Beispiel für ein solches Hydrat ist Cobalt(II)-chlorid-Hexahydrat (Geheimtinte).
Bsp.: Geheimtinte
Co2+Cl21- * 6H2O(s)
Cobalt bildet mit 6 Wassermolekülen eine Komplexion:
[CO(6H2O)6]2+
Im Cobaltchlorid Hexahydrat ist jetzt diese Komplexion und noch zwei Chlor-Ionen enthalten.
Jedes Cobalt-Ion ist von 8 Gegen-Ionen umgeben, zwei davon Chlor-Ionen und sechs Wassermoleküle.
Geheimtinte wird sichtbar, sobald man ein damit beschriebenes Blatt erhitzt.
| CO2+CL21- * 6H2O(s) | → | CO2+CL21-(s) + 6H2O(g) |
| Cobaltchlorid Hexahydrat (rosa) | Cobaltchlorid (blau) |
Abbildungen:
Abb. 9 (links): Hier sieht man das Kristallwasser ( Cobalt(II)-chlorid-Hexahydrat ), welches vor dem Erhitzen auf ein Blatt Papier aufgetragen wurde.
Abb. 10 (rechts): Hier sieht man das nun sichtbare Kristallwasser (Geheimtinte), nach dem Erhitzen auf einer Herdplatte.
Vorgang:
Wenn das Kristallwasser im Ionengitter verdampft, bleibt Cobaltchlorid übrig und wird sichtbar.
Sobald das Kristallwasser verdampft, verwandelt sich das kaum sichtbare (hell-rosa) Cobalt(II)-chlorid-Hexahydrat in sichtbar blaues Cobalt(II)-chlorid.
Dadurch wird die "unsichtbare" Schrift sichtbar und daher kommt der Name: Geheimtinte.
Exsikkator
Definition:
Ein Exsikkator ist ein Gerät, welches in Laboren zur Aufbewahrung von Proben in einer trockenen Umgebung verwendet wird oder zum Trocknen von Stoffen nach einer Synthese. Es wird eingesetzt, um zu verhindern, dass Feuchtigkeit in die Proben eindringt, was deren Eigenschaften verändern könnte.
Hauptbestandteile:
Deckel: Oft aus Glas oder Kunststoff, dicht verschliessbar, um die Proben vor Luftfeuchtigkeit zu schützen.
Boden: Ebenfalls aus Glas oder Kunststoff, manchmal mit einem herausnehmbaren Rost oder einer perforierten Platte.
Trockenmittel: In der Regel Blaugel oder andere Substanzen, welche Wasser gut aufnehmen können, die in einem separaten Fach oder direkt am Boden des Exsikkators platziert werden.
Vakuumanschluss (optional): Einige Exsikkatoren sind mit einem Anschluss für eine Vakuumpumpe ausgestattet, um ein Vakuum zu erzeugen und die Feuchtigkeit noch effektiver zu entfernen.
(siehe Abb. 12)
Funktionsweise:
Probenlagerung: Proben werden auf dem Rost oder der perforierten Platte platziert.
Verschliessen: Der Deckel wird dicht verschlossen, oft mit einem speziellen Fett oder einer Dichtung, um die Abdichtung zu verbessern.
Feuchtigkeitsentzug: Das Trockenmittel absorbiert die Feuchtigkeit aus der Luft im Inneren des Exsikkators.
Vakuum (optional): Bei Exsikkatoren mit Vakuumanschluss kann die Luft entfernt werden, um die Trocknung zu beschleunigen.
Abb. 11: Hier sieht man:
Rechts: Das Trockenmittel Blaugel vor der Aufnahme von Feuchtigkeit.
Links: Das Trockenmittel Blaugel nach der Aufnahme von Feuchtigkeit.
(Nach der Aufnahme von Feuchtigkeit kann man das Blaugel z.B. mithilfe eines Trockenschranks bei ca. 60° Grad trocknen.)
Abb. 12: Hier sieht man einen einfachen Exsikkator.
Wichtig: Zu beachten ist, dass Blaugel mittlerweile verboten ist. Es besteht aus Cobalt(II)-chlorid und ist krebserregend.
Alternativ wird heutzutage Orangegel verwendet. Orangegel ist Silicagel mit einem anderen Indikator als Kobaltchlorid und somit weniger gefährlich.
Quellen
- Chemienotizen des 2. Jahres an der KsBa
- Chemiebuch
- Bilder von Herrn Deuber
- BingAI inkl. Quellenangaben
Weblinks
- Swisseduc – Unterrichtsserver für Chemie
- Mediawiki Hilfeseite – So kann der Link näher beschrieben werden
- [1] – Löslichkeit, Wikipedia
- [2] – Cobalt(II)-chlorid, Wikipedia
- [3] – Hydration, Studyfix
- [4] – Salze, Studyfix
- [5] – Löslichkeitsprodukt, Studyfix
- [6] – Salze, Lernort-Mint
- [7] – Löslichkeit, Lenntech
- [8] – Silicagel, Chemie.de
- [9] – Exsikkator, Wikipedia