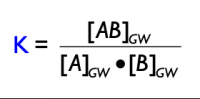Die Beschreibung des Chemischen Gleichgewichts: Unterschied zwischen den Versionen
(→Phase 4: Stabiler Gleichgewichtszustand) |
|||
| (211 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 3: | Zeile 3: | ||
| − | == 1. Definition des Chemischen Gleichgewichts == | + | == 1. Das Chemische Gleichgewicht == |
| + | === Definition des Chemischen Gleichgewichts === | ||
Ein chemisches Gleichgewicht tritt auf, wenn in einem geschlossenen System die Hin- und Rückreaktionen einer chemischen Reaktion mit derselben Geschwindigkeit ablaufen. Dies bedeutet nicht, dass die chemische Aktivität aufgehört hat, sondern dass sich die Konzentrationen der Reaktanten und Produkte nicht mehr ändern. | Ein chemisches Gleichgewicht tritt auf, wenn in einem geschlossenen System die Hin- und Rückreaktionen einer chemischen Reaktion mit derselben Geschwindigkeit ablaufen. Dies bedeutet nicht, dass die chemische Aktivität aufgehört hat, sondern dass sich die Konzentrationen der Reaktanten und Produkte nicht mehr ändern. | ||
| Zeile 9: | Zeile 10: | ||
Das chemische Gleichgewicht ist ein zentrales Konzept in der Chemie, da es die Dynamik vieler chemischer Reaktionen beschreibt, die in der Natur und in der Industrie stattfinden. Es hilft uns zu verstehen, wie Reaktionen unter bestimmten Bedingungen ablaufen und wie wir diese Bedingungen beeinflussen können, um die Ausbeute an gewünschten Produkten zu maximieren. | Das chemische Gleichgewicht ist ein zentrales Konzept in der Chemie, da es die Dynamik vieler chemischer Reaktionen beschreibt, die in der Natur und in der Industrie stattfinden. Es hilft uns zu verstehen, wie Reaktionen unter bestimmten Bedingungen ablaufen und wie wir diese Bedingungen beeinflussen können, um die Ausbeute an gewünschten Produkten zu maximieren. | ||
| − | === | + | === Fragestellung === |
| − | + | Die Lage des chemischen Gleichgewichts kann stark variieren und hängt von verschiedenen Faktoren ab. Dies wirft folgende wichtige Fragen auf: | |
| − | + | : Wo genau liegt das Gleichgewicht in einer chemischen Reaktion? | |
| + | : Welche Konzentrationen erreichen die Edukte und Produkte im Gleichgewichtszustand? | ||
| + | Antworten auf diese Kernfragen finden sich im weiteren Verlauf dieses Kapitels. | ||
== 2. Der Holzapfelkrieg == | == 2. Der Holzapfelkrieg == | ||
| − | + | Um die Lage des chemischen Gleichgewichts und Gleichgewichtskonzentration anschaulich zu erklären, verwenden wir das Beispiel des "Holzapfelkriegs". Dieses Beispiel hilft, den Gleichgewichtsprozesses zu visualisieren. | |
| − | Um | ||
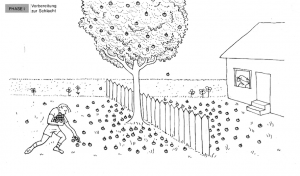
==== Phase 1: Vorbereitung zur Schlacht ==== | ==== Phase 1: Vorbereitung zur Schlacht ==== | ||
Stellen Sie sich einen Holzapfelbaum vor, der genau auf der Grenze zwischen zwei Gärten steht. In einem Garten wohnt ein Junge, im anderen ein alter Mann. Der Baum trägt viele Holzäpfel, die auf beiden Seiten des Zauns fallen. Zu Beginn sammelt der Junge alle Holzäpfel in seinem Garten auf. | Stellen Sie sich einen Holzapfelbaum vor, der genau auf der Grenze zwischen zwei Gärten steht. In einem Garten wohnt ein Junge, im anderen ein alter Mann. Der Baum trägt viele Holzäpfel, die auf beiden Seiten des Zauns fallen. Zu Beginn sammelt der Junge alle Holzäpfel in seinem Garten auf. | ||
| − | Analogie: Dies entspricht der | + | '''Analogie:''' Dies entspricht dem Start der Hinreaktion in einer chemischen Reaktion. |
[[Datei:Holzapfelkrieg_Phase1.png|thumb|center|300px|Phase 1: Vorbereitung zur Schlacht.]] | [[Datei:Holzapfelkrieg_Phase1.png|thumb|center|300px|Phase 1: Vorbereitung zur Schlacht.]] | ||
| − | |||
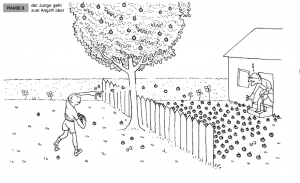
==== Phase 2: Der Junge geht zum Angriff über ==== | ==== Phase 2: Der Junge geht zum Angriff über ==== | ||
| − | Der Junge möchte die Holzäpfel loswerden und beginnt, sie in den Garten des alten Mannes zu werfen | + | Der Junge möchte die Holzäpfel loswerden und beginnt, sie in den Garten des alten Mannes zu werfen. |
| − | Analogie: Dies stellt die Hinreaktion dar, bei der die Reaktanten zu Produkten reagieren. | + | '''Analogie:''' Dies stellt die Hinreaktion dar, bei der die Reaktanten zu Produkten reagieren. |
[[Datei:Holzapfelkrieg_Phase2.png|thumb|center|300px|Phase 2: Der Junge geht zum Angriff über.]] | [[Datei:Holzapfelkrieg_Phase2.png|thumb|center|300px|Phase 2: Der Junge geht zum Angriff über.]] | ||
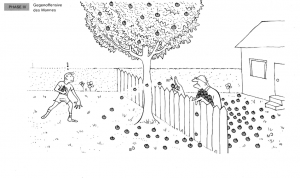
| + | ==== Phase 3: Der Mann beginnt, Äpfel zurückzuwerfen ==== | ||
| + | Der Mann beginnt, die Holzäpfel zurück in den Garten des Jungen zu werfen. | ||
| − | + | '''Analogie:''' Dies repräsentiert die Rückreaktion, bei der die Produkte wieder zu Reaktanten reagieren. | |
| − | + | ||
| + | [[Datei:Holzapfelkrieg_Phase3.png|thumb|center|300px|Phase 3: Gegenoffensive des Mannes.]] | ||
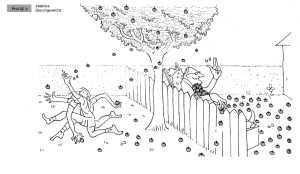
| − | + | ==== Phase 4: Stabiler Gleichgewichtszustand ==== | |
| + | Mit der Zeit wirft der Mann genauso viele Äpfel zurück in den Garten des Jungen, wie er in seinen Garten wirft. Es stellt sich ein Gleichgewichtszustand ein, bei dem die Anzahl der Holzäpfel, die in beide Richtungen geworfen werden, gleich ist. Im stabilen Gleichgewichtszustand ändern sich die Mengen an Holzäpfeln in den beiden Gärten nicht mehr, obwohl weiterhin Äpfel hin- und hergeworfen werden. Zwei Hauptfaktoren haben eine entscheidende Rolle bei der Bestimmung, wie viele Äpfel gesammelt und rübergeworfen werden und wie schnell dies geschieht: | ||
| − | + | : Fitness: Der jüngere, fittere Junge kann schneller Äpfel sammeln und rüberwerfen als der ältere Mann. | |
| + | : Anzahl der Äpfel im Garten: Der Garten des alten Mannes enthält mehr Äpfel, was ihm das Sammeln und Rüberwerfen der Äpfel erleichtert. | ||
| − | + | '''Analogie:''' Die Fitness des Jungen repräsentiert die Reaktionsgeschwindigkeit, je fitter der Junge, desto schneller kann er Äpfel sammeln und werfen, ähnlich der schnellen Umwandlung von Edukten in Produkte in einer chemischen Reaktion. Die Anzahl der Äpfel im Garten des alten Mannes symbolisiert die Konzentration der Edukte bzw. Produkte. Eine grössere Menge ermöglicht ihm ein effizienteres Sammeln und Werfen, vergleichbar mit der erhöhten Reaktionsgeschwindigkeit bei höheren Konzentrationen von Edukten. | |
| − | |||
| − | + | Dies stellt das chemische Gleichgewicht dar, bei dem die Reaktionsgeschwindigkeiten der Hin- und Rückreaktionen gleich sind und die Konzentrationen der Reaktanten und Produkte konstant bleiben. | |
[[Datei:Holzapfelkrieg_Phase4.png|thumb|center|300px|Phase 4: Stabiles Gleichgewicht.]] | [[Datei:Holzapfelkrieg_Phase4.png|thumb|center|300px|Phase 4: Stabiles Gleichgewicht.]] | ||
| + | ==== Bedeutung für dieses Gleichgewicht ==== | ||
| + | |||
| + | In der chemischen Reaktion versteht man unter Fitness die „Grundgeschwindigkeit“ der Hin- und Rückreaktionen, die durch die Aktivierungsenergie bestimmt wird und in die Reaktionsgeschwindigkeitskonstante 𝑘 einfliesst. Dies beeinflusst direkt die Geschwindigkeit, mit der die Reaktanten und Produkte umgesetzt werden. | ||
| + | |||
| + | Die „Anzahl der Äpfel“ symbolisiert die Gleichgewichtskonzentrationen der Edukte und Produkte. Diese Konzentrationen bleiben im chemischen Gleichgewicht konstant, obwohl die Reaktionen weiterhin auf molekularer Ebene stattfinden, was bedeutet, dass die Reaktionsgeschwindigkeiten der Hin- und Rückreaktion gleich sind. | ||
| + | |||
| + | == 3. Das Massenwirkungsgesetz == | ||
| + | ==== Einleitung ==== | ||
| + | Im vorangegangenen Abschnitt des "Holzapfelkriegs" haben wir gesehen, wie sich ein stabiles Gleichgewicht einstellt, wenn der Junge und der alte Mann eine gleichbleibende Anzahl an Äpfeln hin und her werfen. Jede Aktion des einen ruft eine gleichwertige Reaktion des anderen hervor, und trotz der fortwährenden Aktivität ändert sich die Gesamtzahl der Äpfel in jedem Garten nicht mehr. | ||
| + | Diese Beobachtung leitet uns zum Massenwirkungsgesetz über, einem zentralen Prinzip in der Chemie, das die Dynamik chemischer Gleichgewichte beschreibt. Ähnlich wie beim Holzapfelkrieg, bei dem eine Balance zwischen den geworfenen und zurückgeworfenen Äpfeln erreicht wird, beschreibt das Massenwirkungsgesetz die Balance zwischen den Reaktionsgeschwindigkeiten der Hin- und Rückreaktion in chemischen Reaktionen. | ||
| + | |||
| + | ==== Grundprinzipien ==== | ||
| + | In der Chemie erreicht eine Reaktion dann ein Gleichgewicht, wenn die Geschwindigkeit, mit der die Edukten zu Produkten reagieren (Hinreaktion), gleich der Geschwindigkeit ist, mit der die Produkte wieder zu Edukten reagieren (Rückreaktion). Das bedeutet, dass die Reaktionsgeschwindigkeiten RG<sub>hin</sub> und RG<sub>rück</sub> gleich sind. Dieser Zustand wird durch die Konstanten der Reaktionsgeschwindigkeiten und durch die Konzentrationen der beteiligten Stoffe bestimmt. | ||
| + | |||
| + | === Herleitung Schritt-für-Schritt === | ||
| + | |||
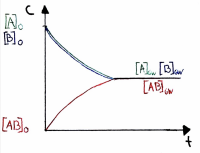
| + | Es ist nötig, das chemische Gleichgewicht mathematisch-quantitativ zu beschreiben, um berechnen zu können, wie gross die Konzentrationen der beteiligten Stoffe im Gleichgewicht sind (z.B. für den pH-Wert). Im Kontext der ''Powerpoint Apfelschlacht'' wird dies durch die Gleichung RG = f(k, c) verdeutlicht. | ||
| + | |||
| + | In einem chemischen Gleichgewicht sind die Geschwindigkeiten der Hin- und Rückreaktion gleich (RG<sub>hin</sub> = RG<sub>rück</sub>), weil die Reaktion reversibel ist. Dies führt dazu, dass keine Änderung in den Konzentrationen von Reaktanten und Produkten auftritt, was einen stabilen Zustand des Systems darstellt. | ||
| + | |||
| + | Gleichgewichtszustand: <span style="color:green;">RG<sub>hin</sub></span> = <span style="color:red;">RG<sub>rück</sub></span> | ||
| + | |||
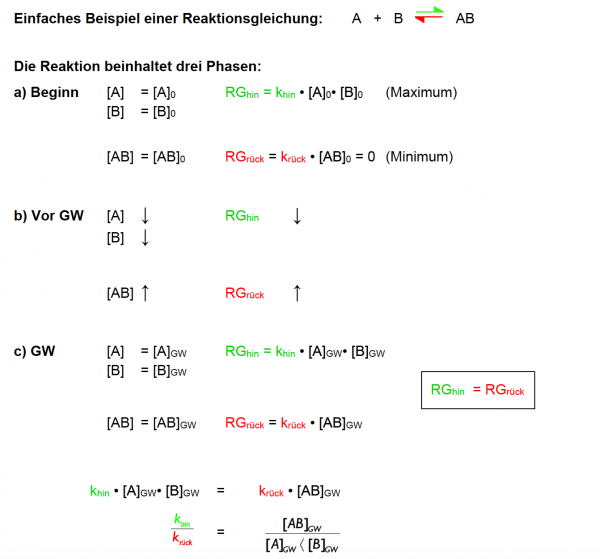
| + | Beginnen wir mit einer einfachen Reaktionsgleichung: '''A''' + '''B''' ⇌ '''AB''' | ||
| + | |||
| + | [[Datei:Schritt-für-Schritt Herleitung.png|thumb|center|600px|]] | ||
| + | |||
| + | ==== Die Reaktion beinhaltet drei Phasen: ==== | ||
| + | |||
| + | |||
| + | ;'''a) Beginn''' | ||
| + | |||
| + | :*'''Ausgangskonzentrationen:''' Die Reaktion beginnt mit den Anfangskonzentrationen von '''[A]''' und '''[B]''', bezeichnet als '''[A]<sub>0</sub>''' und '''[B]<sub>0</sub>'''. | ||
| + | |||
| + | :*'''Reaktionsgeschwindigkeit hin:''' Die Geschwindigkeit der Hinreaktion (<span style="color:green;">RG<sub>hin</sub></span>) ist am Anfang maximal, weil die Konzentrationen der Reaktanten am höchsten sind. Berechnet durch '''<span style="color:green;">k<sub>hin</sub></span>''' · '''[A]<sub>0</sub>''' · '''[B]<sub>0</sub>'''. | ||
| + | |||
| + | :*'''Reaktionsgeschwindigkeit rück:''' Die Geschwindigkeit der Rückreaktion (<span style="color:red;">RG<sub>rück</sub></span>) ist zu Beginn gleich Null, da noch kein Produkt '''[AB]''' vorhanden ist, um rückwärts zu reagieren '''<span style="color:red;">k<sub>rück</sub></span>''' · '''[AB]<sub>0</sub>''' = '''0'''. | ||
| − | |||
| − | |||
| − | + | ;'''b) Vor dem Gleichgewicht (GW)''' | |
| − | + | :*'''Abnahme der Reaktanten:''' Die Konzentrationen von '''[A]''' und '''[B]''' nehmen ab, weil sie zu '''[AB]''' reagieren. | |
| − | Da | + | :*'''Veränderung der Reaktionsgeschwindigkeiten:''' Da die Konzentrationen der Reaktanten abnehmen, nimmt auch '''<span style="color:green;">RG<sub>hin</sub></span>''' ab. Gleichzeitig steigt '''<span style="color:red;">RG<sub>rück</sub></span>''', da die Konzentration von '''[AB]''' durch die Hinreaktion zunimmt. |
| − | |||
| + | ;'''c) Gleichgewicht (GW)''' | ||
| − | + | :*'''Gleichgewichtskonzentrationen:''' Die Konzentrationen von '''[A]''', '''[B]''', und '''[AB]''' ändern sich nicht mehr weiter. Diese Konzentrationen werden mit '''[A]<sub>GW</sub>''', '''[B]<sub>GW</sub>''', und '''[AB]<sub>GW</sub>''' bezeichnet. | |
| − | * | + | :*'''Gleichgewichtsbedingung:''' Am Gleichgewichtspunkt sind die Geschwindigkeiten der Hin- und Rückreaktion gleich (<span style="color:green;">RG<sub>hin</sub></span> = <span style="color:red;">RG<sub>rück</sub></span>), was durch die Gleichung <span style="color:white;">: :</sub></span> '''<span style="color:green;">k<sub>hin</sub></span>''' · '''[A]<sub>GW</sub>''' · '''[B]<sub>GW</sub>''' = '''<span style="color:red;">k<sub>rück</sub></span>''' · '''[AB]<sub>GW</sub>''' ausgedrückt wird. |
| − | |||
| − | < | + | :*'''Verhältnis der Geschwindigkeitskonstanten:''' Das Verhältnis der Geschwindigkeitskonstanten '''<span style="color:green;">k<sub>hin</sub></span>''' / '''<span style="color:red;">k<sub>rück</sub></span>''' wird durch das Verhältnis der Gleichgewichtskonzentrationen beschrieben, was eine zentrale Aussage des Massenwirkungsgesetzes ist. |
| − | |||
| − | </ | ||
| − | |||
| − | |||
| − | + | '''Aussage:''' Im Zustand des chemischen Gleichgewichts sind die Konzentrationen aller Stoffe konstant, und können mathematisch berechnet werden: Das (mathematische) Produkt der Produktkonzentrationen geteilt durch das Produkt der Eduktkonzentrationen ist konstant. | |
| − | |||
| − | |||
| + | Da <span style="color:green;">k<sub>hin</sub></span> und <span style="color:red;">k<sub>rück</sub></span> konstant sind, können sie als neue Konstante zusammengefasst werden | ||
| + | --> K: Gleichgewichtskonstante | ||
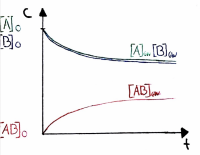
| − | + | Massenwirkungsgesetz: [[Datei:Massenwirkungsgesetz.png|thumb|center|200px|]] | |
| − | |||
| − | + | === Graphische Darstellungen === | |
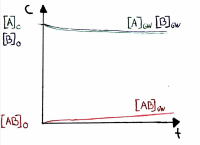
| − | + | [[Datei:Graphische Darstellunge.png|thumb|left|200px|]] | |
| − | |||
| − | |||
| − | |||
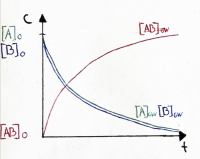
| − | + | ==== Verlauf der Gleichgewichtskonzentrationen ==== | |
| − | + | • Die Gleichgewichtskonzentrationen sind je nach Reaktion verschieden und werden durch K beschrieben. | |
| − | + | • Es ist auch möglich, dass die Gleichgewichtskonzentration der Edukte grösser ist als der Produkte | |
| − | + | • In dieser Graphik ist die Konzentration des Produktes höher, daher ist die Lage des Gleichgewichts rechts verschoben. | |
| − | + | [[Datei:Graphische Darstellung.png|thumb|right|200px|]] | |
| − | |||
| − | |||
| − | + | ||
| − | == | + | |
| − | + | ||
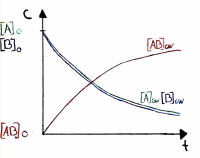
| − | Die | + | |
| − | + | ==== Verlauf von <span style="color:green;">RG<sub>hin</sub></span> und <span style="color:red;">RG<sub>rück</sub></span> ==== | |
| − | + | ||
| − | + | ||
| − | + | ||
| + | • Die Grösse der Reaktionsgeschwindigkeit im Gleichgewicht wird ebenfalls durch K beschrieben. | ||
| + | |||
| + | • Die Abnahme von RGhin ist der Abnahme der Eduktkonzentrationen proportional. | ||
| + | |||
| + | • In dieser Graphik überwiegen die Produkte, daher ist die Lage des Gleichgewichts rechts verschoben. | ||
| + | |||
| + | |||
| + | |||
| + | == 4. Allgemeine Form des Massenwirkungsgesetz == | ||
| + | Betrachten wir eine allgemeine reversible chemische Reaktion: | ||
| + | : aA + bB + ... ⇌ cC + dD + ... | ||
| + | : K = <span>[C]</span><sup>c</sup> · <span>[D]</span><sup>d</sup> · <span>[...]</span><sup>...</sup> / <span>[A]</span><sup>a</sup> · <span>[B]</span><sup>b</sup> · <span>[...]</span><sup>...</sup> | ||
| + | |||
| + | Hierbei sind: | ||
| + | * '''K''' die Gleichgewichstkonstante, | ||
| + | * '''A''' und '''B''' die Edukte, | ||
| + | * '''C''' und '''D''' die Produkte, | ||
| + | * '''a''', '''b''', '''c''' und '''d''' die stöchiometrischen Koeffizienten der jeweiligen Spezies (Elemente, Moleküle, Ionen etc.). | ||
| + | * '''[]''' repräsentieren die Konzentrationen der jeweiligen Spezies im Gleichgewichtszustand. | ||
| + | |||
| + | Im Gleichgewicht bleibt die Konzentration der Reaktanten und Produkte konstant, obwohl die Hin- und Rückreaktionen weiterhin stattfinden. | ||
| + | |||
| + | === Beispiele === | ||
| + | [[Datei:Beispiele_Synthese_von_Ammoniak_&_Bildung_von_Wasser.png|thumb|center|300px|]] | ||
| + | |||
| + | == 5. Bedeutung der Gleichgewichtskonstante == | ||
| + | === Einleitung === | ||
| + | Die Gleichgewichtskonstante K ist ein zentrales Konzept in der Chemie, das das Verhältnis der Konzentrationen von Produkten zu Reaktanten im chemischen Gleichgewicht beschreibt. Sie liefert wichtige Informationen über die Lage des Gleichgewichts und die Ausbeute einer chemischen Reaktion. | ||
| + | |||
| + | === Chemische Bedeutung der Gleichgewichtskonstanten K === | ||
| + | {| class="wikitable" | ||
| + | ! K-Wert | ||
| + | ! Beschreibung | ||
| + | ! Zusätzliche Info | ||
| + | ! Verlauf der Konzentrationen | ||
| + | |- | ||
| + | | K<sub>max</sub> → ∞ | ||
| + | | ''Es gibt nur noch Produkte'' | ||
| + | | ''Beim Reaktionstyp <span style="color:green;">∆H < 0, ∆S > 0</span>'' | ||
| + | | ''[[Datei:Konzentrationen1.png|thumb|right|200px|]]'' | ||
| + | |- | ||
| + | | K > I | ||
| + | | ''Die Produkte überwiegen'' | ||
| + | | ''Das Gleichgewicht liegt rechts'' | ||
| + | | ''[[Datei:Konzentrationen2.png|thumb|right|200px|]]'' | ||
| + | |- | ||
| + | | K = I | ||
| + | | ''Produkte und Edukte halten sich die Waage'' | ||
| + | | ''Das Gleichgewicht liegt in der Mitte'' | ||
| + | | ''[[Datei:Konzentrationen3.png|thumb|right|200px|]]'' | ||
| + | |- | ||
| + | | K < I | ||
| + | | ''Die Edukte überwiegen'' | ||
| + | | ''Das Gleichgewicht liegt links'' | ||
| + | | ''[[Datei:Konzentrationen4.png|thumb|right|200px|]]'' | ||
| + | |- | ||
| + | | K<sub>max</sub> → 0 | ||
| + | | ''Die Edukte reagieren gar nicht '' | ||
| + | | ''Beim Reaktionstyp <span style="color:red;">∆H > 0, ∆S < 0</span>'' | ||
| + | | ''[[Datei:Konzentrationen5.png|thumb|right|200px|]]'' | ||
| + | |} | ||
| + | |||
| + | == 6. Zusammenfassung des Videos "Was sagt der Kc-Wert aus?" == | ||
| + | Das Video erklärt die Bedeutung des Gleichgewichtskonstantenwertes Kc in chemischen Reaktionen. Hier sind die wichtigsten Punkte: | ||
| + | |||
| + | === 1. Definition von K: === | ||
| + | * K ist das Verhältnis der Konzentrationen der Produkte zu den Reaktanten im Gleichgewicht. | ||
| + | * Für die Reaktion: aA + bB ⇌ cC + dD lautet die Formel: | ||
| − | + | K = <span>[C]</span><sup>c</sup> · <span>[D]</span><sup>d</sup> / <span>[A]</span><sup>a</sup> · <span>[B]</span><sup>b</sup> | |
| − | |||
| − | |||
| − | |||
| − | : | + | === 2. Interpretation des Kc-Wertes: === |
| − | * | + | * K > 1: Das Gleichgewicht liegt rechts, auf der Seite der Produkte. Es bedeutet, dass im Gleichgewicht mehr Produkte als Reaktanten vorhanden sind. |
| − | + | * K < 1: Das Gleichgewicht liegt links, auf der Seite der Reaktanten. Es bedeutet, dass im Gleichgewicht mehr Reaktanten als Produkte vorhanden sind. | |
| − | * | + | * K ≈ 1: Die Konzentrationen der Reaktanten und Produkte sind im Gleichgewicht etwa gleich. |
| + | |||
| + | === 3. Einflussfaktoren: === | ||
| + | * Temperatur: Eine Änderung der Temperatur kann den Kc-Wert beeinflussen und das Gleichgewicht verschieben. | ||
| + | :* Exotherme Reaktionen: Erhöhung der Temperatur verschiebt das Gleichgewicht zu den Reaktanten (verringert Kc). | ||
| + | :* Endotherme Reaktionen: Erhöhung der Temperatur verschiebt das Gleichgewicht zu den Produkten (erhöht Kc). | ||
| + | |||
| + | ==== 4. Zusätzliches: ==== | ||
| + | * [[http://www.rdeuber.ch/chemiewiki/index.php?title=Die_Beeinflussung_des_Chemischen_Gleichgewichts:_Das_Prinzip_von_Le_Chatelier#Druck Druck]]: Bei Reaktionen mit gasförmigen Reaktanten und Produkten kann eine Druckänderung das Gleichgewicht beeinflussen. | ||
| + | |||
| + | * [[http://www.rdeuber.ch/chemiewiki/index.php?title=Die_Beeinflussung_des_Chemischen_Gleichgewichts:_Das_Prinzip_von_Le_Chatelier#Konzentration Konzentration]]: Änderungen der Konzentrationen der Reaktanten oder Produkte verschieben das Gleichgewicht nach dem [[http://www.rdeuber.ch/chemiewiki/index.php?title=Die_Beeinflussung_des_Chemischen_Gleichgewichts:_Das_Prinzip_von_Le_Chatelier Prinzip von Le Chatelier]]. | ||
| + | |||
| + | * [[http://www.rdeuber.ch/chemiewiki/index.php?title=Die_Beeinflussung_der_Reaktionsgeschwindigkeit#Katalysator Katalysatoren]]: Katalysatoren erhöhen die Geschwindigkeit der Hin- und Rückreaktionen, ohne die Lage des Gleichgewichts oder den Wert von Kc zu ändern. | ||
==Quellen== | ==Quellen== | ||
| Zeile 126: | Zeile 231: | ||
==Weblinks== | ==Weblinks== | ||
| − | + | ||
*[https://www.youtube.com/watch?v=z8IeyvQ5wFE Simple Club Video] | *[https://www.youtube.com/watch?v=z8IeyvQ5wFE Simple Club Video] | ||
Aktuelle Version vom 22. Juni 2024, 23:22 Uhr
Achtung: Diese Seite muss überarbeitet werden - Bitte nicht als Lerngrundlage verwenden!
Inhaltsverzeichnis
1. Das Chemische Gleichgewicht
Definition des Chemischen Gleichgewichts
Ein chemisches Gleichgewicht tritt auf, wenn in einem geschlossenen System die Hin- und Rückreaktionen einer chemischen Reaktion mit derselben Geschwindigkeit ablaufen. Dies bedeutet nicht, dass die chemische Aktivität aufgehört hat, sondern dass sich die Konzentrationen der Reaktanten und Produkte nicht mehr ändern.
Bedeutung des Chemischen Gleichgewichts
Das chemische Gleichgewicht ist ein zentrales Konzept in der Chemie, da es die Dynamik vieler chemischer Reaktionen beschreibt, die in der Natur und in der Industrie stattfinden. Es hilft uns zu verstehen, wie Reaktionen unter bestimmten Bedingungen ablaufen und wie wir diese Bedingungen beeinflussen können, um die Ausbeute an gewünschten Produkten zu maximieren.
Fragestellung
Die Lage des chemischen Gleichgewichts kann stark variieren und hängt von verschiedenen Faktoren ab. Dies wirft folgende wichtige Fragen auf:
- Wo genau liegt das Gleichgewicht in einer chemischen Reaktion?
- Welche Konzentrationen erreichen die Edukte und Produkte im Gleichgewichtszustand?
Antworten auf diese Kernfragen finden sich im weiteren Verlauf dieses Kapitels.
2. Der Holzapfelkrieg
Um die Lage des chemischen Gleichgewichts und Gleichgewichtskonzentration anschaulich zu erklären, verwenden wir das Beispiel des "Holzapfelkriegs". Dieses Beispiel hilft, den Gleichgewichtsprozesses zu visualisieren.
Phase 1: Vorbereitung zur Schlacht
Stellen Sie sich einen Holzapfelbaum vor, der genau auf der Grenze zwischen zwei Gärten steht. In einem Garten wohnt ein Junge, im anderen ein alter Mann. Der Baum trägt viele Holzäpfel, die auf beiden Seiten des Zauns fallen. Zu Beginn sammelt der Junge alle Holzäpfel in seinem Garten auf.
Analogie: Dies entspricht dem Start der Hinreaktion in einer chemischen Reaktion.
Phase 2: Der Junge geht zum Angriff über
Der Junge möchte die Holzäpfel loswerden und beginnt, sie in den Garten des alten Mannes zu werfen.
Analogie: Dies stellt die Hinreaktion dar, bei der die Reaktanten zu Produkten reagieren.
Phase 3: Der Mann beginnt, Äpfel zurückzuwerfen
Der Mann beginnt, die Holzäpfel zurück in den Garten des Jungen zu werfen.
Analogie: Dies repräsentiert die Rückreaktion, bei der die Produkte wieder zu Reaktanten reagieren.
Phase 4: Stabiler Gleichgewichtszustand
Mit der Zeit wirft der Mann genauso viele Äpfel zurück in den Garten des Jungen, wie er in seinen Garten wirft. Es stellt sich ein Gleichgewichtszustand ein, bei dem die Anzahl der Holzäpfel, die in beide Richtungen geworfen werden, gleich ist. Im stabilen Gleichgewichtszustand ändern sich die Mengen an Holzäpfeln in den beiden Gärten nicht mehr, obwohl weiterhin Äpfel hin- und hergeworfen werden. Zwei Hauptfaktoren haben eine entscheidende Rolle bei der Bestimmung, wie viele Äpfel gesammelt und rübergeworfen werden und wie schnell dies geschieht:
- Fitness: Der jüngere, fittere Junge kann schneller Äpfel sammeln und rüberwerfen als der ältere Mann.
- Anzahl der Äpfel im Garten: Der Garten des alten Mannes enthält mehr Äpfel, was ihm das Sammeln und Rüberwerfen der Äpfel erleichtert.
Analogie: Die Fitness des Jungen repräsentiert die Reaktionsgeschwindigkeit, je fitter der Junge, desto schneller kann er Äpfel sammeln und werfen, ähnlich der schnellen Umwandlung von Edukten in Produkte in einer chemischen Reaktion. Die Anzahl der Äpfel im Garten des alten Mannes symbolisiert die Konzentration der Edukte bzw. Produkte. Eine grössere Menge ermöglicht ihm ein effizienteres Sammeln und Werfen, vergleichbar mit der erhöhten Reaktionsgeschwindigkeit bei höheren Konzentrationen von Edukten.
Dies stellt das chemische Gleichgewicht dar, bei dem die Reaktionsgeschwindigkeiten der Hin- und Rückreaktionen gleich sind und die Konzentrationen der Reaktanten und Produkte konstant bleiben.
Bedeutung für dieses Gleichgewicht
In der chemischen Reaktion versteht man unter Fitness die „Grundgeschwindigkeit“ der Hin- und Rückreaktionen, die durch die Aktivierungsenergie bestimmt wird und in die Reaktionsgeschwindigkeitskonstante 𝑘 einfliesst. Dies beeinflusst direkt die Geschwindigkeit, mit der die Reaktanten und Produkte umgesetzt werden.
Die „Anzahl der Äpfel“ symbolisiert die Gleichgewichtskonzentrationen der Edukte und Produkte. Diese Konzentrationen bleiben im chemischen Gleichgewicht konstant, obwohl die Reaktionen weiterhin auf molekularer Ebene stattfinden, was bedeutet, dass die Reaktionsgeschwindigkeiten der Hin- und Rückreaktion gleich sind.
3. Das Massenwirkungsgesetz
Einleitung
Im vorangegangenen Abschnitt des "Holzapfelkriegs" haben wir gesehen, wie sich ein stabiles Gleichgewicht einstellt, wenn der Junge und der alte Mann eine gleichbleibende Anzahl an Äpfeln hin und her werfen. Jede Aktion des einen ruft eine gleichwertige Reaktion des anderen hervor, und trotz der fortwährenden Aktivität ändert sich die Gesamtzahl der Äpfel in jedem Garten nicht mehr. Diese Beobachtung leitet uns zum Massenwirkungsgesetz über, einem zentralen Prinzip in der Chemie, das die Dynamik chemischer Gleichgewichte beschreibt. Ähnlich wie beim Holzapfelkrieg, bei dem eine Balance zwischen den geworfenen und zurückgeworfenen Äpfeln erreicht wird, beschreibt das Massenwirkungsgesetz die Balance zwischen den Reaktionsgeschwindigkeiten der Hin- und Rückreaktion in chemischen Reaktionen.
Grundprinzipien
In der Chemie erreicht eine Reaktion dann ein Gleichgewicht, wenn die Geschwindigkeit, mit der die Edukten zu Produkten reagieren (Hinreaktion), gleich der Geschwindigkeit ist, mit der die Produkte wieder zu Edukten reagieren (Rückreaktion). Das bedeutet, dass die Reaktionsgeschwindigkeiten RGhin und RGrück gleich sind. Dieser Zustand wird durch die Konstanten der Reaktionsgeschwindigkeiten und durch die Konzentrationen der beteiligten Stoffe bestimmt.
Herleitung Schritt-für-Schritt
Es ist nötig, das chemische Gleichgewicht mathematisch-quantitativ zu beschreiben, um berechnen zu können, wie gross die Konzentrationen der beteiligten Stoffe im Gleichgewicht sind (z.B. für den pH-Wert). Im Kontext der Powerpoint Apfelschlacht wird dies durch die Gleichung RG = f(k, c) verdeutlicht.
In einem chemischen Gleichgewicht sind die Geschwindigkeiten der Hin- und Rückreaktion gleich (RGhin = RGrück), weil die Reaktion reversibel ist. Dies führt dazu, dass keine Änderung in den Konzentrationen von Reaktanten und Produkten auftritt, was einen stabilen Zustand des Systems darstellt.
Gleichgewichtszustand: RGhin = RGrück
Beginnen wir mit einer einfachen Reaktionsgleichung: A + B ⇌ AB
Die Reaktion beinhaltet drei Phasen:
- a) Beginn
- Ausgangskonzentrationen: Die Reaktion beginnt mit den Anfangskonzentrationen von [A] und [B], bezeichnet als [A]0 und [B]0.
- Reaktionsgeschwindigkeit hin: Die Geschwindigkeit der Hinreaktion (RGhin) ist am Anfang maximal, weil die Konzentrationen der Reaktanten am höchsten sind. Berechnet durch khin · [A]0 · [B]0.
- Reaktionsgeschwindigkeit rück: Die Geschwindigkeit der Rückreaktion (RGrück) ist zu Beginn gleich Null, da noch kein Produkt [AB] vorhanden ist, um rückwärts zu reagieren krück · [AB]0 = 0.
- b) Vor dem Gleichgewicht (GW)
- Abnahme der Reaktanten: Die Konzentrationen von [A] und [B] nehmen ab, weil sie zu [AB] reagieren.
- Veränderung der Reaktionsgeschwindigkeiten: Da die Konzentrationen der Reaktanten abnehmen, nimmt auch RGhin ab. Gleichzeitig steigt RGrück, da die Konzentration von [AB] durch die Hinreaktion zunimmt.
- c) Gleichgewicht (GW)
- Gleichgewichtskonzentrationen: Die Konzentrationen von [A], [B], und [AB] ändern sich nicht mehr weiter. Diese Konzentrationen werden mit [A]GW, [B]GW, und [AB]GW bezeichnet.
- Gleichgewichtsbedingung: Am Gleichgewichtspunkt sind die Geschwindigkeiten der Hin- und Rückreaktion gleich (RGhin = RGrück), was durch die Gleichung : : khin · [A]GW · [B]GW = krück · [AB]GW ausgedrückt wird.
- Verhältnis der Geschwindigkeitskonstanten: Das Verhältnis der Geschwindigkeitskonstanten khin / krück wird durch das Verhältnis der Gleichgewichtskonzentrationen beschrieben, was eine zentrale Aussage des Massenwirkungsgesetzes ist.
Aussage: Im Zustand des chemischen Gleichgewichts sind die Konzentrationen aller Stoffe konstant, und können mathematisch berechnet werden: Das (mathematische) Produkt der Produktkonzentrationen geteilt durch das Produkt der Eduktkonzentrationen ist konstant.
Da khin und krück konstant sind, können sie als neue Konstante zusammengefasst werden --> K: Gleichgewichtskonstante
Massenwirkungsgesetz:
Graphische Darstellungen
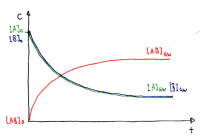
Verlauf der Gleichgewichtskonzentrationen
• Die Gleichgewichtskonzentrationen sind je nach Reaktion verschieden und werden durch K beschrieben.
• Es ist auch möglich, dass die Gleichgewichtskonzentration der Edukte grösser ist als der Produkte
• In dieser Graphik ist die Konzentration des Produktes höher, daher ist die Lage des Gleichgewichts rechts verschoben.
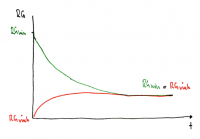
Verlauf von RGhin und RGrück
• Die Grösse der Reaktionsgeschwindigkeit im Gleichgewicht wird ebenfalls durch K beschrieben.
• Die Abnahme von RGhin ist der Abnahme der Eduktkonzentrationen proportional.
• In dieser Graphik überwiegen die Produkte, daher ist die Lage des Gleichgewichts rechts verschoben.
4. Allgemeine Form des Massenwirkungsgesetz
Betrachten wir eine allgemeine reversible chemische Reaktion:
- aA + bB + ... ⇌ cC + dD + ...
- K = [C]c · [D]d · [...]... / [A]a · [B]b · [...]...
Hierbei sind:
- K die Gleichgewichstkonstante,
- A und B die Edukte,
- C und D die Produkte,
- a, b, c und d die stöchiometrischen Koeffizienten der jeweiligen Spezies (Elemente, Moleküle, Ionen etc.).
- [] repräsentieren die Konzentrationen der jeweiligen Spezies im Gleichgewichtszustand.
Im Gleichgewicht bleibt die Konzentration der Reaktanten und Produkte konstant, obwohl die Hin- und Rückreaktionen weiterhin stattfinden.
Beispiele
5. Bedeutung der Gleichgewichtskonstante
Einleitung
Die Gleichgewichtskonstante K ist ein zentrales Konzept in der Chemie, das das Verhältnis der Konzentrationen von Produkten zu Reaktanten im chemischen Gleichgewicht beschreibt. Sie liefert wichtige Informationen über die Lage des Gleichgewichts und die Ausbeute einer chemischen Reaktion.
Chemische Bedeutung der Gleichgewichtskonstanten K
| K-Wert | Beschreibung | Zusätzliche Info | Verlauf der Konzentrationen |
|---|---|---|---|
| Kmax → ∞ | Es gibt nur noch Produkte | Beim Reaktionstyp ∆H < 0, ∆S > 0 | |
| K > I | Die Produkte überwiegen | Das Gleichgewicht liegt rechts | |
| K = I | Produkte und Edukte halten sich die Waage | Das Gleichgewicht liegt in der Mitte | |
| K < I | Die Edukte überwiegen | Das Gleichgewicht liegt links | |
| Kmax → 0 | Die Edukte reagieren gar nicht | Beim Reaktionstyp ∆H > 0, ∆S < 0 |
6. Zusammenfassung des Videos "Was sagt der Kc-Wert aus?"
Das Video erklärt die Bedeutung des Gleichgewichtskonstantenwertes Kc in chemischen Reaktionen. Hier sind die wichtigsten Punkte:
1. Definition von K:
- K ist das Verhältnis der Konzentrationen der Produkte zu den Reaktanten im Gleichgewicht.
- Für die Reaktion: aA + bB ⇌ cC + dD lautet die Formel:
K = [C]c · [D]d / [A]a · [B]b
2. Interpretation des Kc-Wertes:
- K > 1: Das Gleichgewicht liegt rechts, auf der Seite der Produkte. Es bedeutet, dass im Gleichgewicht mehr Produkte als Reaktanten vorhanden sind.
- K < 1: Das Gleichgewicht liegt links, auf der Seite der Reaktanten. Es bedeutet, dass im Gleichgewicht mehr Reaktanten als Produkte vorhanden sind.
- K ≈ 1: Die Konzentrationen der Reaktanten und Produkte sind im Gleichgewicht etwa gleich.
3. Einflussfaktoren:
- Temperatur: Eine Änderung der Temperatur kann den Kc-Wert beeinflussen und das Gleichgewicht verschieben.
- Exotherme Reaktionen: Erhöhung der Temperatur verschiebt das Gleichgewicht zu den Reaktanten (verringert Kc).
- Endotherme Reaktionen: Erhöhung der Temperatur verschiebt das Gleichgewicht zu den Produkten (erhöht Kc).
4. Zusätzliches:
- [Druck]: Bei Reaktionen mit gasförmigen Reaktanten und Produkten kann eine Druckänderung das Gleichgewicht beeinflussen.
- [Konzentration]: Änderungen der Konzentrationen der Reaktanten oder Produkte verschieben das Gleichgewicht nach dem [Prinzip von Le Chatelier].
- [Katalysatoren]: Katalysatoren erhöhen die Geschwindigkeit der Hin- und Rückreaktionen, ohne die Lage des Gleichgewichts oder den Wert von Kc zu ändern.
Quellen
- Eigene Notizen