Grundlagen der Reaktionsgeschwindigkeit: Unterschied zwischen den Versionen
Mberth (Diskussion | Beiträge) |
Mberth (Diskussion | Beiträge) |
||
| (30 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
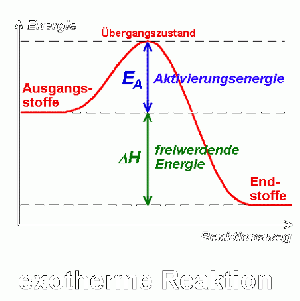
| + | [[image:EnergiediagrammExothermeReaktion.gif|thumb|right|Energiediagramm, Delta H beschreibt die freigewordene Energie (exotherm); für eine detailliertere Sicht siehe [https://www.seilnacht.com/Lexikon/aktiv2.html]]] | ||
| + | |||
__TOC__ | __TOC__ | ||
===Grundlagen der Reaktionsgeschwindigkeit=== | ===Grundlagen der Reaktionsgeschwindigkeit=== | ||
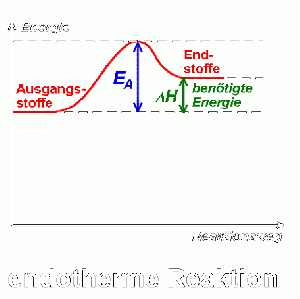
| − | [[image: | + | [[image:EnergiediagrammEndothermeReaktion.gif|thumb|right|Energiediagramm, Delta H beschreibt die benötigte Energie (endotherm); für eine detailliertere Sicht siehe [https://www.seilnacht.com/Lexikon/aktiv2.html]]] |
| + | |||
| + | Die Reaktionsgeschwindigkeit ist ein Mass dafür, wie viele Teilchen in einem bestimmten Volumen während einer chemischen Reaktion pro Zeiteinheit reagieren. Je höher die Reaktionsgeschwindigkeit ist – also je schneller eine Reaktion abläuft – desto schneller nimmt die Konzentration der Edukte ab. Die Reaktionsgeschwindigkeit (RG) kann demnach auch beeinflusst werden, indem die Eduktkonzentration erhöht oder verringert wird. | ||
| + | |||
| + | Definition RG: | ||
| + | <b> v= Δc/Δt </b> | ||
| + | |||
| + | → Abnahme der Konzentration pro Zeit und Volumen. | ||
| + | |||
| + | Reaktionsgeschwindigkeit ist von äusseren Einflüssen abhängig und kann durch Faktoren wie Temperatur, Druck und Katalysatoren beeinflusst werden. | ||
| + | Um die Reaktionsgeschwindigkeit genauer verstehen zu können, muss man sich bewusst sein, dass jede Reaktion ihre eigene charakteristische Zeit hat, in der sie abläuft. Hierbei unterscheiden wir zwischen langsamen und schnellen Reaktionen. Während schnelle Reaktionen oft innerhalb von Sekundenbruchteilen ablaufen, gibt es langsame Reaktionen, die Monate bis Jahre dauern können. | ||
| + | |||
| + | Schnelle und langsame Reaktionen: | ||
| − | + | Ein Beispiel für eine schnelle Reaktion wären Explosionen oder Verbrennungen sowie die Fällung von Salzen. Schnelle Reaktionen sind oft exotherm, geben also Wärme ab. | |
| − | |||
| − | |||
| − | Schnelle Reaktionen sind oft exotherm, geben also Wärme ab. | ||
| − | + | Ein Beispiel für eine langsamere Reaktion wäre das Rosten von Metall oder das Verderben von Lebensmitteln. | |
| − | |||
| − | Der Unterschied zwischen schnellen und langsamen Reaktionen liegt | + | Der Unterschied zwischen schnellen und langsamen Reaktionen liegt darin, wie schnell sich die Konzentration der jeweiligen reagierenden Stoffe ändert. Je schneller sich die Konzentration der Edukte ändert, desto schneller verläuft eine Reaktion. Damit Edukte mit neuen Stoffen reagieren können, müssen sich deren bestehende Bindungen zuerst lösen. Das Lösen der vorherigen Bindungen benötigt einen bestimmten Energieaufwand (Aktivierungsenergie). |
| − | |||
| + | Bei beiden Reaktionen müssen zunächst die anziehenden Kräfte überwunden werden. Erst wenn die alten Bindungen getrennt sind, können sich neue Bindungen bilden und die Reaktion kann ablaufen. | ||
| + | |||
| + | Im Verlauf der Reaktion steigt die potenzielle Energie der Edukte an (Lockerung der Bindungen) und erreicht ein Maximum. Sobald neue Bindungen geknüpft werden, sinkt die potenzielle Energie wieder. Bei exothermen Reaktionen ist der Energiegehalt der Produkte niedriger als der der Edukte. Bei endothermen Reaktionen ist der Energiegehalt der Edukte niedriger als der der Produkte. ΔH beschreibt die freigewordene Energie (exotherm) und die benötigte Energie (endotherm) der Reaktionen. | ||
===Stosstheorie=== | ===Stosstheorie=== | ||
| Zeile 25: | Zeile 37: | ||
Für jede Reaktion lässt sich eine minimale kinetische Energie (erforderliche Aktivierungsenergie) definieren, damit eine Reaktion erfolgreich ablaufen kann. | Für jede Reaktion lässt sich eine minimale kinetische Energie (erforderliche Aktivierungsenergie) definieren, damit eine Reaktion erfolgreich ablaufen kann. | ||
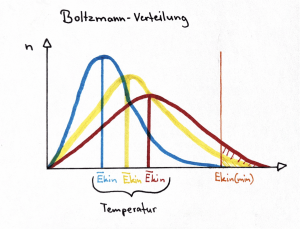
| − | [[image:Boltzmann-Verteilung. | + | [[image:Boltzmann-Verteilung eigeneGrafik.png|thumb|right|Boltzmann-Verteilung, Verhältnis Temperatur und Anzahl Teilchen; E<sub>kin (min)</sub> entspricht der E<sub>A</sub>]] |
===Boltzmann-Verteilung=== | ===Boltzmann-Verteilung=== | ||
| − | Die Boltzmann-Verteilung | + | Die Boltzmann-Verteilung hilft zu bestimmen, wie viele Teilchen in einem System die notwendige kinetische Energie haben, um die Aktivierungsenergie für eine chemische Reaktion zu überwinden, was die Wahrscheinlichkeit erfolgreicher Zusammenstösse beeinflusst. Sie zeigt, dass Teilchen mit höherer kinetischer Energie weniger häufig vorkommen als solche mit niedrigerer kinetischer Energie. |
| + | Wichtig für die Boltzmann-Verteilung ist das Konzept der Stosstheorie; dabei ist die Berücksichtigung und Unterscheidung zwischen der Anzahl der gesamten Zusammenstösse und der Anzahl erfolgreichen Zusammenstösse entscheidend. | ||
| + | |||
| + | |||
| + | |||
| + | == Quellen == | ||
| + | * Chemieunterlagen | ||
| + | * Buch: Chemie für das Gymnasium, Günter Baars und Roger Deuber, 2. Auflage, Kapitel 11 | ||
== Weblinks == | == Weblinks == | ||
* [https://www.youtube.com/watch?v=HrEtl5mVRmM/ Reaktionsgeschwindigkeit] – Video zur Reaktionsgeschwindigkeit (Simpleclub) | * [https://www.youtube.com/watch?v=HrEtl5mVRmM/ Reaktionsgeschwindigkeit] – Video zur Reaktionsgeschwindigkeit (Simpleclub) | ||
Aktuelle Version vom 16. Juni 2024, 10:12 Uhr
Inhaltsverzeichnis
Grundlagen der Reaktionsgeschwindigkeit
Die Reaktionsgeschwindigkeit ist ein Mass dafür, wie viele Teilchen in einem bestimmten Volumen während einer chemischen Reaktion pro Zeiteinheit reagieren. Je höher die Reaktionsgeschwindigkeit ist – also je schneller eine Reaktion abläuft – desto schneller nimmt die Konzentration der Edukte ab. Die Reaktionsgeschwindigkeit (RG) kann demnach auch beeinflusst werden, indem die Eduktkonzentration erhöht oder verringert wird.
Definition RG: v= Δc/Δt
→ Abnahme der Konzentration pro Zeit und Volumen.
Reaktionsgeschwindigkeit ist von äusseren Einflüssen abhängig und kann durch Faktoren wie Temperatur, Druck und Katalysatoren beeinflusst werden. Um die Reaktionsgeschwindigkeit genauer verstehen zu können, muss man sich bewusst sein, dass jede Reaktion ihre eigene charakteristische Zeit hat, in der sie abläuft. Hierbei unterscheiden wir zwischen langsamen und schnellen Reaktionen. Während schnelle Reaktionen oft innerhalb von Sekundenbruchteilen ablaufen, gibt es langsame Reaktionen, die Monate bis Jahre dauern können.
Schnelle und langsame Reaktionen:
Ein Beispiel für eine schnelle Reaktion wären Explosionen oder Verbrennungen sowie die Fällung von Salzen. Schnelle Reaktionen sind oft exotherm, geben also Wärme ab.
Ein Beispiel für eine langsamere Reaktion wäre das Rosten von Metall oder das Verderben von Lebensmitteln.
Der Unterschied zwischen schnellen und langsamen Reaktionen liegt darin, wie schnell sich die Konzentration der jeweiligen reagierenden Stoffe ändert. Je schneller sich die Konzentration der Edukte ändert, desto schneller verläuft eine Reaktion. Damit Edukte mit neuen Stoffen reagieren können, müssen sich deren bestehende Bindungen zuerst lösen. Das Lösen der vorherigen Bindungen benötigt einen bestimmten Energieaufwand (Aktivierungsenergie).
Bei beiden Reaktionen müssen zunächst die anziehenden Kräfte überwunden werden. Erst wenn die alten Bindungen getrennt sind, können sich neue Bindungen bilden und die Reaktion kann ablaufen.
Im Verlauf der Reaktion steigt die potenzielle Energie der Edukte an (Lockerung der Bindungen) und erreicht ein Maximum. Sobald neue Bindungen geknüpft werden, sinkt die potenzielle Energie wieder. Bei exothermen Reaktionen ist der Energiegehalt der Produkte niedriger als der der Edukte. Bei endothermen Reaktionen ist der Energiegehalt der Edukte niedriger als der der Produkte. ΔH beschreibt die freigewordene Energie (exotherm) und die benötigte Energie (endotherm) der Reaktionen.
Stosstheorie
Bei chemischen Reaktionen, wie zum Beispiel das Rosten von Eisen, wird von aussen keine Energie hinzugefügt, daher muss die Aktivierungsenergie von den Edukten selbst stammen. Ein Stoff kann bei Raumtemperatur und in allen Aggregatszuständen eine kleine oder hohe kinetische Energie aufweisen, da sich die Teilchen in einem Stoff eigenständig bewegen. Die Teilchen müssen für das Funktionieren einer Reaktion miteinander kollidieren, jedoch führt nicht jede Kollision zu einer Reaktion. Nur Kollisionen, bei denen die Teilchen eine ausreichende kinetische Energie haben, um die Aktivierungsenergie der Reaktion zu überwinden, können zu einer Reaktion führen. Man muss zwischen der gesamten Anzahl und der Anzahl erfolgreicher Zusammenstösse unterscheiden, da nicht alle gleicht stark sind. Die Ausrichtung der Teilchen ist zudem auch relevant, denn je nachdem, wie die Teilchen ausgerichtet sind, werden beim Zusammenstoss vorhandene Bindungen gelockert. Bei einem ausreichend heftigen Zusammenprall werden die Bindungen schliesslich so stark geschwächt, dass sich die neuen Bindungen der Produkte bilden können. Für jede Reaktion lässt sich eine minimale kinetische Energie (erforderliche Aktivierungsenergie) definieren, damit eine Reaktion erfolgreich ablaufen kann.
Boltzmann-Verteilung
Die Boltzmann-Verteilung hilft zu bestimmen, wie viele Teilchen in einem System die notwendige kinetische Energie haben, um die Aktivierungsenergie für eine chemische Reaktion zu überwinden, was die Wahrscheinlichkeit erfolgreicher Zusammenstösse beeinflusst. Sie zeigt, dass Teilchen mit höherer kinetischer Energie weniger häufig vorkommen als solche mit niedrigerer kinetischer Energie. Wichtig für die Boltzmann-Verteilung ist das Konzept der Stosstheorie; dabei ist die Berücksichtigung und Unterscheidung zwischen der Anzahl der gesamten Zusammenstösse und der Anzahl erfolgreichen Zusammenstösse entscheidend.
Quellen
- Chemieunterlagen
- Buch: Chemie für das Gymnasium, Günter Baars und Roger Deuber, 2. Auflage, Kapitel 11
Weblinks
- Reaktionsgeschwindigkeit – Video zur Reaktionsgeschwindigkeit (Simpleclub)