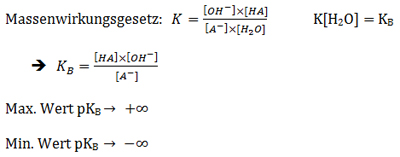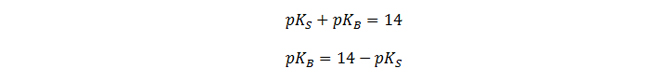Berechnen und Messen des pH-Werts: Unterschied zwischen den Versionen
(→Berechnung des pH-Wertes schwacher Säuren und Basen) |
(→Starke Säuren) |
||
| (6 dazwischenliegende Versionen von 2 Benutzern werden nicht angezeigt) | |||
| Zeile 27: | Zeile 27: | ||
== Das Berechnen von pH-Werten == | == Das Berechnen von pH-Werten == | ||
| − | + | Wozu ist das Berechnen von pH-WErten gut? Dazu folgende Situation: Wird ein Organ transplantiert, muss es während des Transports in einer Lösung transportiert werden, die während der ganzen Zeit ganz genau dem physiologischen pH-Wert von 7.4 entspricht. Auch kleinere Abweichungen führen zur Denaturierung von Proteinen, sodass z.B: Enzyme nicht mehr richtig funktionieren, was das Organ schädigt. | |
| + | Dazu muss man natürlich wissen, wie man eine Lösung mit einem ganz bestimmten pH-Wert herstellen kann. | ||
| Zeile 40: | Zeile 41: | ||
Erklärung: | Erklärung: | ||
| − | Jedes HCl gibt 1 H+ ab → wir haben 0.1 M H3O+-Ionen → pH = -log [H3O+] = 1 | + | Jedes HCl gibt 1 H+ ab → wir haben 0.1 M H3O+-Ionen → '''pH = -log [H3O+]''' (in diesem Fall = 1) |
| Zeile 53: | Zeile 54: | ||
| − | === Starke Säuren === | + | === Starke und schwache Säuren === |
Die (H<sub>3</sub>O<sup>+</sup>)-Konzentration entspricht der Anfangskonzentration [HA]<sub>0</sub>, wenn es sich um eine starke Säure handelt, denn praktisch jedes Teilchen reagiert mit Wasser. Deshalb liegt das Gleichgewicht bei einer Reaktion mit einer starken Säure ganz rechts. | Die (H<sub>3</sub>O<sup>+</sup>)-Konzentration entspricht der Anfangskonzentration [HA]<sub>0</sub>, wenn es sich um eine starke Säure handelt, denn praktisch jedes Teilchen reagiert mit Wasser. Deshalb liegt das Gleichgewicht bei einer Reaktion mit einer starken Säure ganz rechts. | ||
| Zeile 148: | Zeile 149: | ||
(HAc ist in diesem Fall das Symbol für eine schwache Säure) | (HAc ist in diesem Fall das Symbol für eine schwache Säure) | ||
Aus dieser Formel HAc + H<sub>2</sub>O ↔ Ac- + H<sub>3</sub>O<sup>+</sup>. Nehmen wir als Beispiel Essigsäure. Diese hat einen pKs-Wert von 4.8, woraus wir schliessen können, dass es sich um eine typische schwache Säure handelt. | Aus dieser Formel HAc + H<sub>2</sub>O ↔ Ac- + H<sub>3</sub>O<sup>+</sup>. Nehmen wir als Beispiel Essigsäure. Diese hat einen pKs-Wert von 4.8, woraus wir schliessen können, dass es sich um eine typische schwache Säure handelt. | ||
| + | Siehe Kapitel E. chemisches Gleichgewicht. Link: [[E Das Chemische Gleichgewicht]] | ||
Aktuelle Version vom 21. Juni 2022, 10:23 Uhr
Inhaltsverzeichnis
Das Messen von pH-Werten
SIB-Indikatoren
Prinzip: H Ind ⇌ Ind- + H+
Die Wirkung des Indikators als Säure oder als Base soll vernachlässigbar sein.
In einer stark sauren Lösung (viele H+-Ionen) dominiert Farbe 1 auf Grund einer hohen H3O+ -Konzentration. Aus dem Massenwirkungsgesetzt wird ersichtlich, dass ein grosser Protonendruck herrscht (alles wird protoniert), wodurch eine Verschiebung des Gleichgewichts nach links stattfindet. Bei einer stark basischen Lösung herrscht hingegen ein Protonensog.
Mit diesem Prinzip der Farbänderung funktionieren Universalindikator-Stäbchen. Auf diesen Stäbchen sind verschiedene Indikatoren, welche alle einen anderen Farbumschlag sichtbar machen, angeordnet. Zur genauen Bestimmung des pH-Wertes wird also nicht nur eine Farbänderung erreicht. Die unterschiedlichen Farbanordnungen lassen eine Spezifischere Bestimmung zu, als beispielsweise pH-Papier.
pH-Meter
Ein pH-Meter ist ein Gerät, welches die elektrische Leitfähigkeit misst.
Die elektrische Leitfähigkeit einer Säure oder Base hängt von der Konzentration der geladenen Teilchen ab: Je mehr geladene Teilchen, welche in diesem Fall H3O+ -Teilchen sind, umso höher ist die Leitfähigkeit und umso tiefer ist der pH-Welt.
So sieht auf jeden Fall die Theorie aus. In Wirklichkeit gibt es aber noch mehr Ionen, welche das genaue Messen stören. Des Weiteren gehen bei der Digitalisierung der Daten durch Auflösen und Runden von Werten Informationen über genaue Messdaten verloren.
Video von Simpleclub zum Messen des pH-Werts:
pH-Wert experimentell bestimmen
Das Berechnen von pH-Werten
Wozu ist das Berechnen von pH-WErten gut? Dazu folgende Situation: Wird ein Organ transplantiert, muss es während des Transports in einer Lösung transportiert werden, die während der ganzen Zeit ganz genau dem physiologischen pH-Wert von 7.4 entspricht. Auch kleinere Abweichungen führen zur Denaturierung von Proteinen, sodass z.B: Enzyme nicht mehr richtig funktionieren, was das Organ schädigt. Dazu muss man natürlich wissen, wie man eine Lösung mit einem ganz bestimmten pH-Wert herstellen kann.
Konkrete Fragestellung: Wieviel Säure (bzw. Base) muss einer bestimmten Menge Wasser zugegeben werden, damit ein bestimmter pH-Wert erreicht wird?
Wenn ich z.B. 1 Mol einer Säure in einem Liter Wasser gebe (d.h. Konzentration 1 M), wie ist dann der pH-Wert?
Auf diese Frage bekommen wir durch experimentelles Ausprobieren / Bestimmen eine Antwort.
1. Experiment:
Wir geben 0.1Mol HCL zu einem Liter Wasser (Salzsäure) dazu.
Beim messen mit einem Indikator hat die Lösung den pH-Wert 0
Erklärung: Jedes HCl gibt 1 H+ ab → wir haben 0.1 M H3O+-Ionen → pH = -log [H3O+] (in diesem Fall = 1)
2. Experiment:
Wir geben 0.1Mol Essigsäure zu einem Liter Wasser dazu.
Beim messen mit einem Indikator hat die Lösung einen deutliche höheren pH-Wert von 2.4.
Erklärung: Das Gleichgewicht der Reaktion liegt nicht ganz rechts, d.h. nur ein Teil der Essigsäure-Teilchen geben ein H+ ab.
Nun lässt sich feststellen, dass es ein bedeutender Unterschied zwischen der Berechnung der starken und der Berechnung der schwachen Säure besteht.
Starke und schwache Säuren
Die (H3O+)-Konzentration entspricht der Anfangskonzentration [HA]0, wenn es sich um eine starke Säure handelt, denn praktisch jedes Teilchen reagiert mit Wasser. Deshalb liegt das Gleichgewicht bei einer Reaktion mit einer starken Säure ganz rechts. Bei schwachen Säuren läuft die Reaktion nicht vollständig ab, denn ein pH-Wert von 2 bedeutet, dass es schon mehr als 10× weniger (H3O+)-Ionen hat. Deshalb liegt das Gleichgewicht bei einer Reaktion mit einer schwachen Säure nicht ganz rechts.
Schlussfolgerung aus den 2 Experimenten:
Es gibt offenbar starke Säuren, bei denen das Gleichgewicht ganz rechts liegt, dann gilt pH = -log[HA]0.
Es gibt aber auch schwache Säuren, bei denen das Gleichgewicht nicht ganz rechts liegt, dann muss man wissen, wo das Gleichgewicht liegt.
Wir brauchen ein Mass für die Stärke von Säuren und Basen aus zwei Gründen:
• Um bei Säuren (und Basen) bestimmen zu können, ob das GW genügend stark rechts liegt, sodass sie als starke Säuren bezeichnet werden können.
• Um auch bei schwachen Säuren den pH-Wert bestimmen zu können.
Zusammenfassend kann festgehalten werden:
• starke Säure → [H3O+] ^= [HA]0
• schwache Säuren müssen anders berechnet werden
Da die Reaktion mit Wasser nicht vollständig verläuft, muss die Stärke der Säure bzw. Base in die Berechnung einfliessen. Dazu muss zunächst ein Mass für die Säure- bzw. Basenstärke erarbeitet werden.
→ Zum Berechnen der pH-Werte muss das genaue Wissen über Art und Menge der Säure bzw. Base in der Lösung vorhanden sein.
Exkurse
Das Mass für die Stärke von Säuren: Der pKs-Wert
Ein Mass für die Stärke von Säuren ist der pKs –Wert. Er gibt Auskunft darüber, wie stark eine Säure ist. Es ist der negative Logarithmus der Gleichgewichtskonstante Ks, wenn eine Säure bzw Base mit Wasser reagiert.
Mit dem Massenwirkungsgesetz kann die Lage des Gleichgewichts gemessen werden, wenn eine bestimmte Menge einer Säure in Wasser gegeben wird.
Reaktionsgleichung: HA + H2O ⇌ H3O+ + A-
Herleitung:
Der maximale Wert strebt gegen ∞ → Je positiver, desto schwächer die Säure
Der minimale Wert strebt gegen -∞ → Je negativer, desto stärker die Säure
Eine starke Säure hat einen pKs-Wert mit negativem Vorzeichen, das wird aufgrund der Ks-Gleichung erklärt.
Der pKs-Wert ist somit die Stärke der Säure gegenüber Wasser. HA ist hierbei die Säure, welche ihr Proton abgibt. Die Konzentration des Wassers kann hier vernachlässigt werden, da sie beinahe konstant bleibt. Man sieht hier also, dass bei einem hohen Ks-Wert die Konzentration an Edukten sehr niedrig ist.
Die Stärke von Basen: Der pKB-Wert
Base + H2O ⇌ konj. Säure + OH-
Je stärker die konjugierte Säure, umso schwächer ist die Base, da die starke Säure Tendenz hat Protonen abzugeben und die schwache Säure notwendigerweise eine geringere, die Protonen zu halten.
Basen sind stark, wenn pKB < 0
Berechnung des pKB aus dem pKs:
Hier sieht man auch wieder, dass eine starke Säure eine schwache konjugierte Base hat.
Mit diesen weiteren Kenntnissen, können nun auch der pH-Wert schwacher Säuren bzw Basen berechnet werden.
Mathematische Herleitung von pKs und pKb Werten
(Für Interessierte, aber nicht Prüfungsrelevant)
Berechnung des pH-Wertes starker Säuren und Basen
Aus dem einleitenden Experiment "das Berechnen von pH-Werten" geht wie erwähnt die folgende Berechnugsformel hervor.
Aus diesem Zusammenhang lässt sich auch der Berechnungsweg für starke Basen herleiten.
Achtung! Wenn Säuren mehrmals reagieren können, wie mehrprotonige Säuren, muss die Anzahl der OH- - und H3O+ - Ionen aus der Formel des Stoffes hergeleitet werden.
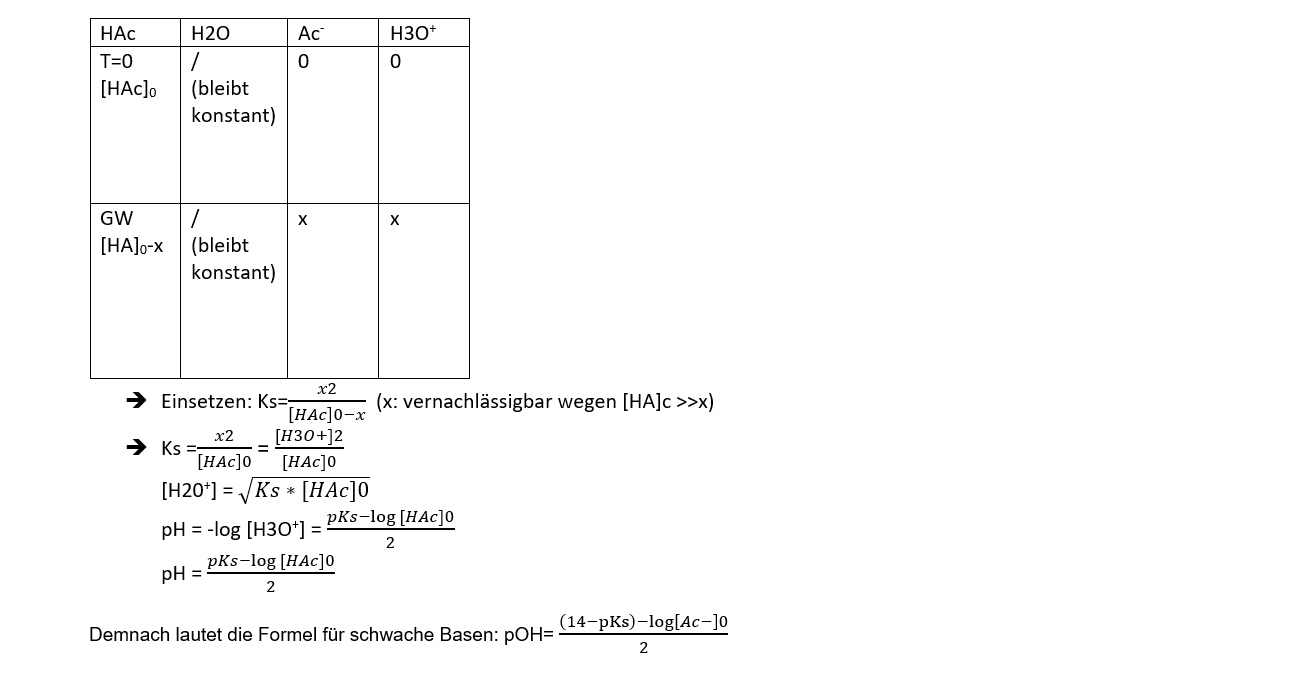
Berechnung des pH-Wertes schwacher Säuren und Basen
(HAc ist in diesem Fall das Symbol für eine schwache Säure) Aus dieser Formel HAc + H2O ↔ Ac- + H3O+. Nehmen wir als Beispiel Essigsäure. Diese hat einen pKs-Wert von 4.8, woraus wir schliessen können, dass es sich um eine typische schwache Säure handelt. Siehe Kapitel E. chemisches Gleichgewicht. Link: E Das Chemische Gleichgewicht
→ Die Säurekonstante einer starken Säure ist gross, die Basenkonstante ihrer korrespondierenden Base entsprechend klein. → Die Basenkonstante starken Basen ist gross, die Säurekonstante ihrer korrespondierenden Säure ist deshalb klein → Die Stärke einer Säure, d.h. die Leichtigkeit, mit der sie Protonen abgibt, wird durch die Säurekonstante ausgedrückt → Die Basenkonstante gibt, die Stärke einer Base an, d.h. die Leichtigkeit, mit der sie Protonen aufnimmt.
Zusammenfassung: Video von the Simple Chemics
pH-Wert berechnen
Link: pH-Wert berechnen REMAKE
Das Video zeigt das Vorgehen, wie man den pH-Wert berechnen kann. Zuerst erläutern sie, welche Schritte man durchführen muss, bevor man mit dem Rechnen beginnt. Dann zeigen sie alle Formeln zur Berechnung auf. Am Schluss gibt es noch 2 Beispiele, anhand welchen alles nochmal erklärt und genau gezeigt wird.
Zu beachten:
- Das Video setzt voraus, dass man weiss, was der pH-Wert, Säuren und Basen ist bzw. sind und deren Definitionen kennt.
- Nicht zu vergessen: Der pH-Wert eignet sich nur für die Bestimmung des sauren/basischen Gehalt in WÄSSRIGEN Lösungen.
- Hat man ein Ampholyt, muss man zuerst entscheiden, ob er als Base oder Säure reagiert. Hier gilt: Falls pkS > pkB, dann reagiert der Stoff als Base, sonst als Säure.
- Im Video werden die Säuren und Basen in die Kategorien stark, mittelstark und schwach eingeteilt. Im Unterricht müssen wir jedoch nur zwischen starken und schwachen Säuren bzw. Basen unterscheiden. Hier gilt: pKS < 0 – starke Säure, pKS > 0 – schwache Säure. Bei Basen ist es das gleiche, dort wird jedoch der pKB Wert benutzt.
- Die Begriffe pKS und pKB werden nicht wirklich erklärt und ihr Bezug auf den pH-Wert wird nicht erwähnt. (Nachzulesen unter Kapitel 3: Exkurse)
- Der pH-Wert für schwache Säuren und Basen ist ein arithmetisches Mittel und nicht ganz genau, da wir das x vernachlässigen. Der Wert ist genauer für schwächere Säuren und Basen, da dort der Fehler kleiner ist.
Besonders nützlich:
Das Berechnen des pH-Werts wird Schritt für Schritt gezeigt. Ausserdem gibt es zwei Beispiele am Schluss, wo man kontrollieren kann, ob man das Prinzip verstanden hat.
Quellen
- Chemieunterlagen
- Wikipedia
- http://www.guidobauersachs.de/allgemeine/SABA.html
- Video: The Simple Chemics
Weblinks
- [1] – Bilder
- http://www.bs-wiki.de/mediawiki/images/Indikatoren.png - Indikator-Bild