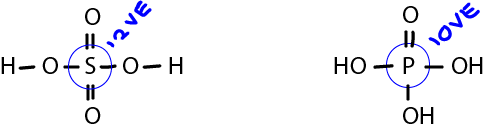Die Oktettregel und ihre Ausnahmen: Unterschied zwischen den Versionen
(→Quellen) |
|||
| (16 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
| − | == | + | == 1. Einführung == |
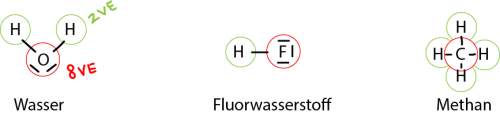
| + | Als Oktettregel versteht man in der Chemie ein Prinzip, welches den Aufbau von Molekülen, bzw. Atomen beschreibt und begründet. Der Grund, warum sich Atome binden, ist unter anderem auf diese Regel zurückzuführen. Wenn ein Molekül entsteht, teilen sich die jeweiligen Nichtmetall - Atome der Verbindung ihre Valenzelektronen (siehe: [[Medium:http://www.rdeuber.ch/chemiewiki/index.php?title=Einfache_Molek%C3%BCle]]). Die Oktettregel besagt, dass ein Atom maximal 8 Elektronen in der äussersten Schale haben darf und diesen Zustand auch anstrebt, da die Nichtmetalle eine starke Anziehungskraft auf Elektronen ausüben. Wenn ein Element 8 Elektronen in der äussersten Schale besitzt, so ist diese voll besetzt und es können keine weiteren Elektronen aufgenommen werden (4 * 2 Elektronenpaare). Wenn ein Atom also durch Bindung mit anderen Atomen die 8 Valenzelektronen erreicht (daher auch der Name Oktett => 8), so ist dieses Teilchen in einem stabileren Zustand als normal. Diese Regel kann man auf fast alle Elektronenpaarbindungen zurückführen. Hier einige Beispiele mithilfe der Lewisformel: | ||
| − | |||
| − | + | [[Datei:oktettregel_bsp_neu.png|500px| Abb. 1: Atome teilen Elektronen für eine volle Valenzschale]] | |
| + | Hierbei sieht man, dass die beteiligten Atome der Bindung eine volle Valenzschale erreichen. Wichtig ist, dass geteilte Elektronen zu beiden Atomen gezählt werden müssen. Somit erhält bei der Wasser-Verbindung der Sauerstoff jeweils ein zusätzliches Elektron der Wasserstoff-Atome, aber auch das Wasserstoff-Atom teilt mit dem Sauerstoff ein Elektron, womit es eine volle Valenzschale erreicht mit zwei Elektronen. Dasselbe Prinzip gilt foglich auch für die Verbindungen Fluorwasserstoff und Methan. | ||
| − | + | [[Datei:helium_element.png|150px|thumb|right| Abb. 5: Helium Atom mit vollständig besetzter Valenzschale]] | |
| + | Bei Helium und Wasserstoff trifft die Oktettregel nicht ganz wie oben definiert zu, da sie schlichtweg zu wenige Valenzelektronen besitzen können. Wasserstoff und Helium sind die einzigen zwei Atome in der ersten Periode und somit auch die einzigen zwei, welche maximal zwei Valenzelektronen besitzen können, da die äusserste Schale die K-Schale ist. | ||
| − | + | PS: Des Weiteren besitzen die Elemente der 8. Hauptgruppe des Periodensystems bereits alle 8 Valenzelektronen. Diese Atome erfüllen also bereits die Oktettregel und gehen somit nur sehr schwer Bindungen mit anderen Atomen ein (grosser Energieaufwand), da das Atom alleine eben schon in einem energetisch sehr stabilen Zustand ist. | |
| − | == | + | == 2. Ausnahmen == |
| − | + | Doch leider gibt es keine Regeln ohne Ausnahmen: Auch die Oktettregel ist nicht überall anwendbar. Foglich sind die grössten und wichtigsten Ausnahmen aufgelistet. | |
| − | === | + | === 2.1 Halbmetalle === |
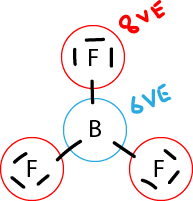
| − | + | Elemente wie beispielsweise Bor, Silizium, Germanium, etc. sind sogenannte Halbmetalle und sind im Periodensystem zwischen den Metallen und Nichtmetallen. Halbmetalle haben die Eigenschaft, schwächere Anziehungskräfte als Nichtmetalle zu haben. Folglich ist es schlichtweg nicht möglich, dass diese Elemente ganze 8 Valenzelektronen in ihrem Orbit behalten können. Verbindungen mit diesen Elementen sind deshalb äusserst instabil. Ein passendes Beispiel für diese Ausnahmegruppe ist unten aufgeführt: | |
| − | |||
| − | [[Datei: | + | [[Datei:oktettregel_ausnahme_halbmetall.png|200px| Abb. 2: Halbmetalle haben zu schwache Anziehungskräfte für eine volle Valenzschale]] |
| − | Bei | + | |
| + | |||
| + | Hierbei kann man sehen, dass jedes der drei Fluor-Atome eine volle Valenzschale hat (8 Elektronen). Das Bor hingegen teilt nur insgesamt 6 Elektronen mit den restlichen Atomen. Die Valenzschale ist somit nicht gefüllt und die Oktettregel nicht erfüllt. Diese Ausnahme gilt auch für die restlichen Halbmetalle. | ||
| + | |||
| + | === 2.2 Radikale === | ||
| + | |||
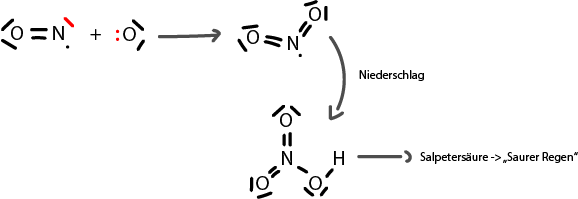
| + | Radikale sind Verbindungen, welche mindestens eine einfach besetzte Elektronenwolke besitzen, wie beispielsweise NO. Bei NO hat das Stickstoff 5 Valenzelektronen und das Sauerstoff 6. Somit haben sie insgesamt 11 Elektronen. Da diese Zahl jedoch nicht durch zwei teilbar ist, hat diese Verbindung eine einfach besetzte Elektronenwolke. | ||
| + | Des Weiteren können wir, wie unten auf der Abbildung, sehen, dass die Edukte des Stickstoffmonoxides eine Doppelbindung eingehen. Nun ist es aber so, dass der Sauerstoff die Elektronen extrem stark anzieht und dadurch das eine übrige Elektron vom Stickstoff auch noch halbwegs beansprucht. Das Resultat ist, dass dieses Molekül relativ stabil ist, aber die Oktettregel nicht erfüllt. | ||
| + | |||
| + | |||
| + | [[Datei:oktettregel_ausnahme_radikale.png|250px| Abb. 3: Radikale erfüllen die Oktettregel nicht]] | ||
| + | |||
| + | |||
| + | === 2.3 Starke Elektronenräuber === | ||
| + | |||
| + | Hier fehlt nicht ein Elektron in der Valenzschale, sondern es kommen zu viele vor. Wie bereits erwähnt, hat Sauerstoff sehr starke Anziehungskräfte und kommt in sehr vielen Bindungen vor. Dabei kann es vorkommen, dass der Sauerstoff eine doppelt besetzte Elektronenwolke sozusagen auflöst und sich mit diesen Elektronen bindet und diese teilt, wie in der Abbildung unten aufgeführt. | ||
| + | |||
| + | |||
| + | [[Datei:oktettregel_ausnahme_räuber.png|700px| Abb. 6: Starke Elektronenräuber führen zu mehr als 8 Valenzelektronen]] | ||
| + | |||
| + | |||
| + | Hierbei kann man sehen, dass das Sauerstoffatom jeweils eine volle Valenzschale erreicht, aber das Stickstoffatom folglich zu viele Elektronen besitzt, nämlich in der ersten Verbindung 9 und in der zweiten sogar 10. Hier noch zwei Beispiele für starke Elektronenräuber (Schwefel- und Phosphorsäure): | ||
| + | |||
| + | |||
| + | [[Datei:oktettregel_ausnahme_räuber3.png|500px| Abb. 7: Starke Elektronenräuber führen zu mehr als 8 Valenzelektronen]] | ||
| + | |||
| + | |||
| + | |||
| + | '''Exkurs: Radikale in der Atmosphäre und im Körper''' | ||
| + | |||
| + | Das Molekül NO, wie oben aufgeführt, entsteht beispielsweise als ein Abgasprodukt von Verbrennungsmotoren, beziehungsweise allgemein bei Verbrennungen. Dieses Teilchen ist extrem giftig für den Menschen und ist dazu noch geruchslos. Das Stickstoffmonoxid reagiert dann in der Atmosphäre mit Sauerstoff zu NO<sub>2</sub> (Stickstoffdioxid). Dieses Stickstoffdioxid ist ebenfalls schädlich für unseren Körper, ist jedoch leicht riechbar. Dieses Stickstoffdioxid kann durch energiereiche UV - Strahlung durch vor allem die Sonne wieder zu NO und O gespalten werden. Da ein einzelnes Sauerstoff-Teilchen natürlich nicht verbleiben kann durch die sehr hohe Reaktionsbereitschaft, reagiert es mit O<sub>2</sub> zu O<sub>3</sub> (Ozon). Gleichzeitig wird aber auch wieder das entstandene Ozon durch das übrig gebliebene NO zu NO<sub>2</sub> und O<sub>2</sub> zurückreagiert. Somit kann man sehen, dass somit ein Kreislauf entsteht (unten nochmals aufgeführt) und je nach der Menge und Stärke der UV - Strahlung mehr oder weniger Ozon, bzw. weniger oder mehr NO<sub>2</sub> und O<sub>2</sub> vorhanden ist. | ||
| + | |||
| + | |||
| + | [[Datei:ozon_zyklus_neu.png|300px| Abb. 4: Zyklus von Stickstoffmonoxid in der Atmosphäre]] | ||
| + | |||
| + | |||
| + | Ein weiteres Beispiel für Radikale können wir in unserem eigenen Körper betrachten. Beim Stoffwechsel entstehen ständig solche Teilchen als Nebenprodukt. Diese sind ziemlich gefährlich für uns, da sie mit anderen Atomen oder Molekülen in unserem Körper reagieren und dadurch Makromoleküle wie beispielsweise Proteine, Lipide oder DNA zerstören können. Wenn sie das tun, entstehen neue Radikale und daraus entsteht eine Kettenreaktion, welche man auch oxidativen Stress nennt. Doch glücklicherweise haben wir sogenannte Antioxidanten, wie zum Beispiel Zink, Selen oder Vitamine wie C und E, welche genau diese Kettenreaktion aufhalten, beziehungsweise diese Radikale neutralisieren. Dabei verrät der Name "Antioxidanten" bereits auch die Funktion dieser Teilchen. Da Radikale oft auch aus Sauerstoff bestehen und das Sauerstoff extrem reaktiv ist, reagieren diese Vitamine mit den Radikalen. Durch diese Reaktion werden die einzeln besetzten Elektronenwolken aufgefüllt und somit auch das Radikal neutralisiert. Dabei begehen die Vitamine sozusagen einen Kamikaze - Angriff, da sie sich damit selbst zerstören. | ||
| − | |||
== Quellen == | == Quellen == | ||
| + | |||
| + | '''Grafiken''' | ||
| + | |||
| + | Abb. 1: Selbst erstellt | ||
| + | |||
| + | Abb. 2: Selbst erstellt | ||
| + | |||
| + | Abb. 3: Selbst erstellt | ||
| + | |||
| + | Abb. 4: Selbst erstellt | ||
| + | |||
| + | Abb. 5: https://de.wikibooks.org/wiki/Wikijunior_Die_Elemente/_Elemente/_Helium#/media/Datei:Atom.svg | ||
| + | |||
| + | Abb. 6: Selbst erstellt | ||
| + | |||
| + | Abb. 7: Selbst erstellt | ||
| + | |||
| + | |||
| + | '''Weblinks''' | ||
| + | |||
| + | 1. https://www.chemie-biologie.uni-siegen.de/ac/hjd/lehre/ws0809/seminar/fenske_oktettregel_korr_.pdf | ||
| + | |||
| + | 2. https://www.verbraucherzentrale.de/wissen/lebensmittel/nahrungsergaenzungsmittel/antioxidantien-helfer-gegen-freie-radikale-10575 | ||
| + | |||
| + | 3. https://www.chemie.de/lexikon/Ozon.html | ||
| + | |||
| + | 4. https://en.wikipedia.org/wiki/Nitrogen_oxide | ||
| + | |||
| + | 5. https://de.wikipedia.org/wiki/Oktettregel | ||
| + | |||
| + | |||
| + | '''Weitere Quellen''' | ||
| + | |||
| + | - Skript und Unterrichtsnotizen von Herrn Deuber | ||
Aktuelle Version vom 11. Juni 2020, 15:32 Uhr
Inhaltsverzeichnis
1. Einführung
Als Oktettregel versteht man in der Chemie ein Prinzip, welches den Aufbau von Molekülen, bzw. Atomen beschreibt und begründet. Der Grund, warum sich Atome binden, ist unter anderem auf diese Regel zurückzuführen. Wenn ein Molekül entsteht, teilen sich die jeweiligen Nichtmetall - Atome der Verbindung ihre Valenzelektronen (siehe: Medium:http://www.rdeuber.ch/chemiewiki/index.php?title=Einfache_Moleküle). Die Oktettregel besagt, dass ein Atom maximal 8 Elektronen in der äussersten Schale haben darf und diesen Zustand auch anstrebt, da die Nichtmetalle eine starke Anziehungskraft auf Elektronen ausüben. Wenn ein Element 8 Elektronen in der äussersten Schale besitzt, so ist diese voll besetzt und es können keine weiteren Elektronen aufgenommen werden (4 * 2 Elektronenpaare). Wenn ein Atom also durch Bindung mit anderen Atomen die 8 Valenzelektronen erreicht (daher auch der Name Oktett => 8), so ist dieses Teilchen in einem stabileren Zustand als normal. Diese Regel kann man auf fast alle Elektronenpaarbindungen zurückführen. Hier einige Beispiele mithilfe der Lewisformel:
Hierbei sieht man, dass die beteiligten Atome der Bindung eine volle Valenzschale erreichen. Wichtig ist, dass geteilte Elektronen zu beiden Atomen gezählt werden müssen. Somit erhält bei der Wasser-Verbindung der Sauerstoff jeweils ein zusätzliches Elektron der Wasserstoff-Atome, aber auch das Wasserstoff-Atom teilt mit dem Sauerstoff ein Elektron, womit es eine volle Valenzschale erreicht mit zwei Elektronen. Dasselbe Prinzip gilt foglich auch für die Verbindungen Fluorwasserstoff und Methan.
Bei Helium und Wasserstoff trifft die Oktettregel nicht ganz wie oben definiert zu, da sie schlichtweg zu wenige Valenzelektronen besitzen können. Wasserstoff und Helium sind die einzigen zwei Atome in der ersten Periode und somit auch die einzigen zwei, welche maximal zwei Valenzelektronen besitzen können, da die äusserste Schale die K-Schale ist.
PS: Des Weiteren besitzen die Elemente der 8. Hauptgruppe des Periodensystems bereits alle 8 Valenzelektronen. Diese Atome erfüllen also bereits die Oktettregel und gehen somit nur sehr schwer Bindungen mit anderen Atomen ein (grosser Energieaufwand), da das Atom alleine eben schon in einem energetisch sehr stabilen Zustand ist.
2. Ausnahmen
Doch leider gibt es keine Regeln ohne Ausnahmen: Auch die Oktettregel ist nicht überall anwendbar. Foglich sind die grössten und wichtigsten Ausnahmen aufgelistet.
2.1 Halbmetalle
Elemente wie beispielsweise Bor, Silizium, Germanium, etc. sind sogenannte Halbmetalle und sind im Periodensystem zwischen den Metallen und Nichtmetallen. Halbmetalle haben die Eigenschaft, schwächere Anziehungskräfte als Nichtmetalle zu haben. Folglich ist es schlichtweg nicht möglich, dass diese Elemente ganze 8 Valenzelektronen in ihrem Orbit behalten können. Verbindungen mit diesen Elementen sind deshalb äusserst instabil. Ein passendes Beispiel für diese Ausnahmegruppe ist unten aufgeführt:
Hierbei kann man sehen, dass jedes der drei Fluor-Atome eine volle Valenzschale hat (8 Elektronen). Das Bor hingegen teilt nur insgesamt 6 Elektronen mit den restlichen Atomen. Die Valenzschale ist somit nicht gefüllt und die Oktettregel nicht erfüllt. Diese Ausnahme gilt auch für die restlichen Halbmetalle.
2.2 Radikale
Radikale sind Verbindungen, welche mindestens eine einfach besetzte Elektronenwolke besitzen, wie beispielsweise NO. Bei NO hat das Stickstoff 5 Valenzelektronen und das Sauerstoff 6. Somit haben sie insgesamt 11 Elektronen. Da diese Zahl jedoch nicht durch zwei teilbar ist, hat diese Verbindung eine einfach besetzte Elektronenwolke. Des Weiteren können wir, wie unten auf der Abbildung, sehen, dass die Edukte des Stickstoffmonoxides eine Doppelbindung eingehen. Nun ist es aber so, dass der Sauerstoff die Elektronen extrem stark anzieht und dadurch das eine übrige Elektron vom Stickstoff auch noch halbwegs beansprucht. Das Resultat ist, dass dieses Molekül relativ stabil ist, aber die Oktettregel nicht erfüllt.
2.3 Starke Elektronenräuber
Hier fehlt nicht ein Elektron in der Valenzschale, sondern es kommen zu viele vor. Wie bereits erwähnt, hat Sauerstoff sehr starke Anziehungskräfte und kommt in sehr vielen Bindungen vor. Dabei kann es vorkommen, dass der Sauerstoff eine doppelt besetzte Elektronenwolke sozusagen auflöst und sich mit diesen Elektronen bindet und diese teilt, wie in der Abbildung unten aufgeführt.
Hierbei kann man sehen, dass das Sauerstoffatom jeweils eine volle Valenzschale erreicht, aber das Stickstoffatom folglich zu viele Elektronen besitzt, nämlich in der ersten Verbindung 9 und in der zweiten sogar 10. Hier noch zwei Beispiele für starke Elektronenräuber (Schwefel- und Phosphorsäure):
Exkurs: Radikale in der Atmosphäre und im Körper
Das Molekül NO, wie oben aufgeführt, entsteht beispielsweise als ein Abgasprodukt von Verbrennungsmotoren, beziehungsweise allgemein bei Verbrennungen. Dieses Teilchen ist extrem giftig für den Menschen und ist dazu noch geruchslos. Das Stickstoffmonoxid reagiert dann in der Atmosphäre mit Sauerstoff zu NO2 (Stickstoffdioxid). Dieses Stickstoffdioxid ist ebenfalls schädlich für unseren Körper, ist jedoch leicht riechbar. Dieses Stickstoffdioxid kann durch energiereiche UV - Strahlung durch vor allem die Sonne wieder zu NO und O gespalten werden. Da ein einzelnes Sauerstoff-Teilchen natürlich nicht verbleiben kann durch die sehr hohe Reaktionsbereitschaft, reagiert es mit O2 zu O3 (Ozon). Gleichzeitig wird aber auch wieder das entstandene Ozon durch das übrig gebliebene NO zu NO2 und O2 zurückreagiert. Somit kann man sehen, dass somit ein Kreislauf entsteht (unten nochmals aufgeführt) und je nach der Menge und Stärke der UV - Strahlung mehr oder weniger Ozon, bzw. weniger oder mehr NO2 und O2 vorhanden ist.
Ein weiteres Beispiel für Radikale können wir in unserem eigenen Körper betrachten. Beim Stoffwechsel entstehen ständig solche Teilchen als Nebenprodukt. Diese sind ziemlich gefährlich für uns, da sie mit anderen Atomen oder Molekülen in unserem Körper reagieren und dadurch Makromoleküle wie beispielsweise Proteine, Lipide oder DNA zerstören können. Wenn sie das tun, entstehen neue Radikale und daraus entsteht eine Kettenreaktion, welche man auch oxidativen Stress nennt. Doch glücklicherweise haben wir sogenannte Antioxidanten, wie zum Beispiel Zink, Selen oder Vitamine wie C und E, welche genau diese Kettenreaktion aufhalten, beziehungsweise diese Radikale neutralisieren. Dabei verrät der Name "Antioxidanten" bereits auch die Funktion dieser Teilchen. Da Radikale oft auch aus Sauerstoff bestehen und das Sauerstoff extrem reaktiv ist, reagieren diese Vitamine mit den Radikalen. Durch diese Reaktion werden die einzeln besetzten Elektronenwolken aufgefüllt und somit auch das Radikal neutralisiert. Dabei begehen die Vitamine sozusagen einen Kamikaze - Angriff, da sie sich damit selbst zerstören.
Quellen
Grafiken
Abb. 1: Selbst erstellt
Abb. 2: Selbst erstellt
Abb. 3: Selbst erstellt
Abb. 4: Selbst erstellt
Abb. 5: https://de.wikibooks.org/wiki/Wikijunior_Die_Elemente/_Elemente/_Helium#/media/Datei:Atom.svg
Abb. 6: Selbst erstellt
Abb. 7: Selbst erstellt
Weblinks
1. https://www.chemie-biologie.uni-siegen.de/ac/hjd/lehre/ws0809/seminar/fenske_oktettregel_korr_.pdf
3. https://www.chemie.de/lexikon/Ozon.html
4. https://en.wikipedia.org/wiki/Nitrogen_oxide
5. https://de.wikipedia.org/wiki/Oktettregel
Weitere Quellen
- Skript und Unterrichtsnotizen von Herrn Deuber