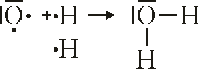Vom Hybridisierungsmodell zum Kugelwolkenmodell: Unterschied zwischen den Versionen
(Die Seite wurde neu angelegt: „ Von Hybridisierungsmodell zum Kugelwolkenmodell Zur Navigation springen Zur Suche springen Zur Beschreibung und Darstellung von Elektronenpaarbindungen wird…“) |
|||
| Zeile 1: | Zeile 1: | ||
| + | Zur Beschreibung und Darstellung von Elektronenpaarbindungen wird im Rahmen des Orbitalmodell in der Regel das sogenannte <b>Hybridisierungsmodell</b> verwendet. Dieses ist aber in der durchgehenden Anwendung für den gymnasialen Grundlagenfachunterricht zu anspruchsvoll. | ||
| − | + | Im Folgenden wird deshalb zuerst das Prinzip des Hybridisierungsmodells erklärt, dann aber das <b>Kugelwolkenmodell</b> als stark vereinfachtes - aber durchaus brauchbares Modell - eingeführt. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | == Das Hybridisierungsmodell == | |
| − | + | Nähern sich zwei Nichtmetallatome, die sich in einer Elektronenpaarbindung verbinden, wirken starke Kräfte: | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | Nähern sich zwei Nichtmetallatome, die sich in einer Elektronenpaarbindung verbinden, wirken starke Kräfte: | ||
- Anziehung zwischen den Kernen und den Elektronen des jeweils anderen Atoms | - Anziehung zwischen den Kernen und den Elektronen des jeweils anderen Atoms | ||
| Zeile 32: | Zeile 12: | ||
- Abstossung zwischen den Elektronen der beiden negativ geladenen Hüllen und den positiv geladenen Kernen | - Abstossung zwischen den Elektronen der beiden negativ geladenen Hüllen und den positiv geladenen Kernen | ||
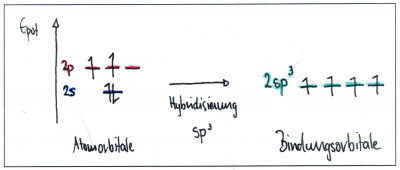
| − | Durch diese Kräfte werden die s- und p-Atomorbitale räumlich und energetisch so verändert, dass das s-Orbital mit allen 3 p-Orbitalen ( | + | Durch diese Kräfte werden die s- und p-Atomorbitale räumlich und energetisch so verändert, dass das s-Orbital mit allen 3 p-Orbitalen (sp<sup>3</sup>-Hybridisierung), oder nur mit zwei p-Orbitalen (sp<sup>2</sup>-Hybridisierung) - oder auch nur mit einem p-Orbital (sp-Hybridisierung) verschmilzt. |
| + | Die dadurch neu entstandenen Bindungsorbitale nennt man Hybridorbitale (hybrida (gr): Mischling). | ||
Die gesamte Anzahl Bindungsorbitale bleibt dabei gleich: Es sind immer insgesamt 4 Orbitale - entweder 4 Hybridorbitale - oder eine Kombination von Hybridorbitalen und unveränderten p-Orbitalen. | Die gesamte Anzahl Bindungsorbitale bleibt dabei gleich: Es sind immer insgesamt 4 Orbitale - entweder 4 Hybridorbitale - oder eine Kombination von Hybridorbitalen und unveränderten p-Orbitalen. | ||
| − | Achtung: Die Zahl im Namen (t.B. | + | Achtung: Die Zahl im Namen (t.B. sp<b><sub>3</b></sub>) bezieht sich immer auf die Anzahl p- Orbitale, die beteiligt sind - und nicht etwa auf die Anzahl Hybridorbitale! In der sp<sup>3</sup>-Hybridisierung gibt es beispielsweise 4 Hybridorbitale |
| − | Im Folgenden wird zuerst die wichtigste Art der sp3-Hybridisierung am Beispiel von Kohlenstoff erklärt, dann noch die seltenere | + | Im Folgenden wird zuerst die wichtigste Art der sp3-Hybridisierung am Beispiel von Kohlenstoff erklärt, dann noch die seltenere sp<sup>2</sup>- und sp-Hybridisierung. |
| − | + | === sp<sup>3</sup>-Hybridisierung - Beispiel Methan CH<sub>4</sub>=== | |
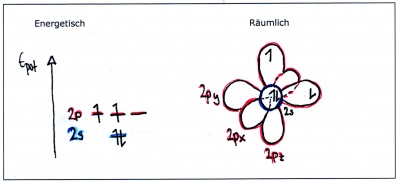
| − | Ein einzelnes Kohlenstoffatom weist die folgende Elektronenkonfiguration auf: [He] | + | Ein einzelnes Kohlenstoffatom weist die folgende Elektronenkonfiguration auf: [He] 2s<sup>2</sup>2p<sup>2</sup> |
| − | Energieniveaus und Orbitale eines einzelnen Kohlenstofftoms | + | [[Bild:Hybridisierung_Atomorbitale_col.jpg|400px||Energieniveaus und Orbitale eines einzelnen Kohlenstofftoms]] |
| − | Wie man sieht, sind nur zwei Orbitale vorhanden, die einfach besetzt sind (das s-Orbital ist voll und das zweite p-Orbital leer). Da nur einfachbesetzte Orbitale Elekronenpaarbindungen bilden können, müsste bei unveränderten Atomorbitalen das Molekül | + | Wie man sieht, sind nur zwei Orbitale vorhanden, die einfach besetzt sind (das s-Orbital ist voll und das zweite p-Orbital leer). Da nur einfachbesetzte Orbitale Elekronenpaarbindungen bilden können, müsste bei unveränderten Atomorbitalen das Molekül <b>CH<sub>2</sub></b> entstehen! |
| − | x | + | [[Bild:Hybridisierung_CH2_col.jpg|250px||x]] |
| − | Diese Struktur widerspricht aber allen Eigenschaften und experimentellen Analysen von Methan und entspricht damit nicht der Realität. Die Natur bildet | + | Diese Struktur widerspricht aber allen Eigenschaften und experimentellen Analysen von Methan und entspricht damit <b>nicht</b> der Realität. <b>Die Natur bildet CH<sub>4</sub>, nicht CH<sub>2</sub>!</b> |
| − | Warum aber liefert das Orbitalmodell nicht die richtige Struktur? Der Grund liegt darin, dass zusätzlich noch die oben erwähnten Kräfte berücksichtigt werden müssen, welche die Form und Energie der Orbitale verändern! Diese Kräfte führen zu einem energiearmen und symmetrischen Zustand - Eben | + | Warum aber liefert das Orbitalmodell nicht die richtige Struktur? Der Grund liegt darin, dass zusätzlich noch die oben erwähnten Kräfte berücksichtigt werden müssen, welche die Form und Energie der Orbitale verändern! Diese Kräfte führen zu einem energiearmen und symmetrischen Zustand - Eben CH<sub>4</sub>! |
Man kann das mathematisch berechnen - wir begnügen uns aber damit, das qualitativ zu beschreiben: | Man kann das mathematisch berechnen - wir begnügen uns aber damit, das qualitativ zu beschreiben: | ||
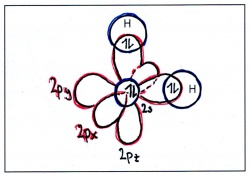
Hat ein Kohlenstoffatom vier Bindungspartner, verschmilzt das s-Orbital mit allen drei p-Orbitalen, wobei vier symmetrische Hybridorbitale entstehen, die gleichmässig um den Kern herum angeordnet sind. Dabei entsteht die bekannte tetraedrische Struktur von Methan: | Hat ein Kohlenstoffatom vier Bindungspartner, verschmilzt das s-Orbital mit allen drei p-Orbitalen, wobei vier symmetrische Hybridorbitale entstehen, die gleichmässig um den Kern herum angeordnet sind. Dabei entsteht die bekannte tetraedrische Struktur von Methan: | ||
| − | |||
| − | Energieniveaus und Orbitale eines einzelnen Kohlenstofftoms | + | [[Bild:Hybridisierung_sp3_col.jpg|400px|left|Energieniveaus und Orbitale eines einzelnen Kohlenstofftoms]] [[Bild:Hybridisierung_CH4.jpg|170px|Energieniveaus und Orbitale eines einzelnen Kohlenstofftoms]] |
Geometrische Anordnung: tetraedrisch - Bindungswinkel: 109.5° (Tetraederwinkel) | Geometrische Anordnung: tetraedrisch - Bindungswinkel: 109.5° (Tetraederwinkel) | ||
| − | Voraussetzung: Ein | + | Voraussetzung: Ein sp<sup>3</sup>-hybridisiertes C-Atom hat typischerweise <b>vier Bindungspartner</b>. |
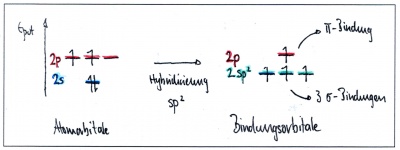
| − | + | === sp<sup>2</sup>-Hybridisierung - Beispiel Ethen C<sub>2</sub>H<sub>4</sub>=== | |
| − | In Ethen sind die beiden Kohlenstoffe mit je zwei Wasserstoffatomen und gegenseitig mit einer Doppelbindung verbunden: Jedes Kohlenstoffatom hat somit insgesamt drei Bindungspartner. Da die Anzahl Bindungspartner bei Kohlenstoff jeweils der Anzahl Hybridorbitale entspricht, verschmilzt in diesem Fall das s-Orbital nur mit zwei p-Orbitalen - ein p-Orbital bleibt dabei also unverändert. | + | In Ethen sind die beiden Kohlenstoffe mit je zwei Wasserstoffatomen und gegenseitig mit einer Doppelbindung verbunden: Jedes Kohlenstoffatom hat somit insgesamt <b>drei Bindungspartner</b>. |
| − | + | Da die Anzahl Bindungspartner bei Kohlenstoff jeweils der Anzahl Hybridorbitale entspricht, verschmilzt in diesem Fall das s-Orbital nur mit zwei p-Orbitalen - ein p-Orbital bleibt dabei also unverändert. | |
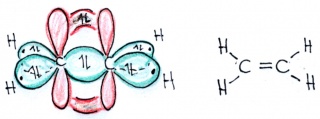
| − | Energieniveaus und Orbitale eines einzelnen Kohlenstofftoms | + | [[Bild:Hybridisierung_sp2_col.jpg|400px|left|Energieniveaus und Orbitale eines einzelnen Kohlenstofftoms]] [[Bild:Hybridisierung_Ethen.jpg|320px|Energieniveaus und Orbitale eines einzelnen Kohlenstofftoms]] |
| − | Bitte beachten Sie, dass sich die beiden p-Orbitale der beiden sp2-hybridisierten Kohlenstoffatome auch überlappen und so ein doppelt besetztes bindendes Orbital binden können!. | + | |
| + | <b>Bitte beachten Sie, dass sich die beiden p-Orbitale der beiden sp2-hybridisierten Kohlenstoffatome auch überlappen und so ein doppelt besetztes bindendes Orbital binden können!</b>. | ||
Eine solche Bindung besteht aus einem "halben" Orbital oberhalb und einem "halben" Orbital unterhalb der Bindungsachse. Diese Bindungen werden als"pi-Orbitale" bezeichnet vom griechischen Buchstaben für p, während die Bindungen mit Hybridorbitalen als "sigma-Bindungen" bezeichnet werden vom griechischen Buchstaben für s, da solche Orbitale auch aus einem s-Orbial entstanden). In den Darstellungen auf dieser Seite sind die pi-Orbitale rot, die sigma-Orbitale grün. | Eine solche Bindung besteht aus einem "halben" Orbital oberhalb und einem "halben" Orbital unterhalb der Bindungsachse. Diese Bindungen werden als"pi-Orbitale" bezeichnet vom griechischen Buchstaben für p, während die Bindungen mit Hybridorbitalen als "sigma-Bindungen" bezeichnet werden vom griechischen Buchstaben für s, da solche Orbitale auch aus einem s-Orbial entstanden). In den Darstellungen auf dieser Seite sind die pi-Orbitale rot, die sigma-Orbitale grün. | ||
| Zeile 85: | Zeile 66: | ||
Geometrische Anordnung: planar-trigonal - Bindungswinkel: 120° | Geometrische Anordnung: planar-trigonal - Bindungswinkel: 120° | ||
| − | Voraussetzung: Ein | + | Voraussetzung: Ein sp<sup>2</sup>-hybridisiertes C-Atom hat typischerweise <b>drei Bindungspartner</b> (und eine Doppelbindung) |
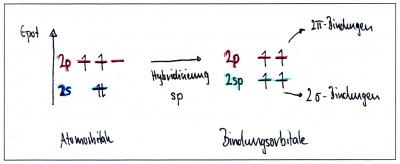
| − | sp-Hybridisierung - Beispiel Ethin | + | === sp-Hybridisierung - Beispiel Ethin C<sub>2</sub>H<sub>2</sub>=== |
| − | In Ethin sind die beiden Kohlenstoffe mit nur je einem Wasserstoffatomen und gegenseitig mit einer Dreifachbindung verbunden: Jedes Kohlenstoffatom hat somit insgesamt nur zwei Bindungspartner. In diesem Fall verschmilzt das s-Orbital nur mit zwei p-Orbitalen - ein p-Orbital bleibt dabei also unverändert. Dabei entstehen zwei Hybridorbitale und die beiden p-Orbitale bleiben unverändert | + | In Ethin sind die beiden Kohlenstoffe mit nur je einem Wasserstoffatomen und gegenseitig mit einer Dreifachbindung verbunden: Jedes Kohlenstoffatom hat somit insgesamt nur <b>zwei Bindungspartner</b>. |
| − | + | In diesem Fall verschmilzt das s-Orbital nur mit zwei p-Orbitalen - ein p-Orbital bleibt dabei also unverändert. Dabei entstehen zwei Hybridorbitale und die beiden p-Orbitale bleiben unverändert | |
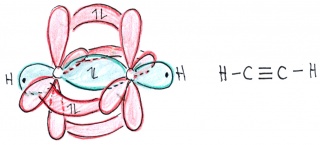
| − | Energieniveaus und Orbitale eines einzelnen Kohlenstofftoms | + | [[Bild:Hybridisierung_sp.jpg|400px|left|Energieniveaus und Orbitale eines einzelnen Kohlenstofftoms]] [[Bild:Hybridisierung_Ethin.jpg|320px|Energieniveaus und Orbitale eines einzelnen Kohlenstofftoms]] |
| − | Wie bei Ethan können sich natürlich auch in diesem Fall die p-Orbitale zu pi-Bindungen überlappen. Diese liegen senkrecht aufeinander und führen zu einer hohen Reaktivität von Alkinen (Kohlenstoffverbindungen mit mindestens einer Dreifachbindung). | + | Wie bei Ethan können sich natürlich auch in diesem Fall die p-Orbitale zu pi-Bindungen überlappen. Diese liegen senkrecht aufeinander und führen zu einer hohen Reaktivität von Alkinen (Kohlenstoffverbindungen mit mindestens einer Dreifachbindung). |
Geometrische Anordnung: linear - Bindungswinkel: 180° | Geometrische Anordnung: linear - Bindungswinkel: 180° | ||
| − | Voraussetzung: Ein | + | Voraussetzung: Ein sp<sup>2</sup>-hybridisiertes C-Atom hat typischerweise <b>zwei Bindungspartner</b> (und zwei Doppelbindungen) |
| − | |||
| − | + | === Zusammenfassung: Hybridisierung=== | |
| + | [[Bild:Hybridisierung Uebersicht col.jpg|800px|Energieniveaus und Orbitale eines einzelnen Kohlenstofftoms]] | ||
| − | |||
| − | • sp3-Hybridisierung bei Kohlenstoff – Ein SimpleClub-Video zur kurzen Einführung ins Prinzip der Hybridisierung | + | === Weiterführende Quellen === |
| + | • [https://www.youtube.com/watch?v=VFABCq4xItY sp3-Hybridisierung bei Kohlenstoff] – Ein SimpleClub-Video zur kurzen Einführung ins Prinzip der Hybridisierung | ||
| − | • Hybridization Theory – Eine ausführliche, verständliche und sorgfältig, gestaltete Einführung ins Hybridisierungsmodel (englisch) | + | • [https://www.youtube.com/watch?v=wPw_LCmyjnI Hybridization Theory] – Eine ausführliche, verständliche und sorgfältig, gestaltete Einführung ins Hybridisierungsmodel (englisch) |
| − | |||
| − | |||
| − | Das | + | == Das Kugelwolkenmodell == |
| − | + | === Eine Vereinfachung des Hybridisierungsmodells === | |
| − | + | Das Hybridisierungsmodell ist zwar ein sehr leistungsfähiges Modell - aber wie bereits erwähnt - für das Grundlagenfach Chemie in der Schweiz zu anspruchsvoll. | |
| + | Ein einfacheres Modell, das auch in Sekundarschulen bzw. Bezirksschulen verwendet wird, ist das <b>Kugelwolkenmodell</b> | ||
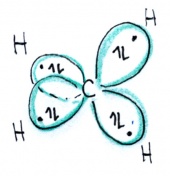
| − | Die Vereinfachung des Kugelwolkenmodells besteht also gewissermassen darin, dass die sp- und | + | Das Kugelwolkenmodell entspricht im wesentlichen der Vorstellung, dass <b>alle Nichtmetalleatome grundsätzlich sp<sup>3</sup>-hybtridisiert sind</b>, d.h. in der Valenzschale vier Kugelwolken aufweisen, die tetraedrisch um den Kern gruppiert sind. |
| + | |||
| + | Diese Kugel- oder Elektronenwolken entsprechen im Wesentlichen den sp<sup>3</sup>-Hybridorbitalen. Jedes Atom hat also vier Kugelwolken - und damit insgesamt 4 x 2 = 8 Valenzelektronen. | ||
| + | |||
| + | Die Vereinfachung des Kugelwolkenmodells besteht also gewissermassen darin, dass die sp- und sp<sup>2</sup>-Hybridisierung ignoriert werden. Dies ergibt zwar Ungenauigkeiten für Doppelbindungen, mit denen es sich aber leben lässt. | ||
Im Folgenden eine Übersicht der Darstellung von Atomen gemäss Kugelwolkenmodell: | Im Folgenden eine Übersicht der Darstellung von Atomen gemäss Kugelwolkenmodell: | ||
| − | Das KWM im Periodensystem | + | [[Bild:KWM im PS.jpg|700px|Das KWM im Periodensystem]] |
| − | Vergleich: KWM - Orbitalmodell | + | === Vergleich: KWM - Orbitalmodell === |
| − | + | {| | |
| − | gleich | + | |- |
| − | + | | | |
| − | + | |- | |
| − | verschieden | + | | |||| <b>Orbitalmodell</b> ||| <b>Kugelwolkenmodell</b> |
| − | + | |- | |
| − | + | | <b>gleich</b> |||| • Unschärfebeziehung: Elektronen als Wellen ||| • Unschärfebeziehung: Elektronen als Wellen | |
| + | |- | ||
| + | | |||| • Energie- und Pauliprinzip, Hundsche Regel ||| • Energie- und Pauliprinzip, Hundsche Regel | ||
| + | |- | ||
| + | | |||| • Schalen der Atome: K, L, M, N usw. ||| • Schalen der Atome: K, L, M, N usw | ||
| + | |- | ||
| + | | | ||
| + | |- | ||
| + | | | ||
| + | |- | ||
| + | | | ||
| + | |- | ||
| + | | | ||
| + | |- | ||
| + | | | ||
| + | |- | ||
| + | | | ||
| + | |- | ||
| + | | <b>verschieden</b> |||| • Hybridisierung ||| • 4 Elektronenwolken | ||
| + | |- | ||
| + | | |||| • Berücksichtigung aller Schalen und Unterschalen ||| • <b>Betonung der Valenzschalen, keine Unterschalen</b> | ||
| + | |- | ||
| + | | ||||||| | ||
| + | |} | ||
| − | Grenzen des Modells | + | === Grenzen des Modells === |
Bindungen der 1. und 2. Periode können mit dem Kugelwolkenmodell gut beschrieben werden, ab der 3. Periode nur eingeschränkt, da diese Atome auch Elektronen in den d- und f-Unerschalden aufweisen. Aus diesem Grund ist das Modell auch nicht geeignet für Nebengruppen: Diese haben ja alle grundsätzlich mit 2 gleich viele Valenzelektronen. | Bindungen der 1. und 2. Periode können mit dem Kugelwolkenmodell gut beschrieben werden, ab der 3. Periode nur eingeschränkt, da diese Atome auch Elektronen in den d- und f-Unerschalden aufweisen. Aus diesem Grund ist das Modell auch nicht geeignet für Nebengruppen: Diese haben ja alle grundsätzlich mit 2 gleich viele Valenzelektronen. | ||
| Zeile 149: | Zeile 156: | ||
| − | |||
| + | == Die Lewisformel == | ||
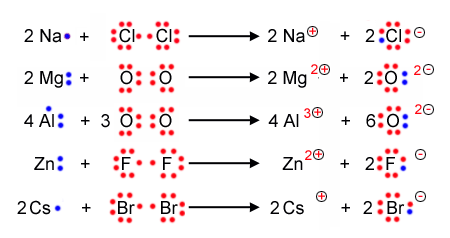
Mit der Lewisschreibweise zeigt man auf einem einfachen weg auf, wieviele Valenzelektronen ein Atom hat, und weiterführend wieviele Bindungen zwischen Nichtmetallatomen in Molekülen gemäss Kugelwolkenmodell entstehen können. Dabei werden die einfach besetzten Elektronenwolken durch einen einen Punkt und die doppelt besetzten mit einem Strich dargestellt. | Mit der Lewisschreibweise zeigt man auf einem einfachen weg auf, wieviele Valenzelektronen ein Atom hat, und weiterführend wieviele Bindungen zwischen Nichtmetallatomen in Molekülen gemäss Kugelwolkenmodell entstehen können. Dabei werden die einfach besetzten Elektronenwolken durch einen einen Punkt und die doppelt besetzten mit einem Strich dargestellt. | ||
| Zeile 157: | Zeile 164: | ||
| − | Energieniveaus und Orbitale eines einzelnen Kohlenstofftoms | + | [[Bild:Lewisformeln Atome.png|500px|Energieniveaus und Orbitale eines einzelnen Kohlenstofftoms]] |
| − | Bindung von zwei Cl-Atomen zum | + | Bindung von zwei Cl-Atomen zum Cl<sub>2</sub> - Molekül: |
| − | + | [[Bild:cl.gif|200px]] | |
| − | Bindung von | + | Bindung von H<sub>2</sub>O: |
| − | + | [[Bild:h2o.gif|200px]] | |
Man kann statt Strichen auch zwei Punkte schreiben: | Man kann statt Strichen auch zwei Punkte schreiben: | ||
| − | Lewis3.gif | + | [[Bild:Lewis3.gif]] |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | == Quellen == | |
| + | <ul> | ||
| + | <li>http://wikipedia.org</li> | ||
| + | <li>http://google.com</li> | ||
| + | <li>Heftaufschrieb</li> | ||
| + | <li>http://www.thomasmusolf.de/fuer_schueler_und_eltern/Chemie/Allgemeines/Wichtige%20Begriffe%20mit%20frame.html</li> | ||
| + | <li>http://www.bionet.schule.de/~grube/fachlehr/chemie/fundamen/valenz.htm</li> | ||
| + | <li>http://chemie.fb2.fh-frankfurt.de/Erlaeuterungen/11Hybridisierung-sp3.htm</li> | ||
| + | <li>http://chemgapedia.de</li> | ||
| + | <li>http://www.thomasmusolf.de/fuer_schueler_und_eltern/Chemie/Allgemeines/PSE%20-%20online07.jpg</li> | ||
| + | <li>Elemente-Moleküle; von Roderich Magyar, Wolfgang Liebhart und Gabriela Jelinek </li> | ||
| + | </ul> | ||
Aktuelle Version vom 27. März 2020, 11:10 Uhr
Zur Beschreibung und Darstellung von Elektronenpaarbindungen wird im Rahmen des Orbitalmodell in der Regel das sogenannte Hybridisierungsmodell verwendet. Dieses ist aber in der durchgehenden Anwendung für den gymnasialen Grundlagenfachunterricht zu anspruchsvoll.
Im Folgenden wird deshalb zuerst das Prinzip des Hybridisierungsmodells erklärt, dann aber das Kugelwolkenmodell als stark vereinfachtes - aber durchaus brauchbares Modell - eingeführt.
Inhaltsverzeichnis
Das Hybridisierungsmodell
Nähern sich zwei Nichtmetallatome, die sich in einer Elektronenpaarbindung verbinden, wirken starke Kräfte:
- Anziehung zwischen den Kernen und den Elektronen des jeweils anderen Atoms
- Abstossung zwischen den Elektronen der beiden negativ geladenen Hüllen und den positiv geladenen Kernen
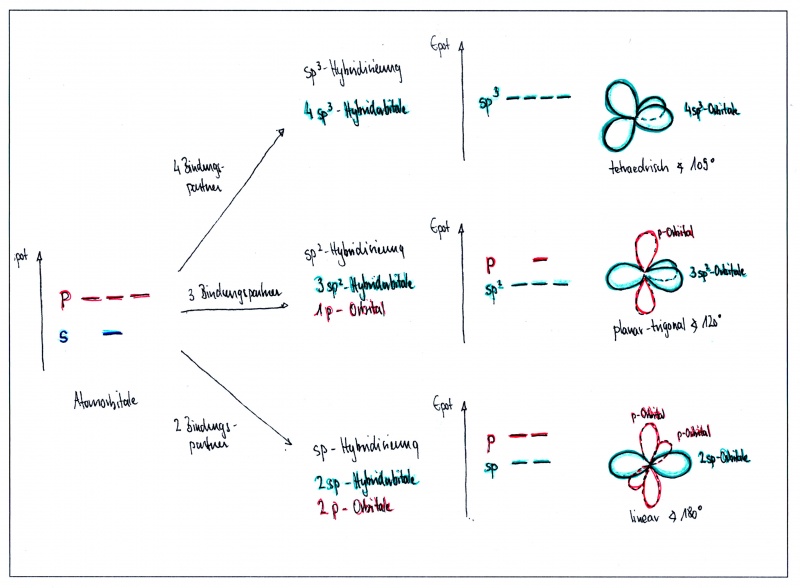
Durch diese Kräfte werden die s- und p-Atomorbitale räumlich und energetisch so verändert, dass das s-Orbital mit allen 3 p-Orbitalen (sp3-Hybridisierung), oder nur mit zwei p-Orbitalen (sp2-Hybridisierung) - oder auch nur mit einem p-Orbital (sp-Hybridisierung) verschmilzt. Die dadurch neu entstandenen Bindungsorbitale nennt man Hybridorbitale (hybrida (gr): Mischling).
Die gesamte Anzahl Bindungsorbitale bleibt dabei gleich: Es sind immer insgesamt 4 Orbitale - entweder 4 Hybridorbitale - oder eine Kombination von Hybridorbitalen und unveränderten p-Orbitalen.
Achtung: Die Zahl im Namen (t.B. sp3) bezieht sich immer auf die Anzahl p- Orbitale, die beteiligt sind - und nicht etwa auf die Anzahl Hybridorbitale! In der sp3-Hybridisierung gibt es beispielsweise 4 Hybridorbitale
Im Folgenden wird zuerst die wichtigste Art der sp3-Hybridisierung am Beispiel von Kohlenstoff erklärt, dann noch die seltenere sp2- und sp-Hybridisierung.
sp3-Hybridisierung - Beispiel Methan CH4
Ein einzelnes Kohlenstoffatom weist die folgende Elektronenkonfiguration auf: [He] 2s22p2
Wie man sieht, sind nur zwei Orbitale vorhanden, die einfach besetzt sind (das s-Orbital ist voll und das zweite p-Orbital leer). Da nur einfachbesetzte Orbitale Elekronenpaarbindungen bilden können, müsste bei unveränderten Atomorbitalen das Molekül CH2 entstehen!
Diese Struktur widerspricht aber allen Eigenschaften und experimentellen Analysen von Methan und entspricht damit nicht der Realität. Die Natur bildet CH4, nicht CH2!
Warum aber liefert das Orbitalmodell nicht die richtige Struktur? Der Grund liegt darin, dass zusätzlich noch die oben erwähnten Kräfte berücksichtigt werden müssen, welche die Form und Energie der Orbitale verändern! Diese Kräfte führen zu einem energiearmen und symmetrischen Zustand - Eben CH4!
Man kann das mathematisch berechnen - wir begnügen uns aber damit, das qualitativ zu beschreiben:
Hat ein Kohlenstoffatom vier Bindungspartner, verschmilzt das s-Orbital mit allen drei p-Orbitalen, wobei vier symmetrische Hybridorbitale entstehen, die gleichmässig um den Kern herum angeordnet sind. Dabei entsteht die bekannte tetraedrische Struktur von Methan:
Geometrische Anordnung: tetraedrisch - Bindungswinkel: 109.5° (Tetraederwinkel)
Voraussetzung: Ein sp3-hybridisiertes C-Atom hat typischerweise vier Bindungspartner.
sp2-Hybridisierung - Beispiel Ethen C2H4
In Ethen sind die beiden Kohlenstoffe mit je zwei Wasserstoffatomen und gegenseitig mit einer Doppelbindung verbunden: Jedes Kohlenstoffatom hat somit insgesamt drei Bindungspartner. Da die Anzahl Bindungspartner bei Kohlenstoff jeweils der Anzahl Hybridorbitale entspricht, verschmilzt in diesem Fall das s-Orbital nur mit zwei p-Orbitalen - ein p-Orbital bleibt dabei also unverändert.
Bitte beachten Sie, dass sich die beiden p-Orbitale der beiden sp2-hybridisierten Kohlenstoffatome auch überlappen und so ein doppelt besetztes bindendes Orbital binden können!.
Eine solche Bindung besteht aus einem "halben" Orbital oberhalb und einem "halben" Orbital unterhalb der Bindungsachse. Diese Bindungen werden als"pi-Orbitale" bezeichnet vom griechischen Buchstaben für p, während die Bindungen mit Hybridorbitalen als "sigma-Bindungen" bezeichnet werden vom griechischen Buchstaben für s, da solche Orbitale auch aus einem s-Orbial entstanden). In den Darstellungen auf dieser Seite sind die pi-Orbitale rot, die sigma-Orbitale grün.
Eine Doppelbindung enthalt somit nicht zwei gleichwertige Bindungen, sonden eine innere sigma- und eine äussere - schwächere - pi-Bindung. Pi-Bindungen sind schwächer, da die pi-Elektronen weniger stark von den Kernen angezogen werden (Abstand!). Das ist der Grund, dass organische Stoffe mit Doppelbindungen im allgemeinen reaktionsfreudig sind.
Geometrische Anordnung: planar-trigonal - Bindungswinkel: 120°
Voraussetzung: Ein sp2-hybridisiertes C-Atom hat typischerweise drei Bindungspartner (und eine Doppelbindung)
sp-Hybridisierung - Beispiel Ethin C2H2
In Ethin sind die beiden Kohlenstoffe mit nur je einem Wasserstoffatomen und gegenseitig mit einer Dreifachbindung verbunden: Jedes Kohlenstoffatom hat somit insgesamt nur zwei Bindungspartner. In diesem Fall verschmilzt das s-Orbital nur mit zwei p-Orbitalen - ein p-Orbital bleibt dabei also unverändert. Dabei entstehen zwei Hybridorbitale und die beiden p-Orbitale bleiben unverändert
Wie bei Ethan können sich natürlich auch in diesem Fall die p-Orbitale zu pi-Bindungen überlappen. Diese liegen senkrecht aufeinander und führen zu einer hohen Reaktivität von Alkinen (Kohlenstoffverbindungen mit mindestens einer Dreifachbindung).
Geometrische Anordnung: linear - Bindungswinkel: 180°
Voraussetzung: Ein sp2-hybridisiertes C-Atom hat typischerweise zwei Bindungspartner (und zwei Doppelbindungen)
Zusammenfassung: Hybridisierung
Weiterführende Quellen
• sp3-Hybridisierung bei Kohlenstoff – Ein SimpleClub-Video zur kurzen Einführung ins Prinzip der Hybridisierung
• Hybridization Theory – Eine ausführliche, verständliche und sorgfältig, gestaltete Einführung ins Hybridisierungsmodel (englisch)
Das Kugelwolkenmodell
Eine Vereinfachung des Hybridisierungsmodells
Das Hybridisierungsmodell ist zwar ein sehr leistungsfähiges Modell - aber wie bereits erwähnt - für das Grundlagenfach Chemie in der Schweiz zu anspruchsvoll. Ein einfacheres Modell, das auch in Sekundarschulen bzw. Bezirksschulen verwendet wird, ist das Kugelwolkenmodell
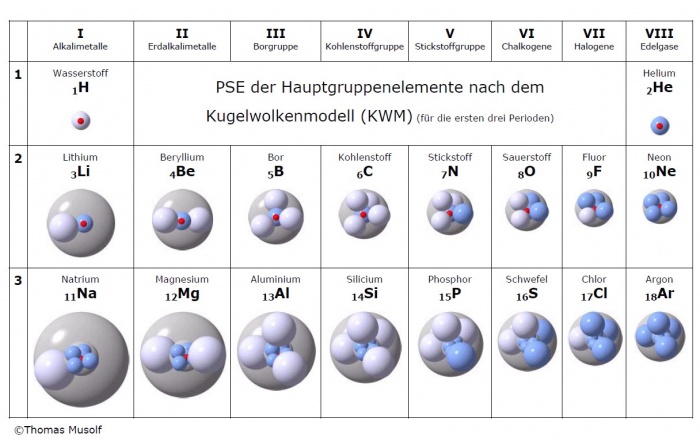
Das Kugelwolkenmodell entspricht im wesentlichen der Vorstellung, dass alle Nichtmetalleatome grundsätzlich sp3-hybtridisiert sind, d.h. in der Valenzschale vier Kugelwolken aufweisen, die tetraedrisch um den Kern gruppiert sind.
Diese Kugel- oder Elektronenwolken entsprechen im Wesentlichen den sp3-Hybridorbitalen. Jedes Atom hat also vier Kugelwolken - und damit insgesamt 4 x 2 = 8 Valenzelektronen.
Die Vereinfachung des Kugelwolkenmodells besteht also gewissermassen darin, dass die sp- und sp2-Hybridisierung ignoriert werden. Dies ergibt zwar Ungenauigkeiten für Doppelbindungen, mit denen es sich aber leben lässt.
Im Folgenden eine Übersicht der Darstellung von Atomen gemäss Kugelwolkenmodell:
Vergleich: KWM - Orbitalmodell
| Orbitalmodell | Kugelwolkenmodell | ||
| gleich | • Unschärfebeziehung: Elektronen als Wellen | • Unschärfebeziehung: Elektronen als Wellen | |
| • Energie- und Pauliprinzip, Hundsche Regel | • Energie- und Pauliprinzip, Hundsche Regel | ||
| • Schalen der Atome: K, L, M, N usw. | • Schalen der Atome: K, L, M, N usw | ||
| verschieden | • Hybridisierung | • 4 Elektronenwolken | |
| • Berücksichtigung aller Schalen und Unterschalen | • Betonung der Valenzschalen, keine Unterschalen | ||
Grenzen des Modells
Bindungen der 1. und 2. Periode können mit dem Kugelwolkenmodell gut beschrieben werden, ab der 3. Periode nur eingeschränkt, da diese Atome auch Elektronen in den d- und f-Unerschalden aufweisen. Aus diesem Grund ist das Modell auch nicht geeignet für Nebengruppen: Diese haben ja alle grundsätzlich mit 2 gleich viele Valenzelektronen.
Die Lewisformel
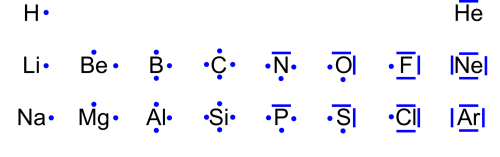
Mit der Lewisschreibweise zeigt man auf einem einfachen weg auf, wieviele Valenzelektronen ein Atom hat, und weiterführend wieviele Bindungen zwischen Nichtmetallatomen in Molekülen gemäss Kugelwolkenmodell entstehen können. Dabei werden die einfach besetzten Elektronenwolken durch einen einen Punkt und die doppelt besetzten mit einem Strich dargestellt.
Hier die Lewisschreibweise der Hauptgruppenelemente der ersten drei Perioden:
Bindung von zwei Cl-Atomen zum Cl2 - Molekül:
Bindung von H2O:
Man kann statt Strichen auch zwei Punkte schreiben:
Quellen
- http://wikipedia.org
- http://google.com
- Heftaufschrieb
- http://www.thomasmusolf.de/fuer_schueler_und_eltern/Chemie/Allgemeines/Wichtige%20Begriffe%20mit%20frame.html
- http://www.bionet.schule.de/~grube/fachlehr/chemie/fundamen/valenz.htm
- http://chemie.fb2.fh-frankfurt.de/Erlaeuterungen/11Hybridisierung-sp3.htm
- http://chemgapedia.de
- http://www.thomasmusolf.de/fuer_schueler_und_eltern/Chemie/Allgemeines/PSE%20-%20online07.jpg
- Elemente-Moleküle; von Roderich Magyar, Wolfgang Liebhart und Gabriela Jelinek