Die Redox-Reihe: Unterschied zwischen den Versionen
| (33 dazwischenliegende Versionen von einem anderen Benutzer werden nicht angezeigt) | |||
| Zeile 17: | Zeile 17: | ||
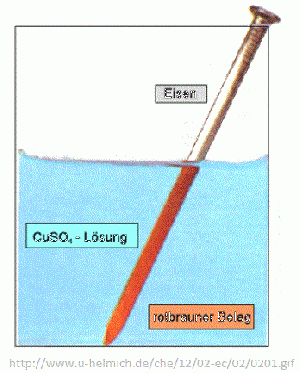
Ein Eisennagel wird in eine Kupfer(II)-sulfat-Lösung getaucht. Es scheidet sich Kupfer auf dem Eisen ab, das sich in der Lösung nachweisen lässt. | Ein Eisennagel wird in eine Kupfer(II)-sulfat-Lösung getaucht. Es scheidet sich Kupfer auf dem Eisen ab, das sich in der Lösung nachweisen lässt. | ||
| − | [[image:Abb.16_Redox.gif|thumb|right|Versuch Eisennagel | + | [[image:Abb.16_Redox.gif|thumb|right|Versuch Eisennagel]] |
Dabei läuft die folgende Reaktion ab: <br> | Dabei läuft die folgende Reaktion ab: <br> | ||
| Zeile 28: | Zeile 28: | ||
Mit weiteren Versuchen kann man eine Reihe von Metallen testen und erhält so eine Redoxreihe der Metalle (siehe unten). | Mit weiteren Versuchen kann man eine Reihe von Metallen testen und erhält so eine Redoxreihe der Metalle (siehe unten). | ||
| − | [[ | + | [[Datei:Redoxreihe_der_Metalle.jpg|200px|thumb|left|Redoxreihe der Metalle]] |
| + | |||
Alle Metalle mit negativem Standard-Reduktionspotenzial sind unedel, da sie gerne Elektronen abgeben, und sich so auflösen. | Alle Metalle mit negativem Standard-Reduktionspotenzial sind unedel, da sie gerne Elektronen abgeben, und sich so auflösen. | ||
| Zeile 39: | Zeile 40: | ||
Zugabe von Chlor in eine wässrige Lösung von Kaliumbromid ergibt eine Braunfärbung der Flüssigkeit. Dies ist so, weil sich Brom bildet. In der Lösung lassen sich Chlorid-Ionen nachweisen. | Zugabe von Chlor in eine wässrige Lösung von Kaliumbromid ergibt eine Braunfärbung der Flüssigkeit. Dies ist so, weil sich Brom bildet. In der Lösung lassen sich Chlorid-Ionen nachweisen. | ||
| − | + | [[image:Versuch Brom.JPG|thumb|right|Versuch Chlor Kaliumbromid]] | |
Folgende Reaktion findet statt: | Folgende Reaktion findet statt: | ||
| Zeile 52: | Zeile 53: | ||
===Redoxreihe ausgewählter Redoxpaare=== | ===Redoxreihe ausgewählter Redoxpaare=== | ||
| − | + | [[Datei:Redoxreihe ausgwaehlter Redoxpaare.gif|200px|thumb|left|Redoxreihe ausgewählter Redoxpaare]] | |
Metallatome stehen in der Redoxreihe links auf der Seite der Reduktoren, da sie bei chemischen Reaktionen grundsätzlich nur Elektronen abgeben können. Metall-Ionen findet man meist rechts, ausser solche, die noch weitere Elektronen abgeben können (wie z.B. Fe<sup>2+</sup>). Nichtmetalle befinden sich in der Redoxreihe in der rechten Spalte. Sie sind mehr oder weniger starke Oxidatoren. Die Anionen der Nichtmetalle sind entsprechend Reduktionsmittel und stehen in der linken Spalte. | Metallatome stehen in der Redoxreihe links auf der Seite der Reduktoren, da sie bei chemischen Reaktionen grundsätzlich nur Elektronen abgeben können. Metall-Ionen findet man meist rechts, ausser solche, die noch weitere Elektronen abgeben können (wie z.B. Fe<sup>2+</sup>). Nichtmetalle befinden sich in der Redoxreihe in der rechten Spalte. Sie sind mehr oder weniger starke Oxidatoren. Die Anionen der Nichtmetalle sind entsprechend Reduktionsmittel und stehen in der linken Spalte. | ||
| Zeile 63: | Zeile 64: | ||
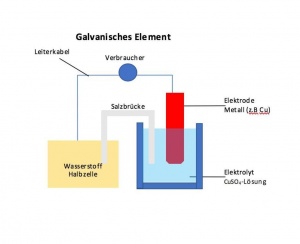
In der folgenden Abbildung sieht man, wie so ein Galvanisches Element aufgebaut ist. | In der folgenden Abbildung sieht man, wie so ein Galvanisches Element aufgebaut ist. | ||
| − | [[image:Galvanisches Element | + | [[image:Galvanisches_Element.jpg|thumb|right|Galvanisches Element]] |
==== Elektrode ==== | ==== Elektrode ==== | ||
Aktuelle Version vom 18. Mai 2020, 20:14 Uhr
Die Redoxreihe ist eine Auflistung von Elementen, die zusammen Redox-Paare bilden. Die Redoxpaare werden nach ihrem Redoxpotential unter Standardbedingungen (Druck=1013 mbar, Temperatur= 298,15K, Aktivität=1) sortiert. Aus der Redoxreihe lässt sich das Redoxverhalten eines Stoffes herauslesen. So kann jede Redoxreaktion durch zwei Paare beschrieben werden und die Richtung von Reaktionen vorausgesagt werden.
Inhaltsverzeichnis
Die Redox-Reihe
Korrespondierende Redoxpaare
Redox-Paar: Ein Reduktor wird durch Elektronenabgabe zum korrespondierenden Oxidator. Dabei wird immer die oxidierte Form zuerst angegeben.
Beispiel: Fe2 → Fe3 + e-
Reduktor und Oxidator einer Redoxreaktion bilden ein korrespondierendes Redoxpaar.
Redoxpotential: Die Summe des Oxidationspotentials und des Reduktionspotentials. Je „lieber“ ein Partner oxidiert wird und je „lieber“ der andere reduziert wird, desto grösser ist deren gemeinsames Redoxpotential. Das Redoxpotential beschreibt somit die Bereitschaft, Elektronen abzugeben und dadurch in die oxidierte Form überzugehen, bzw. Elektronen aufzunehmen und dadurch in die reduzierte Form überzugehen.
Die Reaktionen von Metall-Atomen mit Metall-Kationen
Die Fähigkeit zur Elektronenabgabe – das Reduktionsvermögen – ist unterschiedlich ausgeprägt. Beispiel: Ein Eisennagel wird in eine Kupfer(II)-sulfat-Lösung getaucht. Es scheidet sich Kupfer auf dem Eisen ab, das sich in der Lösung nachweisen lässt.
Dabei läuft die folgende Reaktion ab:
Oxidation: Fe(s) → Fe2+(aq) + 2e-
Reduktion: Cu2+(aq)+2e- → Cu(s)
Redoxreaktion: Fe(s) + Cu2+(aq) → Fe2+(aq) + Cu(s)
Wenn man den Versuch umgekehrt macht, also ein Stück Kupferblech in eine Eisensulfat-Lösung gibt, läuft keine Reaktion ab. Eisen ist von den beiden Metallen der stärkere Reduktor. Man sagt auch, Eisen ist „unedler“ als Kupfer.
Mit weiteren Versuchen kann man eine Reihe von Metallen testen und erhält so eine Redoxreihe der Metalle (siehe unten).
Alle Metalle mit negativem Standard-Reduktionspotenzial sind unedel, da sie gerne Elektronen abgeben, und sich so auflösen.
Unedle Metalle verwittern, rosten und oxidieren schneller.
Reaktion von Nichtmetall-Anionen mit Nichtmetall-Molekülen
Redoxpaare vom Typ Nichtmetall-Anion/Nichtmetall-Molekül lassen sich in eine Reihe einordnen.
Beispiel: Zugabe von Chlor in eine wässrige Lösung von Kaliumbromid ergibt eine Braunfärbung der Flüssigkeit. Dies ist so, weil sich Brom bildet. In der Lösung lassen sich Chlorid-Ionen nachweisen.
Folgende Reaktion findet statt:
Oxidation: 2Br-(aq) → Br2(aq) + 2e-
Reduktion: Cl2(g) → 2Cl-(aq)
Redoxreaktion: Cl2(g) + 2Br-(aq) → Br2(aq) + 2Cl-(aq)
Führt man den umgekehrten Versuch durch mit Brom, das man in eine Kaliumchlorid-Lösung einleitet, so erfolgt keine Reaktion. Daraus kann man schliessen, dass Chlor der stärkere Oxidator ist als Brom. Chloratome nehmen leichter Elektronen auf als Bromatome. Wie bei den Metallen kann man weitere Versuche durchführen und erhält so eine Reihe (die Redoxreihe).
Redoxreihe ausgewählter Redoxpaare
Metallatome stehen in der Redoxreihe links auf der Seite der Reduktoren, da sie bei chemischen Reaktionen grundsätzlich nur Elektronen abgeben können. Metall-Ionen findet man meist rechts, ausser solche, die noch weitere Elektronen abgeben können (wie z.B. Fe2+). Nichtmetalle befinden sich in der Redoxreihe in der rechten Spalte. Sie sind mehr oder weniger starke Oxidatoren. Die Anionen der Nichtmetalle sind entsprechend Reduktionsmittel und stehen in der linken Spalte.
Grundsätzlich gilt: Eine Redoxreaktion läuft nur dann ab, wenn sich dabei einen schwächeren Oxidiator bzw. Reduktor bildet.
Galvanische Elemente
Definition: Galvanische Elemente, benannt nach dem italienischen Mediziner LUIGI GALVANI, sind elektrochemische Zellen, in der eine freiwillige Elektrodenreaktion abläuft, wodurch chemische Energie in elektrische Energie umgewandelt wird und so zum Beispiel eine Batterie angetrieben werden kann. In der folgenden Abbildung sieht man, wie so ein Galvanisches Element aufgebaut ist.
Elektrode
Eine Elektrode ist ein elektrischer Leiter, der im direkten Kontakt mit einem Elektrolyten steht (meistens ein Metall). Er leitet Elektronen und Ionen. Im Galvanischen Element nennt man die Elektrode an der eine Oxidation erfolgt, eine Anode (negativ). Die Elektrode, an der eine Reduktion erfolgt, nennt man Katode. Sie stellt den Gegenpol zur Anode dar.
Elektrolyte
Elektrolyte sind chemische Stoffe, die im festen, flüssigen oder gelösten Zustand in Ionen sich auflösen und so einen Stromtransport durch Ionenverschiebungen ermöglichen.
Quellen
- Chemieunterlagen
- http://chemie.de
- http://chemie-master.de
- http://u-helmich.de
Weblinks
* Swisseduc – Unterrichtsserver für Chemie