Anwendungen: "Kalkerosion und Kalkkreislauf": Unterschied zwischen den Versionen
| (19 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 3: | Zeile 3: | ||
== Der Kalkkreislauf in der Natur == | == Der Kalkkreislauf in der Natur == | ||
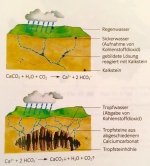
| − | + | [[Datei:Kalkkreislauf_in_der_Natur.jpg|150px|thumb|right|Abbildung 1: Kalkkreislauf in der Natur (Quelle: Elemente: Grundlagen der Chemie für Schweizer Maturitätsschulen, Klett und Balmer Verlag Zug, 1. Auflage, 2007)]] | |
| − | Wenn der Untergrund in der Natur aus Kalk besteht, hat es häufig Spalten und Höhlen im Gestein, welche durch die Umwandlung des | + | Wenn der Untergrund in der Natur aus Kalk besteht, hat es häufig Spalten und Höhlen im Gestein, welche durch die Umwandlung des Calciumhydrogencarbonates in Calciumcarbonat (Kalk) entstehen. Diese Reaktion findet statt, wenn CO<sub>2</sub>-haltiges Regenwasser in das Gestein eindringt. Das Regenwasser nimmt auf dem Weg durch die Luft Kohlenstoffdioxid auf und beim Eindringen in den Boden entstehen die Furchen. |
| − | + | Der Kalkkreislauf wird als Kreislauf bezeichnet, da sich die erklärten Prozesse ständig wiederholen. | |
| − | |||
| − | |||
Die Reaktionsgleichung dieser Gleichgewichtsreaktion sieht folgendermassen aus: | Die Reaktionsgleichung dieser Gleichgewichtsreaktion sieht folgendermassen aus: | ||
| − | + | CaCO<sub>2(s)</sub> + H<sub>2</sub>O<sub>(l)</sub> + CO<sub>2(g)</sub> ⇌ Ca(HCO<sub>3</sub>)<sub>2(aq)</sub> | |
=== Tropfsteinhöhlen === | === Tropfsteinhöhlen === | ||
| − | Genau durch diesen Vorgang entstehen Tropfsteinhöhlen. Wenn ein Wassertropfen die Decke einer Höhle erreicht, entweicht das CO< | + | Genau durch diesen Vorgang entstehen Tropfsteinhöhlen. Wenn ein Wassertropfen die Decke einer Höhle erreicht, entweicht das CO<sub>2</sub> in die Höhle, da diese einen CO<sub>2</sub>-Mangel hat und eine Verschiebung des Gleichgewichts innerhalb der obigen Gleichung führt dazu, dass es eine Kalkablagerung an der Decke der Höhle entsteht. Solche Ablagerungen entwickeln sich zu den sogenannten Stalaktiten. Derselbe Vorgang kann sich am Höhlenboden abspielen, wenn ein Wassertropfen zu Boden fällt. Die vom Boden herausragenden Kalkgebilde werden Stalagmiten genannt. Die Ablagerungen wachsen jährlich um circa 0,2 mm. |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | == | + | === Wie findet man heraus, wo das Gleichgewicht in der Gleichung liegt? === |
| − | + | Das Gleichgewicht ist vom CO<sup>2</sup>-Gehalt abhängig. Die Wasserhärte ist durch den CO<sup>2</sup>-Gehalt bestimmbar. Beispielsweise Pflanzen bewirken einen tiefen Kohlenstoffdioxidgehalt durch die Photosynthese, sodass das Gleichgewicht links liegt. Seen haben folglich weiches Wasser, da durch die Algenpflanzen das Gleichgewicht links gehalten wird. Der überschüssige Kalk, welcher nicht im Wasser selbst bleibt, lagert sich am Seegrund ab. | |
| − | + | Allgemein kann gesagt werden: | |
| − | + | CO<sub>2</sub>-Wert tief - Gleichgewicht links - weiches Wasser (geringer Kalkgehalt) - Kalkablagerungen | |
| − | + | CO<sub>2</sub>-Wert hoch - Gleichgewicht rechts - hartes Wasser (hoher Kalkgehalt) - keine Kalkablagerungen | |
| − | |||
| − | + | ==== Kalk in Boilern ==== | |
| − | + | Die Kalkablagerungen sind im Haushalt sehr störend, da sie beispielsweise Wasserhahnen und -leitungen verstopfen, aber auch Boiler sind davon beeinträchtigt. Boiler sind metallene Behälter, welche als Warmwassererwärmer und Speicher dienen. Wenn die Heizstäbe in den Boilern von Kalk belagert werden, werden sie isoliert und die Wärme wird schlechter abgegeben. Somit nimmt die Leistung von verkalkten Boilern ab. | |
| − | ==== | + | ==== Wasserhärte ==== |
| + | Die Wasserhärte hängt von der Ca2+, Mg2+, Sr2+ und Ba2+ Konzentration ab. Der Begriff "Wasserhärte", bzw. "hartes Wasser" ist entstanden, weil beim Waschen mit hartem Wasser die Wäsche hart wird und umgekehrt mit weichem Wasser sehr fein und angenehm wird. Die benutzte Seife bildet nämlich Kalkseife gemeinsam mit dem harten Wasser. | ||
| − | So | + | Es gibt neuerdings nur noch die drei Abstufungen "hart", "mittel" und "weich" und keine Zahlenskala zur Angabe der Wasserhärte. So ist es für den Ottonormalverbraucher einfacher, die richtigen Waschmittel zu kaufen, weil er weiss, welche Wasserhärte im Eigenheim vorhanden ist. |
| − | |||
| + | === Kalkbrennerei === | ||
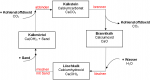
| + | [[Datei:Kalkkreislauf.png|150px|thumb|right|Abbildung 2: Technischer Kalkkreislauf oder Kalkbrennerei (Quelle: Wikipedia, Technischer Kalkkreislauf, heruntergeladen am: 26.06.2016)]] | ||
| + | Das Brennen von Kalk wird als technischer Kalkkreislauf oder Kalkbrennerei bezeichnet. Der Kalkmörtel wird oft als Baustoff und zur Herstellung von Zement, Brannt- und Löschkalk benutzt. | ||
| − | |||
| − | |||
| − | + | Gebrannter Kalk: Durch die Erhitzung des Kalkes auf circa 1000 Grad Celsius zerfällt er in CO<sub>2</sub> und Calciumoxid. | |
| − | |||
| − | |||
| − | + | CaCO<sub>3</sub> → CaO + CO<sub>2</sub> | |
| − | |||
| − | |||
| − | < | ||
| − | |||
| − | + | Löschkalk: Calciumoxid und Wasser reagieren exotherm. Die Reaktion wird als Löschen bezeichnet, da Wasser verwendet wird. | |
| − | + | Kalkmörtel: Löschkalk vermischt mit Sand und Wasser wiederum ergibt Mörtel, welcher als Bindemittel von Mauersteinen verwendet wird, mittlerweile jedoch oftmals von Zement ersetzt worden ist. Wenn Kalkmörtel Kohlenstoffdioxid aus der Luft aufnimmt, entsteht wieder Calciumcarbonat. | |
| − | |||
| − | + | Die obig erklärten Vorgänge können also in einem Kreislauf zusammengefasst werden, der technische Kalkkreislauf. | |
| − | + | === Anwendungsbereiche des Kalkes === | |
| − | + | ==== Kalkfarbe ==== | |
| + | Kalkfarbe ist die ideale Farbe in schimmelgefährdeten Bereichen, beispielsweise in sanitären Anlagen, da sie eine desinfizierende Wirkung hat. Sie wird heutzutage immer noch angewandt, keine neuere Erfindung kommt an die Kalkfarbe heran. | ||
| + | Durch die desinfizierende Wirkung ist die Kalkfarbe sehr beliebt, speziell in Gebieten, wo sich Seuchen schnell verbreiten. Im Mittelmeergebiet (beispielsweise in Griechenland) sind deshalb praktisch alle Häuser mit Kalkfarbe bestrichen, weshalb sie alle in demselben Weiss erstrahlen. Dies hat also vor allem einen hygienischen Zweck, nicht wie oft gedacht einen ästhetischen. | ||
| − | |||
| − | + | === Quellen === | |
| − | + | * Chemieunterlagen von Herr R. Deuber | |
| + | * Wikipedia: Technischer Kalkkreislauf | ||
| − | + | * Elemente: Grundlagen der Chemie für Schweizer Maturitätsschulen, Klett und Balmer Verlag Zug, 1. Auflage, 2007 | |
| − | + | * Elemente: Chemie 1, Unterrichtswerk für Gymnasien, Ernst Klett Verlag Deutschland, 1. Auflage, 1986 | |
| − | + | * Elemente: Sicher und kompetent zur Matura, ÖBV Verlag, 1. Auflage, 2011 | |
| − | + | === Weblinks === | |
| − | |||
| − | |||
| − | == | ||
| − | |||
| − | |||
| − | == | ||
* [http://swisseduc.ch/chemie/ Swisseduc] – Unterrichtsserver für Chemie | * [http://swisseduc.ch/chemie/ Swisseduc] – Unterrichtsserver für Chemie | ||
| − | * [ | + | * [https://de.wikipedia.org/wiki/Technischer_Kalkkreislauf] – Wikipedia Eintrag zum technischen Kalkkreislauf |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
Aktuelle Version vom 23. Oktober 2016, 15:13 Uhr
Inhaltsverzeichnis
Der Kalkkreislauf in der Natur
Wenn der Untergrund in der Natur aus Kalk besteht, hat es häufig Spalten und Höhlen im Gestein, welche durch die Umwandlung des Calciumhydrogencarbonates in Calciumcarbonat (Kalk) entstehen. Diese Reaktion findet statt, wenn CO2-haltiges Regenwasser in das Gestein eindringt. Das Regenwasser nimmt auf dem Weg durch die Luft Kohlenstoffdioxid auf und beim Eindringen in den Boden entstehen die Furchen. Der Kalkkreislauf wird als Kreislauf bezeichnet, da sich die erklärten Prozesse ständig wiederholen.
Die Reaktionsgleichung dieser Gleichgewichtsreaktion sieht folgendermassen aus:
CaCO2(s) + H2O(l) + CO2(g) ⇌ Ca(HCO3)2(aq)
Tropfsteinhöhlen
Genau durch diesen Vorgang entstehen Tropfsteinhöhlen. Wenn ein Wassertropfen die Decke einer Höhle erreicht, entweicht das CO2 in die Höhle, da diese einen CO2-Mangel hat und eine Verschiebung des Gleichgewichts innerhalb der obigen Gleichung führt dazu, dass es eine Kalkablagerung an der Decke der Höhle entsteht. Solche Ablagerungen entwickeln sich zu den sogenannten Stalaktiten. Derselbe Vorgang kann sich am Höhlenboden abspielen, wenn ein Wassertropfen zu Boden fällt. Die vom Boden herausragenden Kalkgebilde werden Stalagmiten genannt. Die Ablagerungen wachsen jährlich um circa 0,2 mm.
Wie findet man heraus, wo das Gleichgewicht in der Gleichung liegt?
Das Gleichgewicht ist vom CO2-Gehalt abhängig. Die Wasserhärte ist durch den CO2-Gehalt bestimmbar. Beispielsweise Pflanzen bewirken einen tiefen Kohlenstoffdioxidgehalt durch die Photosynthese, sodass das Gleichgewicht links liegt. Seen haben folglich weiches Wasser, da durch die Algenpflanzen das Gleichgewicht links gehalten wird. Der überschüssige Kalk, welcher nicht im Wasser selbst bleibt, lagert sich am Seegrund ab.
Allgemein kann gesagt werden:
CO2-Wert tief - Gleichgewicht links - weiches Wasser (geringer Kalkgehalt) - Kalkablagerungen
CO2-Wert hoch - Gleichgewicht rechts - hartes Wasser (hoher Kalkgehalt) - keine Kalkablagerungen
Kalk in Boilern
Die Kalkablagerungen sind im Haushalt sehr störend, da sie beispielsweise Wasserhahnen und -leitungen verstopfen, aber auch Boiler sind davon beeinträchtigt. Boiler sind metallene Behälter, welche als Warmwassererwärmer und Speicher dienen. Wenn die Heizstäbe in den Boilern von Kalk belagert werden, werden sie isoliert und die Wärme wird schlechter abgegeben. Somit nimmt die Leistung von verkalkten Boilern ab.
Wasserhärte
Die Wasserhärte hängt von der Ca2+, Mg2+, Sr2+ und Ba2+ Konzentration ab. Der Begriff "Wasserhärte", bzw. "hartes Wasser" ist entstanden, weil beim Waschen mit hartem Wasser die Wäsche hart wird und umgekehrt mit weichem Wasser sehr fein und angenehm wird. Die benutzte Seife bildet nämlich Kalkseife gemeinsam mit dem harten Wasser.
Es gibt neuerdings nur noch die drei Abstufungen "hart", "mittel" und "weich" und keine Zahlenskala zur Angabe der Wasserhärte. So ist es für den Ottonormalverbraucher einfacher, die richtigen Waschmittel zu kaufen, weil er weiss, welche Wasserhärte im Eigenheim vorhanden ist.
Kalkbrennerei
Das Brennen von Kalk wird als technischer Kalkkreislauf oder Kalkbrennerei bezeichnet. Der Kalkmörtel wird oft als Baustoff und zur Herstellung von Zement, Brannt- und Löschkalk benutzt.
Gebrannter Kalk: Durch die Erhitzung des Kalkes auf circa 1000 Grad Celsius zerfällt er in CO2 und Calciumoxid.
CaCO3 → CaO + CO2
Löschkalk: Calciumoxid und Wasser reagieren exotherm. Die Reaktion wird als Löschen bezeichnet, da Wasser verwendet wird.
Kalkmörtel: Löschkalk vermischt mit Sand und Wasser wiederum ergibt Mörtel, welcher als Bindemittel von Mauersteinen verwendet wird, mittlerweile jedoch oftmals von Zement ersetzt worden ist. Wenn Kalkmörtel Kohlenstoffdioxid aus der Luft aufnimmt, entsteht wieder Calciumcarbonat.
Die obig erklärten Vorgänge können also in einem Kreislauf zusammengefasst werden, der technische Kalkkreislauf.
Anwendungsbereiche des Kalkes
Kalkfarbe
Kalkfarbe ist die ideale Farbe in schimmelgefährdeten Bereichen, beispielsweise in sanitären Anlagen, da sie eine desinfizierende Wirkung hat. Sie wird heutzutage immer noch angewandt, keine neuere Erfindung kommt an die Kalkfarbe heran. Durch die desinfizierende Wirkung ist die Kalkfarbe sehr beliebt, speziell in Gebieten, wo sich Seuchen schnell verbreiten. Im Mittelmeergebiet (beispielsweise in Griechenland) sind deshalb praktisch alle Häuser mit Kalkfarbe bestrichen, weshalb sie alle in demselben Weiss erstrahlen. Dies hat also vor allem einen hygienischen Zweck, nicht wie oft gedacht einen ästhetischen.
Quellen
- Chemieunterlagen von Herr R. Deuber
- Wikipedia: Technischer Kalkkreislauf
- Elemente: Grundlagen der Chemie für Schweizer Maturitätsschulen, Klett und Balmer Verlag Zug, 1. Auflage, 2007
- Elemente: Chemie 1, Unterrichtswerk für Gymnasien, Ernst Klett Verlag Deutschland, 1. Auflage, 1986
- Elemente: Sicher und kompetent zur Matura, ÖBV Verlag, 1. Auflage, 2011