II Welt der Salze: Unterschied zwischen den Versionen
(→Abkürzungen) |
|||
| (44 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 10: | Zeile 10: | ||
| − | == | + | == Posten A: Zucker oder Salz == |
| − | Zucker von Salz | + | Zucker von Salz unterscheiden. Da viele Salze für den Menschen giftig sind, ist von einem Geschmackstest unbedingt abzuraten. |
| + | |||
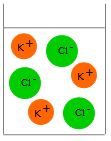
| + | [[image:Salz_Abb.3.jpg|thumb|Abb.3: Das Kaliumchlorid wird in K<sup>+</sup> - und Cl<sup>-</sup> -Ionen getrennt und von Wassermolekülen umgeben, ''hydratisiert''.]] | ||
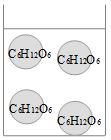
| + | <div class="tright" style="clear:none">[[Datei:Salz_Abb.2.jpg|thumb|Abb.2: Die einzelnen Glucosemoleküle lösen sich nicht auf.]]</div> | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
=== Versuchsaufbau === | === Versuchsaufbau === | ||
| − | Glucose (Traubenzucker, C<sub>6</sub>H<sub>12</sub>O<sub>6</sub>)und Kaliumchlorid (KCl) in je einem Becherglas mit 50 ml deionisiertem Wasser auflösen und die Lösung mit einem Leitfähigkeitsmessgeräts auf elektrische Leitfähigkeit überprüfen. | + | Glucose (Traubenzucker, C<sub>6</sub>H<sub>12</sub>O<sub>6</sub>) und Kaliumchlorid (KCl) in je einem Becherglas mit 50 ml deionisiertem Wasser auflösen und die Lösung mit einem Leitfähigkeitsmessgeräts auf elektrische Leitfähigkeit überprüfen. Das Leitfähigkeitsmessgerät besteht aus einer Batterie, einem Lämpchen und einem unterbrochenen Stromkreislauf. Wenn man die beiden Metalldrähte (Anode und Kathode) in eine Flüssigkeit taucht, die Strom leitet, schliesst sich der Stromkreis und das Lämpchen leuchtet auf. |
=== Beobachtung === | === Beobachtung === | ||
| Zeile 29: | Zeile 27: | ||
=== Erklärung === | === Erklärung === | ||
| − | + | Wenn die Salzkristalle ins Wasser gegeben werden, lagern sich Wassermoleküle mit dem jeweils entgegen gesetzt geladenen Teil an die Kat- und Anionen im Ionengitter an. Dabei wird etwas Energie frei, die Entropie im Salzgitter erhöht sich, die Schwing- und Pendelbewegungen der Ionen erhöhen sich, bis die Bewegungen so stark werden, dass sich einzelne Ionen aus der Gitterstruktur herauslösen und vollständig von Wasserteilchen umgeben werden. Dabei erhöht sich die Entropie erneut (mehr frei bewegliche Teilchen, flüssig statt fest). Da sich bei diesem Lösungsvorgang die Gesamtentropie im System erhöht, läuft der Vorgang weiter, bis sich alle K<sup>+</sup>- und Cl<sup>-</sup>-Ionen frei beweglich zwischen den Wassermolekülen befinden. | |
| − | Die | + | |
| + | Sobald das Leitfähigkeitsmessgerät eingeschaltet wird, beginnen die K<sup>+</sup>-Ionen zur Kathode zu wandern, die Cl<sup>-</sup>-Ionen zur Anode. Einmal bei der Kathode angekommen nehmen die K<sup>+</sup>-Ionen ein Elektron auf und werden zu Kalium-Atomen, die Cl<sup>-</sup>-Ionen geben bei der Anode ein Elektron ab und verbinden sich zu Chlor-Molekülen (Cl<sub>2</sub>). | ||
| + | Die chemischen Bindungen in den Glucosemoleküle werden nicht getrennt; sie bleiben elektrisch neutral. Sie können weder Elektronen abgeben, noch aufnehmen. | ||
Fazit: In Wasser gelöste Salze leiten elektrischen Strom. | Fazit: In Wasser gelöste Salze leiten elektrischen Strom. | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | == | + | == Posten B: Zwei Eisensalze == |
| − | |||
[[image:Salz_Abb.4.jpg|thumb|left|Abb. 4: Eisen(III)-chlorid (FeCl<sub>3</sub>)]] | [[image:Salz_Abb.4.jpg|thumb|left|Abb. 4: Eisen(III)-chlorid (FeCl<sub>3</sub>)]] | ||
| − | [[image:Salz_Abb.5.jpg|thumb| | + | <div class="tleft" style="clear:none">[[image:Salz_Abb.5.jpg|thumb|right|Abb. 5: Abb. 5: Eisen(III)-oxid (Fe<sub>3</sub>O<sub>2</sub>)]]</div> |
| − | + | Eisen bildet mit Halogenen, Sauerstoff und Sulfaten (SO<sub>4</sub><sup>2-</sup>) farbige Salze. In diesem Versuch geht es darum Eisen(III)-chlorid und Eisen(III)-oxid auf ihre Löslichkeit in Wasser zu überprüfen. | |
| − | |||
=== Versuchsaufbau === | === Versuchsaufbau === | ||
| Zeile 51: | Zeile 45: | ||
=== Beobachtung === | === Beobachtung === | ||
| − | Das deionisierte Wasser mit dem Eisen(III)-chlorid wird nach kurzer Zeit wieder transparent | + | Das deionisierte Wasser mit dem Eisen(III)-chlorid wird nach kurzer Zeit wieder transparent. |
| − | Das deionisierte Wasser mit dem Eisen(III)-oxid bleibt trüb | + | Das deionisierte Wasser mit dem Eisen(III)-oxid bleibt trüb. Es handelt sich um eine Suspension. |
=== Erklärung === | === Erklärung === | ||
| + | [[image:Salz_Abb.7.jpg|thumb|right|Abb. 7: Kompaktes Ionengitter von Eisen(III)-oxid ]] | ||
| + | <div class="tright" style="clear:none">[[image:Salz_Abb.6.jpg|thumb|right|Abb. 6: Schichtweise aufgebautes Ionengitter von Eisen(III)-chlorid.]]</div> | ||
| + | Die Löslichkeit von Salzen hat mit der Gitterenergie E<sub>G</sub> zu tun. Diese hängt von Ladung und Radius der beteiligten Ionen sowie von der Struktur des Ionengitters ab. Je kleiner der Radius und je höher die Ladung der Ionen eines Salzes desto grösser ist dessen Gitterenergie und desto weniger gut löslich ist es. Man könnte nun meinen, dass sich jedes Salz vollständig in Wasser lösen sollte, da sich dabei ja die Entropie im Salz erhöhen würde (mehr freie Teilchen, flüssig statt fest). Der Haken dabei ist, dass in gewissen Ionengitter die elektrostatischen Anziehungskräfte zwischen den Ionen derart gross sind, dass das umgebende Wasser die zum Lösungsvorgang benötigte (Wärme-)Energie theoretisch zwar zur Verfügung stellen könnte, sich dabei aber so stark abkühlte, dass der Entropiegewinn, der beim Lösungsvorgang des Salzes entstünde, durch den Entropieverlust im Wasser bei weitem kompenisert würde. Insgesamt würde die Entropie absinken, was gemäss dem 2. Hauptsatz der Thermodynamik nicht möglich ist. | ||
| + | |||
| + | Sowohl beim Eisen(III)-chlorid als auch beim Eisen(III)-oxid sind die Eisenionen dreifach positiv geladen. Die Chloridionen sind aber nur einfach negativ, die Oxidionen hingegen doppelt negativ geladen. Zudem ist der Ionenradius des Chloridions grösser als derjenige des Oxidions. Das führt nun dazu, dass Eisen(III)-chlorid in Wasser löslich ist, wohingegen Eisen(III)-oxid nahezu unlöslich ist. Die elektrostatischen Anziehungskräfte zwischen den 3-fach positiv geladenen Fe<sup>3+</sup>-Ionen und den doppelt negativ geladenen O<sup>2-</sup> ist so gross, dass sich bei einem Lösungsvorgang die Entropie im Gesamtsystem absenken würde, was wie oben gesehen, nicht möglich ist. | ||
| − | + | ====<span style="color:#4C4C4C;">Fragen</span>==== | |
| − | + | <span style="color:#4C4C4C;">'''1.a. Eisenoxide sind die wertvollen Bestandteile von ''Eisenerzen''. Falls Sie das schon vor dem Experiment wussten, dann konnten Sie vermutlich die Löslichkeit des einen Salzes voraussagen. Was wäre Ihre Vermutung gewesen?'''</span> | |
| − | |||
| − | |||
| − | |||
| + | Ich hätte vermutet, dass Eisen(III)-oxid unlöslich ist. Wäre Eisenoxid wasserlöslich, wäre es aus dem Gestein herausgewaschen worden und es gäbe keine Eisenerze. | ||
| + | <span style="color:#4C4C4C;">'''b. Was wissen Sie bereits über Eisenerz?'''</span> | ||
| − | == | + | Eisenerz wird im Berg- oder Tagbau abgebaut und zwecks Eisengewinnung verhüttet. Eisen wird mithilfe von Koks im Hochofen aus Eisenerz gewonnen. |
| + | |||
| + | == Posten C: Chloridionen entdecken == | ||
Mithilfe von Silbernitrat können Chloridionen nachgewiesen werden. | Mithilfe von Silbernitrat können Chloridionen nachgewiesen werden. | ||
| Zeile 76: | Zeile 76: | ||
=== Beobachtung === | === Beobachtung === | ||
| − | RG mit Wasser von A = | + | RG mit Wasser von A = Wasser bleibt klar. |
| − | RG mit Wasser von B = | + | |
| + | RG mit Wasser von B = Wasser wir mit einer weissen Substanz eingetrübt. | ||
=== Erklärung === | === Erklärung === | ||
Silbernitrat löst sich sehr gut in Wasser auf. Im Wasser gelöste Silber- und Chloridionen ziehen sich so stark an, dass sie sich zu einem Ionengitter verbinden und als Salzkristalle ausgefällt werden. | Silbernitrat löst sich sehr gut in Wasser auf. Im Wasser gelöste Silber- und Chloridionen ziehen sich so stark an, dass sie sich zu einem Ionengitter verbinden und als Salzkristalle ausgefällt werden. | ||
| − | |||
| − | |||
Reaktionsgleichungen: | Reaktionsgleichungen: | ||
| − | Na<sup>+</sup> (aq) + Cl<sup>-</sup> (aq) + Ag<sup>+</sup> (aq) + NO3<sup>-</sup> (aq) → AgCl (s) + Na<sup>+</sup> (aq) + NO<sup>-</sup> (aq) | + | Na<sup>+</sup> (aq) + Cl<sup>-</sup> (aq) + Ag<sup>+</sup> (aq) + NO3<sup>-</sup> (aq) → '''AgCl (s)''' + Na<sup>+</sup> (aq) + NO<sup>-</sup> (aq) |
oder kompakter: | oder kompakter: | ||
| − | NaCl (aq) + | + | NaCl (aq) + AgNO<sub>3</sub> (aq) → '''AgCl (s)''' + NaNO<sub>3</sub> (aq) |
| + | == Posten D: Lösen von Salzen in Wasser == | ||
| − | + | Wir lösen verschiedene Salze in Wasser und messen im Anschluss daran die Wassertemperatur | |
| − | |||
| − | Wir lösen verschiedene Salze in Wasser und | ||
Salze: Lithiumchlorid (LiCl), Natriumchlorid (NaCl), Kaliumchlorid (KCl), Calciumchlorid (CaCl<sub>2</sub>) und Ammoniumchlorid (NH<sub>4</sub>Cl) | Salze: Lithiumchlorid (LiCl), Natriumchlorid (NaCl), Kaliumchlorid (KCl), Calciumchlorid (CaCl<sub>2</sub>) und Ammoniumchlorid (NH<sub>4</sub>Cl) | ||
| Zeile 111: | Zeile 109: | ||
| Lithiumchlorid (LiCl) | | Lithiumchlorid (LiCl) | ||
| Li<sup>+</sup> Cl<sup>-</sup> | | Li<sup>+</sup> Cl<sup>-</sup> | ||
| − | | 24°C | + | | style="text-align:center"|24°C |
| − | | | + | | style="text-align:center"|4°C |
| E<sub>H</sub> > E<sub>G</sub> exotherm | | E<sub>H</sub> > E<sub>G</sub> exotherm | ||
|- | |- | ||
| Natriumchlorid (NaCl) | | Natriumchlorid (NaCl) | ||
| Na<sup>+</sup> Cl<sup>-</sup> | | Na<sup>+</sup> Cl<sup>-</sup> | ||
| − | | 20°C | + | | style="text-align:center"|20°C |
| − | | 0°C | + | | style="text-align:center"|0°C |
| E<sub>H</sub> ≈ E<sub>G</sub> | | E<sub>H</sub> ≈ E<sub>G</sub> | ||
|- | |- | ||
| Kaliumchlorid (KCl) | | Kaliumchlorid (KCl) | ||
| K<sup>+</sup> Cl<sup>-</sup> | | K<sup>+</sup> Cl<sup>-</sup> | ||
| − | | 15°C | + | | style="text-align:center"|15°C |
| − | | -5°C | + | | style="text-align:center"|-5°C |
| E<sub>H</sub> < E<sub>G</sub> endotherm | | E<sub>H</sub> < E<sub>G</sub> endotherm | ||
|- | |- | ||
| Calciumchlorid (CaCl<sub>2</sub>) | | Calciumchlorid (CaCl<sub>2</sub>) | ||
| Ca<sup>2+</sup> Cl<sup>-</sup> | | Ca<sup>2+</sup> Cl<sup>-</sup> | ||
| − | | 26°C | + | | style="text-align:center"|26°C |
| − | | | + | | style="text-align:center"|6°C |
| E<sub>H</sub> > E<sub>G</sub> exotherm | | E<sub>H</sub> > E<sub>G</sub> exotherm | ||
|- | |- | ||
| Ammoniumchlorid (NH<sub>4</sub>Cl) | | Ammoniumchlorid (NH<sub>4</sub>Cl) | ||
| Na<sub>4</sub><sup>+</sup> Cl<sup>-</sup> | | Na<sub>4</sub><sup>+</sup> Cl<sup>-</sup> | ||
| − | | 18°C | + | | style="text-align:center"|18°C |
| − | | -2°C | + | | style="text-align:center"|-2°C |
| E<sub>H</sub> < E<sub>G</sub> endotherm | | E<sub>H</sub> < E<sub>G</sub> endotherm | ||
|} | |} | ||
| + | |||
=== Erklärung === | === Erklärung === | ||
| + | [[Bild:Salz_Abb.9b.jpg|thumb|right|Abb.9b: Schematische Darstellung des Lösungsvorgangs von Kaliumchlorid (endotherm)]] | ||
| + | <div class="tright" style="clear:none">[[Datei:Salz_Abb.9a.jpg|thumb|right|Abb.9a: Schematische Darstellung des Lösungsvorgangs von Lithiumchlorid (exotherm)]]</div> | ||
| + | Wenn ein Salzkristall ins Wasser gegeben wird, docken Wassermoleküle an ihn an. Da Wassermoleküle Dipole sind, können sie sich sowohl bei den Kationen als auch bei den Anionen anlagern. Durch dieses Anlagern wird etwas Energie frei, was die Entropie und die Pendelbewegung der Ionen im Ionengitter erhöht; allmählich beginnen sich die Ionen an den Ecken und Rändern aus dem Ionengitter herauszulösen. Einmal herausgelöst werden sie von Wassermolekülen umgeben. Dieser Vorgang nennt sich Hydratation, bei dem die Hydratationsenergie E<sub>H</sub> frei wird. Die Entropie hat sich ein zweites Mal erhöht. | ||
| + | Ist nun bei einem Salz die Hydratationsenergie grösser als die für den Lösungsvorgang hinderliche Gitterenergie E<sub>G</sub> verläuft der Lösungsvorgang exotherm, die Umgebungstemperatur erhöht sich (s. Abb. 9a). Im umgekehrten Fall wird dem Wasser Wärmeenergie entzogen, damit die Gitterenergie doch noch überwunden werden kann. Der Lösungsvorgang verläuft endotherm (s. Abb. 9b). Für die Temperaturänderung massgebend ist auch die Menge des Salzes, das man zugibt. Bei grösseren Salzmengen wird die Temperaturänderung vergrössert. | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | ||
| − | RG = Reagenzglas | + | ==== <span style="color:#4C4C4C;">Fragen</span> ==== |
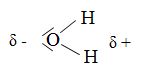
| + | [[image:Salz_Abb.10.jpg|thumb|right|Abb.10: Wassermoleküle sind Dipole; das Sauerstoffatom zieht die beiden negativ geladenen Elektronen der Wasserstoffatome in seine Richtung.]] | ||
| + | <span style="color:#4C4C4C;">'''1.a. Ein Salzkristall wird ins Wasser gegeben. Die ''Salzteilchen'' und die ''Wassermoleküle'' treten miteinander in Wechselwirkung.'''</span> | ||
| + | <span style="color:#4C4C4C;">'''Worauf beruht diese Wechselwirkung?'''</span> | ||
| + | |||
| + | Wassermoleküle sind Dipole. Sie richten sich mit ihrem positiv geladenen Teil zu den Anionen, mit dem negativ geladenen Teil zu den Kationen aus. Sie treten mit den Ionen im Salzgitter in eine elektrostatische Wechselwirkung. | ||
| + | |||
| + | <span style="color:#4C4C4C;">'''b. Wie liegt das gelöste Salz vor?'''</span> | ||
| + | |||
| + | Die Ionen sind umgeben von Wassermolekülen, sie sind ''hydratisiert''. Die Kationen werden von Wassermolekülen umgeben, die ihnen ihren negativ geladen Pol zuwenden. Die Anionen werden von Wassermolekülen umgeben, die ihnen den positiv geladenen Pol zuwenden. | ||
| + | |||
| + | <span style="color:#4C4C4C;">'''2. Bei der Wechselwirkung wird Energie frei: die Hydratationsenergie E<sub>H</sub>. Diese fördert den Lösungsvorgang. Es gibt jedoch eine zweite Kraft, welche dem Lösungsvorgang entgegenwirkt. Um was handelt es sich?'''</span> | ||
| + | |||
| + | Es handelt sich um die elektrostatische Anziehungskraft zwischen den Ionen in der Gitterstruktur. Um all diese Anziehungskräfte im Ionengitter zu überwinden, wird die Gitterenergie E<sub>G</sub> benötigt. | ||
| + | |||
| + | <span style="color:#4C4C4C;">'''3. Es gibt Salze, bei denen wird beim Lösen Wärme frei (''exothermer'' Lösungsvorgang). Andere lösen sich unter starker Abkühlung (''endothermer'' Lösungsvorgang). Wie schätzen Sie für diese beiden Fälle die förderliche und die hinderliche Energie ein?'''</span> | ||
| + | |||
| + | Beim exothermen Lösungsvorgang ist die zum Lösen förderliche Hydratationsenergie E<sub>H</sub> grösser als die zum Lösen hinderliche Gitterenergie E<sub>G</sub>. | ||
| + | Beim endothermen Lösungsvorgang ist es gerade umgekehrt. | ||
| + | |||
| + | <span style="color:#4C4C4C;">'''4. Welche Verhältnisse herrschen bei ''schwerlöslichen'' Salzen?'''</span> | ||
| + | |||
| + | Bei schwerlöslichen Salzen ist die Hydratationsenergie vernachlässigbar klein im Vergleich zur Gitterenergie, es gilt: E<sub>G</sub> >> E<sub>H</sub>. Die Zunahme der Entropie, die entstünde, wenn sich ein schwerlösliches Salz in Wasser löste, würde durch die Zunahme der Ordnung (Bewegungen der Wassermoleküle werden langsamer) und einer damit einhergehenden Abnahme der Entropie im Wasser überkompensiert. D.h. der Lösungsvorgang würde zur einer Abnahme der Gesamt-Entropie führen, was nicht möglich ist. | ||
| + | |||
| + | <span style="color:#4C4C4C;">'''5.a. Der Lösungsvorgang mit Kochsalz beschreibt man in der Formelsprache folgendermassen: NaCl(s) → Na<sup>+</sup>(aq) + Cl<sup>-</sup>(aq). Was bedeutet das Anhängsel „aq“?'''</span> | ||
| + | |||
| + | Die Teilchen liegen in Wasser gelöstem, in hydratisiertem Zustand vor. | ||
| + | |||
| + | <span style="color:#4C4C4C;">'''b. Was stellen Sie sich unter folgender Beschreibung vor: NaCl(aq) ?'''</span> | ||
| + | |||
| + | Dabei handelt es sich um eine Natriumchlorid-Lösung (Natronlauge). Die Na<sup>+</sup>- und die Cl<sup>-</sup>-Ionen sind von Wassermolekülen umgeben, hydratisiert. | ||
| + | |||
| + | == Abkürzung == | ||
| + | RG = Reagenzglas | ||
== Quellen == | == Quellen == | ||
* Unterlagen: GLF Praktikum | * Unterlagen: GLF Praktikum | ||
* 02 Welt_der_Salze_Einfuehrung.pdf | * 02 Welt_der_Salze_Einfuehrung.pdf | ||
| − | * Werner Eisner: Elemente. Klett und Balmer Verlag, Zug, 5. Auflage 2013. | + | * Werner Eisner u.a.: Elemente. Klett und Balmer Verlag, Zug, 5. Auflage 2013. |
| − | * [ | + | * [http://www.wikipedia.org/ www.wikipedia.org] |
== Bildnachweis == | == Bildnachweis == | ||
| − | Abb.1: [http://www.cumschmidt.de/s_styp_nacl.htm] | + | *Abb.1:[http://www.cumschmidt.de/s_styp_nacl.htm] |
| − | Abb.4:[http://www.subolab.de/shop/eisen-iii-chlorid-hexahydrat-reinst-500g.html] | + | *Abb.4:[http://www.subolab.de/shop/eisen-iii-chlorid-hexahydrat-reinst-500g.html] |
| − | Abb.5: [http://www.subolab.de/shop/eisen-iii-oxid-rot-gereinigt-250-g.html] | + | *Abb.5:[http://www.subolab.de/shop/eisen-iii-oxid-rot-gereinigt-250-g.html] |
| − | Abb.6: [ | + | *Abb.6:[http://de.wikipedia.org/wiki/Eisen%28III%29-chlorid] |
| − | Abb.7: [ | + | *Abb.7:[http://de.wikipedia.org/wiki/Eisen%28III%29-oxid] |
| − | Abb.8: [http://www.seilnacht.com/Chemie/ch_agno3.htm] | + | *Abb.8:[http://www.seilnacht.com/Chemie/ch_agno3.htm] |
| − | Abb.9: Schema gemäss Werner Eisner u.a.: Elemente. Klett und Balmer Verlag, Zug, 5. Auflage 2013, S.152, Abb.33. | + | *Abb.9: Schema gemäss Werner Eisner u.a.: Elemente. Klett und Balmer Verlag, Zug, 5. Auflage 2013, S.152, Abb.33. |
| + | |||
| + | ---- | ||
| − | Kay Tobler, | + | Kay Tobler, 29.6.2015 |
Aktuelle Version vom 29. Juni 2015, 19:14 Uhr
Inhaltsverzeichnis
Einleitung
Salze werden auch Ionenverbindungen genannt. Sie sind aus positiv geladenen Metallionen (Kationen) und negativ geladenen Nichtmetallionen (Anionen) aufgebaut. Sie bilden eine regelmässige Gitterstruktur, zu deren Auflösung die Gitterenergie erforderlich ist. Salze begegnen uns in allen Lebensbereichen, z.B. in der Küche zum Würzen von Speisen oder zum Konservieren von Lebensmitteln, auf der Strasse zum Auftauen von Glatteis oder in der Medizin als Riechsalze zur Überwindung von Schwindelanfällen.
Ziele:
- Die wichtigsten Eigenschaften von Salzen kennenlernen und erklären können
- Salze aufgrund dieser Eigenschaften erkennen
Posten A: Zucker oder Salz
Zucker von Salz unterscheiden. Da viele Salze für den Menschen giftig sind, ist von einem Geschmackstest unbedingt abzuraten.
Versuchsaufbau
Glucose (Traubenzucker, C6H12O6) und Kaliumchlorid (KCl) in je einem Becherglas mit 50 ml deionisiertem Wasser auflösen und die Lösung mit einem Leitfähigkeitsmessgeräts auf elektrische Leitfähigkeit überprüfen. Das Leitfähigkeitsmessgerät besteht aus einer Batterie, einem Lämpchen und einem unterbrochenen Stromkreislauf. Wenn man die beiden Metalldrähte (Anode und Kathode) in eine Flüssigkeit taucht, die Strom leitet, schliesst sich der Stromkreis und das Lämpchen leuchtet auf.
Beobachtung
Die KCl(aq)-Lösung bringt die Lampe zum Leuchten, während die Glucose-Lösung keinen elektrischen Strom leitet.
Erklärung
Wenn die Salzkristalle ins Wasser gegeben werden, lagern sich Wassermoleküle mit dem jeweils entgegen gesetzt geladenen Teil an die Kat- und Anionen im Ionengitter an. Dabei wird etwas Energie frei, die Entropie im Salzgitter erhöht sich, die Schwing- und Pendelbewegungen der Ionen erhöhen sich, bis die Bewegungen so stark werden, dass sich einzelne Ionen aus der Gitterstruktur herauslösen und vollständig von Wasserteilchen umgeben werden. Dabei erhöht sich die Entropie erneut (mehr frei bewegliche Teilchen, flüssig statt fest). Da sich bei diesem Lösungsvorgang die Gesamtentropie im System erhöht, läuft der Vorgang weiter, bis sich alle K+- und Cl--Ionen frei beweglich zwischen den Wassermolekülen befinden.
Sobald das Leitfähigkeitsmessgerät eingeschaltet wird, beginnen die K+-Ionen zur Kathode zu wandern, die Cl--Ionen zur Anode. Einmal bei der Kathode angekommen nehmen die K+-Ionen ein Elektron auf und werden zu Kalium-Atomen, die Cl--Ionen geben bei der Anode ein Elektron ab und verbinden sich zu Chlor-Molekülen (Cl2). Die chemischen Bindungen in den Glucosemoleküle werden nicht getrennt; sie bleiben elektrisch neutral. Sie können weder Elektronen abgeben, noch aufnehmen. Fazit: In Wasser gelöste Salze leiten elektrischen Strom.
Posten B: Zwei Eisensalze
Eisen bildet mit Halogenen, Sauerstoff und Sulfaten (SO42-) farbige Salze. In diesem Versuch geht es darum Eisen(III)-chlorid und Eisen(III)-oxid auf ihre Löslichkeit in Wasser zu überprüfen.
Versuchsaufbau
Wenige Kristalle der Salze in je ein zu 1/3 mit deionisiertem Wasser gefülltes RG geben.
Beobachtung
Das deionisierte Wasser mit dem Eisen(III)-chlorid wird nach kurzer Zeit wieder transparent. Das deionisierte Wasser mit dem Eisen(III)-oxid bleibt trüb. Es handelt sich um eine Suspension.
Erklärung
Die Löslichkeit von Salzen hat mit der Gitterenergie EG zu tun. Diese hängt von Ladung und Radius der beteiligten Ionen sowie von der Struktur des Ionengitters ab. Je kleiner der Radius und je höher die Ladung der Ionen eines Salzes desto grösser ist dessen Gitterenergie und desto weniger gut löslich ist es. Man könnte nun meinen, dass sich jedes Salz vollständig in Wasser lösen sollte, da sich dabei ja die Entropie im Salz erhöhen würde (mehr freie Teilchen, flüssig statt fest). Der Haken dabei ist, dass in gewissen Ionengitter die elektrostatischen Anziehungskräfte zwischen den Ionen derart gross sind, dass das umgebende Wasser die zum Lösungsvorgang benötigte (Wärme-)Energie theoretisch zwar zur Verfügung stellen könnte, sich dabei aber so stark abkühlte, dass der Entropiegewinn, der beim Lösungsvorgang des Salzes entstünde, durch den Entropieverlust im Wasser bei weitem kompenisert würde. Insgesamt würde die Entropie absinken, was gemäss dem 2. Hauptsatz der Thermodynamik nicht möglich ist.
Sowohl beim Eisen(III)-chlorid als auch beim Eisen(III)-oxid sind die Eisenionen dreifach positiv geladen. Die Chloridionen sind aber nur einfach negativ, die Oxidionen hingegen doppelt negativ geladen. Zudem ist der Ionenradius des Chloridions grösser als derjenige des Oxidions. Das führt nun dazu, dass Eisen(III)-chlorid in Wasser löslich ist, wohingegen Eisen(III)-oxid nahezu unlöslich ist. Die elektrostatischen Anziehungskräfte zwischen den 3-fach positiv geladenen Fe3+-Ionen und den doppelt negativ geladenen O2- ist so gross, dass sich bei einem Lösungsvorgang die Entropie im Gesamtsystem absenken würde, was wie oben gesehen, nicht möglich ist.
Fragen
1.a. Eisenoxide sind die wertvollen Bestandteile von Eisenerzen. Falls Sie das schon vor dem Experiment wussten, dann konnten Sie vermutlich die Löslichkeit des einen Salzes voraussagen. Was wäre Ihre Vermutung gewesen?
Ich hätte vermutet, dass Eisen(III)-oxid unlöslich ist. Wäre Eisenoxid wasserlöslich, wäre es aus dem Gestein herausgewaschen worden und es gäbe keine Eisenerze.
b. Was wissen Sie bereits über Eisenerz?
Eisenerz wird im Berg- oder Tagbau abgebaut und zwecks Eisengewinnung verhüttet. Eisen wird mithilfe von Koks im Hochofen aus Eisenerz gewonnen.
Posten C: Chloridionen entdecken
Mithilfe von Silbernitrat können Chloridionen nachgewiesen werden. Ein Schüler hat einige Spritzflaschen mit Leitungswasser anstatt mit deionisiertem Wasser aufgefüllt. Welche Spritzflasche enthält Leitungswasser und folglich auch Chloridionen?
Versuchsaufbau
Man fülle zwei RGs zur Hälfte, eines mit Wasser aus Spritzflasche A, eines mit Wasser aus Spritzflasche B. Dann gibt man je drei Tropfen Silbernitrat-Lösung bei.
Beobachtung
RG mit Wasser von A = Wasser bleibt klar.
RG mit Wasser von B = Wasser wir mit einer weissen Substanz eingetrübt.
Erklärung
Silbernitrat löst sich sehr gut in Wasser auf. Im Wasser gelöste Silber- und Chloridionen ziehen sich so stark an, dass sie sich zu einem Ionengitter verbinden und als Salzkristalle ausgefällt werden.
Reaktionsgleichungen: Na+ (aq) + Cl- (aq) + Ag+ (aq) + NO3- (aq) → AgCl (s) + Na+ (aq) + NO- (aq)
oder kompakter: NaCl (aq) + AgNO3 (aq) → AgCl (s) + NaNO3 (aq)
Posten D: Lösen von Salzen in Wasser
Wir lösen verschiedene Salze in Wasser und messen im Anschluss daran die Wassertemperatur
Salze: Lithiumchlorid (LiCl), Natriumchlorid (NaCl), Kaliumchlorid (KCl), Calciumchlorid (CaCl2) und Ammoniumchlorid (NH4Cl)
Versuchsaufbau
RGs zu einem Drittel mit deionisiertem Wasser füllen, einen halben Löffel eines Salzes zugeben, mit Stopfen das RG schliessen, dreimal kräftig schütteln, Stopfen entfernen und sofort die Temperatur mit dem Thermometer messen.
Beobachtung
Wassertemperatur in der Spritzflasche: 20°C
| Salznamen (Verhältnisformel) | Kation/ Anion | Temp. in der Salzlösung | Temp. Differenz | Erklärung |
|---|---|---|---|---|
| Lithiumchlorid (LiCl) | Li+ Cl- | 24°C | 4°C | EH > EG exotherm |
| Natriumchlorid (NaCl) | Na+ Cl- | 20°C | 0°C | EH ≈ EG |
| Kaliumchlorid (KCl) | K+ Cl- | 15°C | -5°C | EH < EG endotherm |
| Calciumchlorid (CaCl2) | Ca2+ Cl- | 26°C | 6°C | EH > EG exotherm |
| Ammoniumchlorid (NH4Cl) | Na4+ Cl- | 18°C | -2°C | EH < EG endotherm |
Erklärung
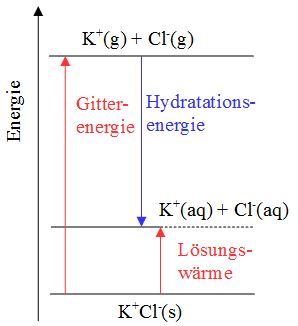
Wenn ein Salzkristall ins Wasser gegeben wird, docken Wassermoleküle an ihn an. Da Wassermoleküle Dipole sind, können sie sich sowohl bei den Kationen als auch bei den Anionen anlagern. Durch dieses Anlagern wird etwas Energie frei, was die Entropie und die Pendelbewegung der Ionen im Ionengitter erhöht; allmählich beginnen sich die Ionen an den Ecken und Rändern aus dem Ionengitter herauszulösen. Einmal herausgelöst werden sie von Wassermolekülen umgeben. Dieser Vorgang nennt sich Hydratation, bei dem die Hydratationsenergie EH frei wird. Die Entropie hat sich ein zweites Mal erhöht. Ist nun bei einem Salz die Hydratationsenergie grösser als die für den Lösungsvorgang hinderliche Gitterenergie EG verläuft der Lösungsvorgang exotherm, die Umgebungstemperatur erhöht sich (s. Abb. 9a). Im umgekehrten Fall wird dem Wasser Wärmeenergie entzogen, damit die Gitterenergie doch noch überwunden werden kann. Der Lösungsvorgang verläuft endotherm (s. Abb. 9b). Für die Temperaturänderung massgebend ist auch die Menge des Salzes, das man zugibt. Bei grösseren Salzmengen wird die Temperaturänderung vergrössert.
Fragen
1.a. Ein Salzkristall wird ins Wasser gegeben. Die Salzteilchen und die Wassermoleküle treten miteinander in Wechselwirkung. Worauf beruht diese Wechselwirkung?
Wassermoleküle sind Dipole. Sie richten sich mit ihrem positiv geladenen Teil zu den Anionen, mit dem negativ geladenen Teil zu den Kationen aus. Sie treten mit den Ionen im Salzgitter in eine elektrostatische Wechselwirkung.
b. Wie liegt das gelöste Salz vor?
Die Ionen sind umgeben von Wassermolekülen, sie sind hydratisiert. Die Kationen werden von Wassermolekülen umgeben, die ihnen ihren negativ geladen Pol zuwenden. Die Anionen werden von Wassermolekülen umgeben, die ihnen den positiv geladenen Pol zuwenden.
2. Bei der Wechselwirkung wird Energie frei: die Hydratationsenergie EH. Diese fördert den Lösungsvorgang. Es gibt jedoch eine zweite Kraft, welche dem Lösungsvorgang entgegenwirkt. Um was handelt es sich?
Es handelt sich um die elektrostatische Anziehungskraft zwischen den Ionen in der Gitterstruktur. Um all diese Anziehungskräfte im Ionengitter zu überwinden, wird die Gitterenergie EG benötigt.
3. Es gibt Salze, bei denen wird beim Lösen Wärme frei (exothermer Lösungsvorgang). Andere lösen sich unter starker Abkühlung (endothermer Lösungsvorgang). Wie schätzen Sie für diese beiden Fälle die förderliche und die hinderliche Energie ein?
Beim exothermen Lösungsvorgang ist die zum Lösen förderliche Hydratationsenergie EH grösser als die zum Lösen hinderliche Gitterenergie EG. Beim endothermen Lösungsvorgang ist es gerade umgekehrt.
4. Welche Verhältnisse herrschen bei schwerlöslichen Salzen?
Bei schwerlöslichen Salzen ist die Hydratationsenergie vernachlässigbar klein im Vergleich zur Gitterenergie, es gilt: EG >> EH. Die Zunahme der Entropie, die entstünde, wenn sich ein schwerlösliches Salz in Wasser löste, würde durch die Zunahme der Ordnung (Bewegungen der Wassermoleküle werden langsamer) und einer damit einhergehenden Abnahme der Entropie im Wasser überkompensiert. D.h. der Lösungsvorgang würde zur einer Abnahme der Gesamt-Entropie führen, was nicht möglich ist.
5.a. Der Lösungsvorgang mit Kochsalz beschreibt man in der Formelsprache folgendermassen: NaCl(s) → Na+(aq) + Cl-(aq). Was bedeutet das Anhängsel „aq“?
Die Teilchen liegen in Wasser gelöstem, in hydratisiertem Zustand vor.
b. Was stellen Sie sich unter folgender Beschreibung vor: NaCl(aq) ?
Dabei handelt es sich um eine Natriumchlorid-Lösung (Natronlauge). Die Na+- und die Cl--Ionen sind von Wassermolekülen umgeben, hydratisiert.
Abkürzung
RG = Reagenzglas
Quellen
- Unterlagen: GLF Praktikum
- 02 Welt_der_Salze_Einfuehrung.pdf
- Werner Eisner u.a.: Elemente. Klett und Balmer Verlag, Zug, 5. Auflage 2013.
- www.wikipedia.org
Bildnachweis
- Abb.1:[1]
- Abb.4:[2]
- Abb.5:[3]
- Abb.6:[4]
- Abb.7:[5]
- Abb.8:[6]
- Abb.9: Schema gemäss Werner Eisner u.a.: Elemente. Klett und Balmer Verlag, Zug, 5. Auflage 2013, S.152, Abb.33.
Kay Tobler, 29.6.2015