Das Prinzip des Energieminimums: Unterschied zwischen den Versionen
K (→Grundsätzliches) |
(→Zufällige Teilchenbewegung) |
||
| (5 dazwischenliegende Versionen von 2 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
| − | + | Der Einfluss der Enthalpie ΔH | |
| − | == | + | == Wann spricht man von Reaktionsenthalpie? == |
| − | + | Der Begriff Enthalpie wird dann verwendet, wenn die Reaktion isobar und isotherm verläuft, also wenn der Druck und die Temperatur konstant bleiben. Der Druck und die Temperatur sind somit vor und nach der Reaktion gleich gross. | |
| − | Aufgrund dieser | + | Da freiwillige Reaktionen auch ohne Energie- oder Stoffzufuhr ablaufen, sieht man unter isobaren und isothermen Bedingungen gut, ob eine Reaktion freiwillig abläuft. |
| + | Die Enthalpie allein entscheidet nicht, ob die Reaktion freiwillig verläuft oder nicht. Entscheidend ist ein Zusammenspiel der Enthalpie (ΔH) und der Entropie (ΔS) in Abhängigkeit von der Temperatur, welche dann besagt, ob die Gibbs-Energie grösser oder kleiner als null ist. Wenn die Gibbs-Energie (ΔG) kleiner als null ist, verläuft die Reaktion freiwillig. Wenn sie grösser als null ist, verläuft die Reaktion nicht freiwillig. | ||
| + | |||
| + | |||
| + | == Welche Reaktionen sind freiwillig? == | ||
| + | Eine freiwillige Reaktion hat einen isobaren und isothermen Reaktionsverlauf und es findet '''kein''' Energie- oder Stoffaustausch mit der Umgebung statt. | ||
| + | |||
| + | [[Bild:Chemiewiki 1.png]] | ||
| + | |||
| + | In einem offenen System findet ein Stoff- oder Energieaustausch mit der Umgebung statt, bei einem abgeschlossenen System jedoch nicht. | ||
| + | |||
| + | Neben freiwilligen Reaktionen gibt es auch unfreiwillige Reaktionen, bei denen die Edukte ohne ständige Energie- und Stoffzufuhr nicht zu den Produkten reagieren. | ||
| + | |||
| + | |||
| + | == Vergleich: Kräfte bewirken eine Umwandlung == | ||
| + | Steine rollen stets nach unten, da die potenzielle Energie (E<sub>pot</sub>) durch die Gravitationskraft in kinetische Energie (E<sub>kin</sub>) umgewandelt wird, sodass ein Zustand minimaler Energie erreicht wird. | ||
| + | Dieses Konzept kann wie folgt auf chemische Reaktionen angewendet werden: | ||
| + | |||
| + | |||
| + | === Exotherme Reaktion === | ||
| + | Wenn energiereiche Stoffe freiwillig zu energiearmen Stoffen reagieren, wird Energie beispielsweise in Form von Wärme frei. Es handelt sich dabei um exotherme Reaktionen. | ||
| + | |||
| + | ΔH<0 | ||
| + | |||
| + | ΔH wird wie folgt berechnet: ΔH = EG<sub>p</sub> - EG<sub>ed</sub> | ||
| + | |||
| + | [[Bild:Chemiewiki_2.png|300px|]] | ||
| + | |||
| + | === Endotherme Reaktion === | ||
| + | Wenn Energie aufgewendet oder von der Umgebung hinzugefügt werden muss, damit energetisch tieferliegende Edukte zu energiereicheren Stoffen reagieren, kühlt sich die Umgebungstemperatur ab. | ||
| + | Es handelt sich dabei um eine endotherme Reaktion. | ||
| + | |||
| + | ΔH>0 | ||
| + | |||
| + | ΔH wird wie folgt berechnet: ΔH = EG<sub>p</sub> - EG<sub>ed</sub> | ||
| + | |||
| + | [[Bild:Chemiewiki_3.png|300px|]] | ||
| + | |||
| + | |||
| + | == Warum wird es immer warm bei exothermen Reaktionen? == | ||
| + | Exotherme Reaktionen in Lebewesen verursachen im Vergleich zu Umgebung erhöhte Körpertemperatur, da ständig Edukte in Produkte umgewandelt werden. Ein Beispiel dafür ist die Muskelkontraktion, bei welcher aus ATP, ADP und Phosphat entsteht. Die Erhöhung der Körpertemperatur geschieht, da die Energie der Produkte geringer ist als die der Edukte. Ein anderes Beispiel sind Gärvorgänge, bei denen Wärme an die Umgebung abgegeben wird. Aufgrund dieser Beispiele kann man vermuten, dass die Reaktionsenthalpie ΔH entscheidend ist für die Freiwilligkeit chemischer Reaktionen. Und genau das hat Marcellin Berthelot 1878 formuliert und es entstand das «Prinzip von Berthelot». | ||
| + | |||
| + | |||
| + | == Prinzip von Berthelot == | ||
| + | Marcellin Berthelot formulierte das Prinzip von Berthelot: | ||
| + | Jede chemische Reaktion, die in einem abgeschlossenen System, also ohne Einflüsse von äusserer Energie abläuft, will das Produkt oder den Körper bilden, welches am meisten Wärme freisetzt. | ||
| + | |||
| + | Freiwillige Reaktionen sind exotherm und die Temperatur steigt. | ||
| + | |||
| + | Unfreiwillige Reaktionen sind endotherm und die Temperatur sinkt. | ||
| + | |||
| + | |||
| + | === Überprüfung der Hypothese === | ||
| + | Falsifizierung: Aber es gibt auch freiwillige endotherme Reaktionen? | ||
| + | |||
| + | |||
| + | 1. Verdunsten von H<sub>2</sub>O<sub>(l)</sub> zu H<sub>2</sub>O<sub>(g)</sub> → ΔH>0, freiwillig | ||
| + | |||
| + | Temperatur sinkt schnell und stark | ||
| + | |||
| + | Somit ist Verdunsten von H<sub>2</sub>O eine freiwillige '''und''' endotherme Reaktion. | ||
| + | |||
| + | |||
| + | 2. Bariumhydroxid: Ba(OH)<sub>2</sub> und Ammoniumthiocyanat: NH<sub>4</sub>SCN | ||
| + | |||
| + | Werden diese zwei Salze zusammengeschüttet, sinkt die Temperatur → ΔH>0, freiwillig | ||
| + | |||
| + | Somit ist es eine freiwillige '''und''' endotherme Reaktion. | ||
| + | |||
| + | |||
| + | == Zufällige Teilchenbewegung == | ||
| + | Die zufällige Teilchenbewegung spielt eine wichtige Rolle für den freiwilligen Verlauf chemischer Reaktionen. Ionen zittern, stossen zufällig zusammen und durch starke Stösse entfernen sie sich voneinander und aus dem Gitter hinaus. Dies zeigt sich gut am Beispiel eines endothermen Lösevorgangs eines Salzes wie z.B. Ammoniumchlorid in Wasser. | ||
| + | Ionen werden getrennt und von Wasser-Molekülen umgeben. Ist die Hydrationsenthalpie kleiner als die Gitterenergie, ist der Lösevorgang endotherm. Das Stoffsystem geht somit von einem energieärmeren in einen energiereicheren Zustand über und dies geschieht freiwillig. | ||
| + | |||
| + | Wenn ein Ion mit einem anderen Ion zusammenstosst und nach einem starken Stoss nochmals stark getroffen wird, gibt es zwei Möglichkeiten: | ||
| + | |||
| + | 1. Entweder das Ion wird so getroffen, dass es wieder zurück auf seinen Platz gestossen wird und durch die Anziehungskräfte gehört es dann auch wieder zum Gitter | ||
| + | |||
| + | oder | ||
| + | |||
| + | 2. Das Ion wird durch einen zusätzlichen Stoss weiter vom Gitter weggestossen und von Wasser-Molekülen umgeben und somit hydratisiert. Durch die Hydration werden die Anziehungskräfte zwischen dem Ionengitter und dem Ion geschwächt und das Ion entfernt sich noch weiter. | ||
| + | |||
| + | Es gibt viel mehr Möglichkeiten, dass Teilchen weiter weggestossen werden, als dass sie wieder zurück ins Gitter gespickt werden. | ||
| + | |||
| + | Fazit: Es geschieht das, was wahrscheinlich ist. | ||
| + | |||
| + | Mit der Anziehung zwischen den Teilchen und der Wahrscheinlichkeit kommen wir nun zum nächsten Thema und somit zur Entropie ΔS. | ||
| + | |||
| + | Hier gehts zu [[Die Entropie ΔS]]. | ||
| + | |||
| + | == Exkurs kinetisches und thermodynamisches Produkt == | ||
| + | Kinetisches Produkt: | ||
| + | |||
| + | - Niedrigere Aktivierungsenergie, verläuft deshalb schneller aber ist instabiler im Vergleich zum thermodynamischen Produkt. | ||
| + | |||
| + | [[Bild:Chemiewiki_4.png|300px|]] | ||
| + | |||
| + | Thermodynamisches Produkt: | ||
| + | |||
| + | - Stabiler, E<sub>A</sub> kann höher/grösser sein als beim kinetischen Produkt. Deshalb muss mehr Energie hinzugefügt werden, um das thermodynamische Produkt zu erhalten. | ||
| + | |||
| + | [[Bild:Chemiewiki.5.png|300px|]] | ||
| + | |||
| + | Bei niedrigen Temperaturen wird Aktivierungsenergie (E<sub>A</sub>) nur so gross, dass ein kinetisches Produkt entsteht. Bei höheren Temperaturen kann eine höhere Aktivierungsenergie erreicht werden und somit kann auch ein stabiles, thermodynamisches Produkt entstehen. | ||
| − | |||
| − | |||
| − | |||
| − | |||
== Quellen == | == Quellen == | ||
* Chemieunterlagen | * Chemieunterlagen | ||
| − | * Chemiebuch " | + | * Chemiebuch "Chemie für das Gymnasium - Günter Baars und Roger Deuber" |
| − | |||
| − | |||
[[Kategorie:Chemie]] | [[Kategorie:Chemie]] | ||
Aktuelle Version vom 25. Mai 2024, 21:18 Uhr
Der Einfluss der Enthalpie ΔH
Inhaltsverzeichnis
Wann spricht man von Reaktionsenthalpie?
Der Begriff Enthalpie wird dann verwendet, wenn die Reaktion isobar und isotherm verläuft, also wenn der Druck und die Temperatur konstant bleiben. Der Druck und die Temperatur sind somit vor und nach der Reaktion gleich gross. Da freiwillige Reaktionen auch ohne Energie- oder Stoffzufuhr ablaufen, sieht man unter isobaren und isothermen Bedingungen gut, ob eine Reaktion freiwillig abläuft. Die Enthalpie allein entscheidet nicht, ob die Reaktion freiwillig verläuft oder nicht. Entscheidend ist ein Zusammenspiel der Enthalpie (ΔH) und der Entropie (ΔS) in Abhängigkeit von der Temperatur, welche dann besagt, ob die Gibbs-Energie grösser oder kleiner als null ist. Wenn die Gibbs-Energie (ΔG) kleiner als null ist, verläuft die Reaktion freiwillig. Wenn sie grösser als null ist, verläuft die Reaktion nicht freiwillig.
Welche Reaktionen sind freiwillig?
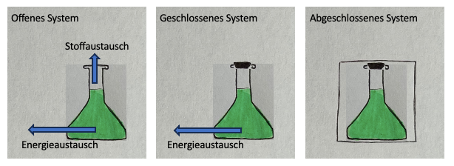
Eine freiwillige Reaktion hat einen isobaren und isothermen Reaktionsverlauf und es findet kein Energie- oder Stoffaustausch mit der Umgebung statt.
In einem offenen System findet ein Stoff- oder Energieaustausch mit der Umgebung statt, bei einem abgeschlossenen System jedoch nicht.
Neben freiwilligen Reaktionen gibt es auch unfreiwillige Reaktionen, bei denen die Edukte ohne ständige Energie- und Stoffzufuhr nicht zu den Produkten reagieren.
Vergleich: Kräfte bewirken eine Umwandlung
Steine rollen stets nach unten, da die potenzielle Energie (Epot) durch die Gravitationskraft in kinetische Energie (Ekin) umgewandelt wird, sodass ein Zustand minimaler Energie erreicht wird. Dieses Konzept kann wie folgt auf chemische Reaktionen angewendet werden:
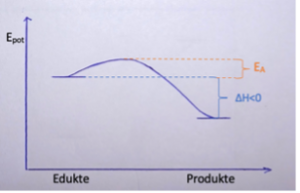
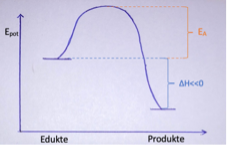
Exotherme Reaktion
Wenn energiereiche Stoffe freiwillig zu energiearmen Stoffen reagieren, wird Energie beispielsweise in Form von Wärme frei. Es handelt sich dabei um exotherme Reaktionen.
ΔH<0
ΔH wird wie folgt berechnet: ΔH = EGp - EGed
Endotherme Reaktion
Wenn Energie aufgewendet oder von der Umgebung hinzugefügt werden muss, damit energetisch tieferliegende Edukte zu energiereicheren Stoffen reagieren, kühlt sich die Umgebungstemperatur ab. Es handelt sich dabei um eine endotherme Reaktion.
ΔH>0
ΔH wird wie folgt berechnet: ΔH = EGp - EGed
Warum wird es immer warm bei exothermen Reaktionen?
Exotherme Reaktionen in Lebewesen verursachen im Vergleich zu Umgebung erhöhte Körpertemperatur, da ständig Edukte in Produkte umgewandelt werden. Ein Beispiel dafür ist die Muskelkontraktion, bei welcher aus ATP, ADP und Phosphat entsteht. Die Erhöhung der Körpertemperatur geschieht, da die Energie der Produkte geringer ist als die der Edukte. Ein anderes Beispiel sind Gärvorgänge, bei denen Wärme an die Umgebung abgegeben wird. Aufgrund dieser Beispiele kann man vermuten, dass die Reaktionsenthalpie ΔH entscheidend ist für die Freiwilligkeit chemischer Reaktionen. Und genau das hat Marcellin Berthelot 1878 formuliert und es entstand das «Prinzip von Berthelot».
Prinzip von Berthelot
Marcellin Berthelot formulierte das Prinzip von Berthelot: Jede chemische Reaktion, die in einem abgeschlossenen System, also ohne Einflüsse von äusserer Energie abläuft, will das Produkt oder den Körper bilden, welches am meisten Wärme freisetzt.
Freiwillige Reaktionen sind exotherm und die Temperatur steigt.
Unfreiwillige Reaktionen sind endotherm und die Temperatur sinkt.
Überprüfung der Hypothese
Falsifizierung: Aber es gibt auch freiwillige endotherme Reaktionen?
1. Verdunsten von H2O(l) zu H2O(g) → ΔH>0, freiwillig
Temperatur sinkt schnell und stark
Somit ist Verdunsten von H2O eine freiwillige und endotherme Reaktion.
2. Bariumhydroxid: Ba(OH)2 und Ammoniumthiocyanat: NH4SCN
Werden diese zwei Salze zusammengeschüttet, sinkt die Temperatur → ΔH>0, freiwillig
Somit ist es eine freiwillige und endotherme Reaktion.
Zufällige Teilchenbewegung
Die zufällige Teilchenbewegung spielt eine wichtige Rolle für den freiwilligen Verlauf chemischer Reaktionen. Ionen zittern, stossen zufällig zusammen und durch starke Stösse entfernen sie sich voneinander und aus dem Gitter hinaus. Dies zeigt sich gut am Beispiel eines endothermen Lösevorgangs eines Salzes wie z.B. Ammoniumchlorid in Wasser. Ionen werden getrennt und von Wasser-Molekülen umgeben. Ist die Hydrationsenthalpie kleiner als die Gitterenergie, ist der Lösevorgang endotherm. Das Stoffsystem geht somit von einem energieärmeren in einen energiereicheren Zustand über und dies geschieht freiwillig.
Wenn ein Ion mit einem anderen Ion zusammenstosst und nach einem starken Stoss nochmals stark getroffen wird, gibt es zwei Möglichkeiten:
1. Entweder das Ion wird so getroffen, dass es wieder zurück auf seinen Platz gestossen wird und durch die Anziehungskräfte gehört es dann auch wieder zum Gitter
oder
2. Das Ion wird durch einen zusätzlichen Stoss weiter vom Gitter weggestossen und von Wasser-Molekülen umgeben und somit hydratisiert. Durch die Hydration werden die Anziehungskräfte zwischen dem Ionengitter und dem Ion geschwächt und das Ion entfernt sich noch weiter.
Es gibt viel mehr Möglichkeiten, dass Teilchen weiter weggestossen werden, als dass sie wieder zurück ins Gitter gespickt werden.
Fazit: Es geschieht das, was wahrscheinlich ist.
Mit der Anziehung zwischen den Teilchen und der Wahrscheinlichkeit kommen wir nun zum nächsten Thema und somit zur Entropie ΔS.
Hier gehts zu Die Entropie ΔS.
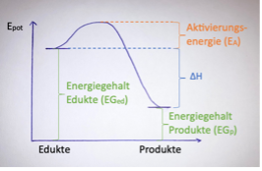
Exkurs kinetisches und thermodynamisches Produkt
Kinetisches Produkt:
- Niedrigere Aktivierungsenergie, verläuft deshalb schneller aber ist instabiler im Vergleich zum thermodynamischen Produkt.
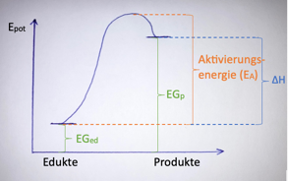
Thermodynamisches Produkt:
- Stabiler, EA kann höher/grösser sein als beim kinetischen Produkt. Deshalb muss mehr Energie hinzugefügt werden, um das thermodynamische Produkt zu erhalten.
Bei niedrigen Temperaturen wird Aktivierungsenergie (EA) nur so gross, dass ein kinetisches Produkt entsteht. Bei höheren Temperaturen kann eine höhere Aktivierungsenergie erreicht werden und somit kann auch ein stabiles, thermodynamisches Produkt entstehen.
Quellen
- Chemieunterlagen
- Chemiebuch "Chemie für das Gymnasium - Günter Baars und Roger Deuber"