Wichtige Hauptgruppen: Unterschied zwischen den Versionen
| (5 dazwischenliegende Versionen von 2 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
[[image:NUR HAUPTGRUPPE.gif|right]] | [[image:NUR HAUPTGRUPPE.gif|right]] | ||
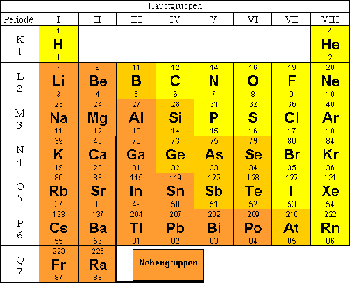
| − | + | Die 8 Hauptgruppen sind diejenigen Gruppen des Periodensystems, welche zum s- und p- Block des Periodensystems gehören. | |
| + | Das Periodensystem wurde so angeordnet, dass Elemente mit ähnlichen Eigenschaften jeweils in einer Gruppe untereinander stehen. Bei den Hauptgruppen ist das ausgeprägter als bei den Nebengruppen. | ||
__TOC__ | __TOC__ | ||
| Zeile 52: | Zeile 53: | ||
- molekulare Stoffe | - molekulare Stoffe | ||
| − | - | + | - Bor ist ein Halbmetall, alle anderen sind Metalle, d.h. Elektronenopfer |
| + | |||
== 4. Hauptgruppe == | == 4. Hauptgruppe == | ||
| Zeile 64: | Zeile 66: | ||
- molekulare Stoffe | - molekulare Stoffe | ||
| + | |||
== 5. Hauptgruppe == | == 5. Hauptgruppe == | ||
| Zeile 75: | Zeile 78: | ||
- molekulare Stoffe | - molekulare Stoffe | ||
| + | |||
== 6. Hauptgruppe == | == 6. Hauptgruppe == | ||
| Zeile 86: | Zeile 90: | ||
- molekulare Stoffe | - molekulare Stoffe | ||
| + | |||
== 7. Hauptgruppe: Halogene == | == 7. Hauptgruppe: Halogene == | ||
| Zeile 104: | Zeile 109: | ||
==== Giftigkeit ==== | ==== Giftigkeit ==== | ||
Die Stoffe dieser Gruppe sind giftig. Sie sind Elektronendiebe. Sie „stehlen“ die Elektronen nicht nur von anderen freien Atomen, sondern auch von den Zellen im Körper. Die Oberflächen der Zellen bestehen grösstenteils aus Proteinen, Fetten und Glucose, also Kohlenhydraten (organisches Material hat eine Kohlenstoffoberfläche). Dieses organische Material ist elektronenreich. | Die Stoffe dieser Gruppe sind giftig. Sie sind Elektronendiebe. Sie „stehlen“ die Elektronen nicht nur von anderen freien Atomen, sondern auch von den Zellen im Körper. Die Oberflächen der Zellen bestehen grösstenteils aus Proteinen, Fetten und Glucose, also Kohlenhydraten (organisches Material hat eine Kohlenstoffoberfläche). Dieses organische Material ist elektronenreich. | ||
| + | |||
== 8. Hauptgruppe: Edelgase == | == 8. Hauptgruppe: Edelgase == | ||
| Zeile 110: | Zeile 116: | ||
[[image:8 edelgase.jpg|right]] | [[image:8 edelgase.jpg|right]] | ||
| − | - | + | - Sie gehören zu den Nichtmetallen, obwohl sie schon eine volle Valenzschale haben, und deshalb auch keine Elektronen stehlen können. (Sie können keine Opfer sein, weil sie am meisten Protonen innerhalb der Periode haben und deshalb die Valenzelektronen am stärksten anziehen) |
- geringe Reaktivität | - geringe Reaktivität | ||
| − | - Da die Valenzschalen schon voll sind, | + | - Da die Valenzschalen schon voll sind, reagieren diese Elemente mit anderen Elementen nicht oder nur sehr gering. |
| Zeile 140: | Zeile 146: | ||
== Quellen == | == Quellen == | ||
* Chemieunterlagen | * Chemieunterlagen | ||
| − | + | * [http://www.chemische-experimente.com Chemische Experimente] - Hauptgruppen | |
== Weblinks == | == Weblinks == | ||
* [http://swisseduc.ch/chemie/ Swisseduc] – Unterrichtsserver für Chemie | * [http://swisseduc.ch/chemie/ Swisseduc] – Unterrichtsserver für Chemie | ||
Aktuelle Version vom 16. März 2020, 17:11 Uhr
Die 8 Hauptgruppen sind diejenigen Gruppen des Periodensystems, welche zum s- und p- Block des Periodensystems gehören. Das Periodensystem wurde so angeordnet, dass Elemente mit ähnlichen Eigenschaften jeweils in einer Gruppe untereinander stehen. Bei den Hauptgruppen ist das ausgeprägter als bei den Nebengruppen.
Inhaltsverzeichnis
1. Hauptgruppe: Alkalimetalle
Eigenschaften
- 1 Valenzelektron -> Opfer
- salzartig
- weiche Metalle
- reaktionsfreudigste Gruppe
- niedrige Schmelz- und Siedepunkte
- niedrige Dichte
2. Hauptgruppe: Erdalkalimetalle
Eigenschaften
- 2 Valenzelektronen -> Opfer
- salzartig
- kommen in der Erde bzw. im Gestein vor (-> weniger löslich)
- 2-mal geladene Ionen können sich wegen stärkeren Anziehungskräften im Gitter weniger gut voneinander trennen.
- Wenn die Alkali- und Erdalkalimetalle mit Wasser reagieren, entsteht Wasserstoff, der sich entzünden bzw. explodieren kann.
Beispiele
Magnesium + Wasser + Phenolohthylain -> reagiert nicht so stark
Calcium+ Wasser + Phenolohthylain -> sprudelt wie eine Brausetablette
3. Hauptgruppe
Diese Gruppe hat keinen eigenen Namen, denn die Elemente haben nur wenige ähnliche Eigenschaften. Sie wird auch Bor-Familie genannt.
Eigenschaften
- 3 Valenzelektronen
- molekulare Stoffe
- Bor ist ein Halbmetall, alle anderen sind Metalle, d.h. Elektronenopfer
4. Hauptgruppe
Diese Hauptgruppe hat auch keinen Namen, jedoch hört man auch die Bezeichnung ‚Kohlenstoff-Familie‘.
Eigenschaften
- 4 Valenzelektronen
- molekulare Stoffe
5. Hauptgruppe
Diese Gruppe hat keinen Namen, sie wird aber manchmal als Stickstoff-Familie bezeichnet.
Eigenschaften
- 5 Valenzelektronen
- molekulare Stoffe
6. Hauptgruppe
Diese Gruppe hat auch keinen Name, sie werden aber auch Sauerstoff- Familie oder Chalkogene genannt.
Eigenschaften
- 6 Valenzelektronen
- molekulare Stoffe
7. Hauptgruppe: Halogene
Eigenschaften
- 7 Valenzelzktronen -> Diebe
- Die Reaktionsfähigkeit sinkt von oben nach unten in der Gruppe.
- Wegen ihrer grossen Reaktionsfähigkeit kommen sie in der Natur nicht elementar, sondern nur in Verbindungen vor.
- Sie sind giftig.
- molekulare Stoffe
Giftigkeit
Die Stoffe dieser Gruppe sind giftig. Sie sind Elektronendiebe. Sie „stehlen“ die Elektronen nicht nur von anderen freien Atomen, sondern auch von den Zellen im Körper. Die Oberflächen der Zellen bestehen grösstenteils aus Proteinen, Fetten und Glucose, also Kohlenhydraten (organisches Material hat eine Kohlenstoffoberfläche). Dieses organische Material ist elektronenreich.
8. Hauptgruppe: Edelgase
Eigenschaften
- Sie gehören zu den Nichtmetallen, obwohl sie schon eine volle Valenzschale haben, und deshalb auch keine Elektronen stehlen können. (Sie können keine Opfer sein, weil sie am meisten Protonen innerhalb der Periode haben und deshalb die Valenzelektronen am stärksten anziehen)
- geringe Reaktivität
- Da die Valenzschalen schon voll sind, reagieren diese Elemente mit anderen Elementen nicht oder nur sehr gering.
Bezeichnungen
- Helium: Helios = Sonne
- Neon: neu (Edelgase wurden erst spät entdeckt)
- Argon: faul, träge
- Krypton: versteckt
- Xenon: fremd
Ausnahme Wasserstoff: H
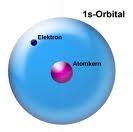
Das Nichtmetall nimmt eine Sonderstellung im Periodensystem ein, da es nur über ein einziges Atomorbital verfügt, das mit einem Elektron besetzt ist. Es könnte auch in die 7. Hauptgruppe eingeordnet werden, da es durch Aufnahme eines Elektrons eine Edelgaskonfiguration erreichen kann.
Eigenschaften
- sehr gut in Metallen löslich
- wichtig in Säure-Base-Reaktionen
Quellen
- Chemieunterlagen
- Chemische Experimente - Hauptgruppen
Weblinks
- Swisseduc – Unterrichtsserver für Chemie