Bausteine der Atome: Unterschied zwischen den Versionen
| (59 dazwischenliegende Versionen von 4 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
Schon vor mehr als 2000 Jahren sprach man von Atomen. Demokrit, einer der grössten Gelehrten im Alten Griechenland, nahm an, alle Materie bestehe aus kleinsten, nicht mehr teilbaren Teilchen, die er "Atome" nannte. Er kam damit der Wahrheit erstaunlich nahe. In Wirklichkeit lässt sich ein Atom noch in Protonen, Elektronen und Neutronen unterteilen, diese Teilchen (auch Elementarteilchen gennant) sind nicht mehr teilbar. | Schon vor mehr als 2000 Jahren sprach man von Atomen. Demokrit, einer der grössten Gelehrten im Alten Griechenland, nahm an, alle Materie bestehe aus kleinsten, nicht mehr teilbaren Teilchen, die er "Atome" nannte. Er kam damit der Wahrheit erstaunlich nahe. In Wirklichkeit lässt sich ein Atom noch in Protonen, Elektronen und Neutronen unterteilen, diese Teilchen (auch Elementarteilchen gennant) sind nicht mehr teilbar. | ||
| + | |||
| + | == Elektrizität == | ||
| + | |||
| + | === Coulombgesetz === | ||
| + | |||
| + | Aus dem Unterricht ist das Experiment mit dem Holundermarkkügelchen bekannt. Ist der Kunststoffstaab durch das Reiben mit dem Seidetuch negativ geladen (hat also eine Überzahl von Elektronen) und wird nahe an das Kügelchen gehalten, so passiert zunächst nichts. Berührt der Staab danach das Kügelchen, so gehen Elektronen vom Staab auf das Kügelchen über und sie stossen sich ab (Kügelchen ist nun ebenfalls negativ geladen, weil es Elektronen aufgenommen hat). Wird dann der durch das Reiben mit dem Seidetuch positiv geladene Plastikstaab nahe an das Holundermarkkügelchen gehalten, ziehen sich Kügelchen und Staab an. Dies ist der Beweis dafür, dass sich zwei unterschiedliche Ladungen anziehen und zwei gleiche Ladungen sich abstossen. | ||
| + | |||
| + | Somit gibt es je zwei Möglichkeiten zur Abstossungs- und Anziehungskraft: | ||
| + | |||
| + | |||
| + | * + | | + --> Beide Ladungen positiv, Kräfte stossen sich ab. | ||
| + | * - | | - --> Beide Ladungen negativ, Kräfte stossen sich ab. | ||
| + | * + | | - --> Ladungen unterschiedlich, Kräfte ziehen sich an. | ||
| + | * - | | + --> Ladungen unterschiedlich, Kräfte ziehen sich an. | ||
| + | |||
| + | |||
| + | Doch nicht nur die Ladungen sind entscheidend für die Anziehugs- und Abstossungskräfte. Eine genau so grosse Rolle spielt der Abstand zwischen den Ladungen. Je weiter auseinander die Ladungen sind, desto geringer auch die Anziehungs- bzw. Abstossungskräfte. | ||
| + | |||
| + | Um die Kräfte zu berechnen, braucht man die Coulombformel: | ||
| + | |||
| + | |||
| + | |||
| + | Q1 und Q2 stehen für die Ladungen und r steht für den Abstand dazwischen. Hier sieht man, dass der Abstand eine grosse Rolle spielt, denn dieser wird im quadrat genommen. | ||
== Elementarteilchen == | == Elementarteilchen == | ||
| Zeile 9: | Zeile 32: | ||
== Anordnung der Elementarteilchen in Atomen == | == Anordnung der Elementarteilchen in Atomen == | ||
| − | Den ersten Beweis, dass die Atome doch aus noch | + | Den ersten Beweis, dass die Atome doch aus noch kleineren Teilchen aufgebaut sind, lieferte J.J.Thomson Ende des 19. Jahrhunderts. Bei Experimenten mit Katodenstrahlen fand er heraus, dass diese aus negativen Teilchen bestehen, die aus dem Innern der Atome stammen müssen. Aus dieser Erkenntnis leitete er ein Atommodell ab, bei dem negative Elektronen in eine gleichmässig positive Grundmaterie eingebettet sind [[image:Thomsonsches_atommodell.png|thumb|right|Atommodell von Thomson]]. |
| − | Die Entdeckung der Radioaktivität durch H. Becquerel 1896 gab den Anstoss, die bisherigen Vorstellungen über die Struktur der Atome durch neue | + | Die Entdeckung der Radioaktivität durch H. Becquerel 1896 gab den Anstoss, die bisherigen Vorstellungen über die Struktur der Atome durch neue Modelle zu ersetzen. Wesentliche neue Erkenntnisse brachten die Streuversuche, die druch E. Rutherford und seine Mitarbeiter im Jahr 1909 ausgeführt wurden. |
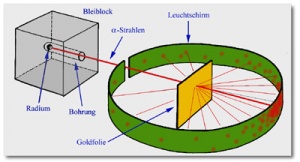
| − | Beim rutherfordschen Streuversuch wurde eine extrem dünne Goldfolie in einer Apparatur eingebaut | + | Beim rutherfordschen Streuversuch wurde eine extrem dünne Goldfolie in einer Apparatur eingebaut[[image:streuv1.jpg|thumb|right|Streuversuch von E.Rutherford]] . Rund um die Goldfolie wurde ein Fotografieschirm aufgespannt, der auf radiaktive Strahlung empfindlich ist. Danach wurde die Goldfolie mit Alpha-Strahlen (positiv geladene Helium-Ionen) beschossen. Die Erwartung, dass die grossen, schweren Alphateilchen in der Goldschicht mit etwa 1000 Goldatom-Schichten (!) stecken bleiben würden, tratt nicht ein. Die Ergebnisse ezigten: |
| + | |||
| + | 1. Der Grossteil der Alphateilchen drang ohne Ablenkung geradlinig durch die Goldfolie hindurch | ||
| + | |||
| + | 2. Einige wenige wurden stark stark abgelenkt. Die Alpha-Strahlen müssen also auf etwas positives, massenhaltiges gestossen sein im Atom. Rutherford leitete daraus ein neues Atommodell ab, bei dem anders als beim Thomsonschen Atommodell das Atom aus einem positiv geladenen massereichen Kern und einer negativ geladenen Hülle besteht. | ||
Nach dem rutherfordschen Atommodell besteht das Atom aus einem punktförmigen, massereichen, positiv geladenen Kern und einer viel grösseren kugelförmigen, negativ geladenen Hülle, die die positive Kernladung kompensiert. Dies erklärt, wieso einige Alphateilchen stark und andere gar nicht abgelenkt wurden, denn immer wenn ein solches Teilchen auf den positiven Kern trifft, wird es stark abgelenkt. | Nach dem rutherfordschen Atommodell besteht das Atom aus einem punktförmigen, massereichen, positiv geladenen Kern und einer viel grösseren kugelförmigen, negativ geladenen Hülle, die die positive Kernladung kompensiert. Dies erklärt, wieso einige Alphateilchen stark und andere gar nicht abgelenkt wurden, denn immer wenn ein solches Teilchen auf den positiven Kern trifft, wird es stark abgelenkt. | ||
| + | [[image:Rutherford_Streuversuch_2.png|thumb|right|Ergebnis Streuversuch Rutherford]] | ||
== Kern-Hülle-Modell == | == Kern-Hülle-Modell == | ||
| Zeile 24: | Zeile 52: | ||
* Enthält fast die gesamte Masse des Atomes | * Enthält fast die gesamte Masse des Atomes | ||
* Enthält Neutronen | * Enthält Neutronen | ||
| + | [[image:Rutherford_Atommodell.png|thumb|right|Atommodell von Rutherford]] | ||
| Zeile 54: | Zeile 83: | ||
==== Erklärung: Zentrifugalkraft (Planetenmodell) ==== | ==== Erklärung: Zentrifugalkraft (Planetenmodell) ==== | ||
| − | 1 | + | [[image:Zentrifugalkraft_1.jpg|thumb|right|Zentrifugalkraft]] |
| − | 2 | + | |
| + | * 1) Anziehungskraft Elektron - Proton | ||
| + | * 2) Zentrifugalkraft des Elektrons | ||
| − | |||
| − | + | Die Erklärung, dass die Zentrifugalkraft des Elektrons die Anziehungskraft zwischen Elektron und Kern kompensiert, kann nicht stimmen, weil nach klassischer Physik bei sich rhythmisch bewegenden entgegengesetzt geladenen Körpern elektromagnetische Strahlung entsteht. | |
| − | + | [[image:ems.jpg|thumb|right|Elektromagnetische Strahlung]] | |
Folge: Das Elektron verliert Energie in Form der elektromagnetischen Strahlung und würde in den Kern fallen. | Folge: Das Elektron verliert Energie in Form der elektromagnetischen Strahlung und würde in den Kern fallen. | ||
Tatsache: Elektronen, die weiter vom Kern weg sind, haben mehr Energie. | Tatsache: Elektronen, die weiter vom Kern weg sind, haben mehr Energie. | ||
| − | --> Das Modell, dass das Elektron ein Teilchen ist, stimmt nicht. Es handelt sich um eine Mischung zwischen einem Teilchen und einer Welle. Näheres zu diesem Thema findet man unter [[Das | + | --> Das Modell, dass das Elektron ein Teilchen ist, stimmt nicht. Es handelt sich um eine Mischung zwischen einem Teilchen und einer Welle. Näheres zu diesem Thema findet man unter [[Das unfassbare Elektron]] |
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| − | |||
| − | |||
== Berechnung der Anzahl der Elementarteilchen eines Atoms == | == Berechnung der Anzahl der Elementarteilchen eines Atoms == | ||
| − | Um die Anzahl herauszufinden, benötigt man ein Periodensystem. Die Ordnungszahl ist gleichzeitig auch die Protonenzahl. Da die Ladung des Atoms neutral sein muss, ist die Elektronenzahl gleich gross wie die Protonenzahl. Aus der Protonenzahl und der Atommasse lässt sich dann die Neutronenzahl bestimmen. Man weiss, dass ein Proton und ein Neutron die Masse 1 Unit haben. Die Differenz der Atommasse und der Ordnungszahl ergibt die Neutronenzahl. | + | Um die Anzahl herauszufinden, benötigt man ein Periodensystem. Die Ordnungszahl ist gleichzeitig auch die Protonenzahl. Da die Ladung des Atoms neutral sein muss, ist die Elektronenzahl gleich gross wie die Protonenzahl. Aus der Protonenzahl und der Atommasse lässt sich dann die Neutronenzahl bestimmen. Man weiss, dass ein Proton und ein Neutron die Masse 1 Unit haben. Die Differenz der Atommasse und der Ordnungszahl ergibt folglich die Neutronenzahl. |
* Beispiele: | * Beispiele: | ||
| Zeile 98: | Zeile 132: | ||
</tr> | </tr> | ||
<tr> | <tr> | ||
| − | <td width="20%"><i>Chlor:</i></td><td>Cl</td><td>ca.35u</td><td>17</td><td>17</td><td>35-17=18</td> | + | <td width="20%"><i>Chlor:</i></td><td>Cl</td><td>ca. 35u</td><td>17</td><td>17</td><td>35-17=18</td> |
</tr> | </tr> | ||
</table> | </table> | ||
| Zeile 105: | Zeile 139: | ||
=== Zusammenhänge === | === Zusammenhänge === | ||
| − | * Anzahl p<sup>+</sup> = | + | * Anzahl p<sup>+</sup> = Anzahl e<sup>-</sup> |
| − | * Anzahl n° = | + | * Anzahl n° = Massenzahl - Anzahl p<sup>+</sup> |
* Ordnungszahl = Anzahl p<sup>+</sup> (= Anzahl e<sup>-</sup>) | * Ordnungszahl = Anzahl p<sup>+</sup> (= Anzahl e<sup>-</sup>) | ||
| + | |||
| + | |||
| + | Die Anzahl Protonen in einem Atom bestimmt das Element. Ist die Protonenzahl bekannt, so kann man das Element im Periodensysem anhand der Ordnungszahl herausfinden, denn die Ordnungszahl entspricht der Anzahl Protonen in einem Atom. Sind z.B. 22 Protonen in einem Atom, so haldelt es sich um Titan, bei 47 Protonen ist es Silber. | ||
== Definitionen == | == Definitionen == | ||
| Zeile 114: | Zeile 151: | ||
* Isotope: Atome mit gleicher Anzahl Prononen und verschiedener Neutronenzahl | * Isotope: Atome mit gleicher Anzahl Prononen und verschiedener Neutronenzahl | ||
* Reinelemente: Bestehen aus einem Nukleid | * Reinelemente: Bestehen aus einem Nukleid | ||
| − | * Mischelemente: aus verschiedenen | + | * Mischelemente: aus verschiedenen Isotopen |
== Quellen == | == Quellen == | ||
| Zeile 121: | Zeile 158: | ||
* Chemieduden | * Chemieduden | ||
* Was ist was Band 3: Atomenergie | * Was ist was Band 3: Atomenergie | ||
| + | * Bild Thomson Atommodell: http://de.academic.ru/pictures/dewiki/116/thomsonsches_atommodell.png | ||
| + | * Bild Rutherford Streuversuch: http://www.u-helmich.de/che/09/03-atombau/streuv1.jpg | ||
| + | * Bild Rutherford Streuversuch 2: http://de.wikipedia.org/w/index.php?title=Datei:Rutherford_gold_foil_experiment_results.svg&filetimestamp=20051230195122 | ||
| + | * Bild Rutherford Atommodell: http://www.bertlnetz.de/chemie/bilder/ruato_gr.png | ||
| + | * Ich habe immer gesagt Enthusiasten dieses seit Jahren. [http://www.viagra-cialis.ch/products/cialis.htm cialis online] | ||
Aktuelle Version vom 2. Februar 2023, 19:56 Uhr
Schon vor mehr als 2000 Jahren sprach man von Atomen. Demokrit, einer der grössten Gelehrten im Alten Griechenland, nahm an, alle Materie bestehe aus kleinsten, nicht mehr teilbaren Teilchen, die er "Atome" nannte. Er kam damit der Wahrheit erstaunlich nahe. In Wirklichkeit lässt sich ein Atom noch in Protonen, Elektronen und Neutronen unterteilen, diese Teilchen (auch Elementarteilchen gennant) sind nicht mehr teilbar.
Inhaltsverzeichnis
Elektrizität
Coulombgesetz
Aus dem Unterricht ist das Experiment mit dem Holundermarkkügelchen bekannt. Ist der Kunststoffstaab durch das Reiben mit dem Seidetuch negativ geladen (hat also eine Überzahl von Elektronen) und wird nahe an das Kügelchen gehalten, so passiert zunächst nichts. Berührt der Staab danach das Kügelchen, so gehen Elektronen vom Staab auf das Kügelchen über und sie stossen sich ab (Kügelchen ist nun ebenfalls negativ geladen, weil es Elektronen aufgenommen hat). Wird dann der durch das Reiben mit dem Seidetuch positiv geladene Plastikstaab nahe an das Holundermarkkügelchen gehalten, ziehen sich Kügelchen und Staab an. Dies ist der Beweis dafür, dass sich zwei unterschiedliche Ladungen anziehen und zwei gleiche Ladungen sich abstossen.
Somit gibt es je zwei Möglichkeiten zur Abstossungs- und Anziehungskraft:
- + | | + --> Beide Ladungen positiv, Kräfte stossen sich ab.
- - | | - --> Beide Ladungen negativ, Kräfte stossen sich ab.
- + | | - --> Ladungen unterschiedlich, Kräfte ziehen sich an.
- - | | + --> Ladungen unterschiedlich, Kräfte ziehen sich an.
Doch nicht nur die Ladungen sind entscheidend für die Anziehugs- und Abstossungskräfte. Eine genau so grosse Rolle spielt der Abstand zwischen den Ladungen. Je weiter auseinander die Ladungen sind, desto geringer auch die Anziehungs- bzw. Abstossungskräfte.
Um die Kräfte zu berechnen, braucht man die Coulombformel:
Q1 und Q2 stehen für die Ladungen und r steht für den Abstand dazwischen. Hier sieht man, dass der Abstand eine grosse Rolle spielt, denn dieser wird im quadrat genommen.
Elementarteilchen
- Elektron(e-): Elektronen haben eine negative Ladung. Ihre Masse beträgt 1/2000 Unit.
- Protonen (p+): Protonen haben eine positive Ladung. Ihre Masse beträgt 1 Unit
- Neutronen (n°): Neutronen haben keine Ladung. Ihre Masse beträgt 1 Unit
Anordnung der Elementarteilchen in Atomen
Den ersten Beweis, dass die Atome doch aus noch kleineren Teilchen aufgebaut sind, lieferte J.J.Thomson Ende des 19. Jahrhunderts. Bei Experimenten mit Katodenstrahlen fand er heraus, dass diese aus negativen Teilchen bestehen, die aus dem Innern der Atome stammen müssen. Aus dieser Erkenntnis leitete er ein Atommodell ab, bei dem negative Elektronen in eine gleichmässig positive Grundmaterie eingebettet sind
.
Die Entdeckung der Radioaktivität durch H. Becquerel 1896 gab den Anstoss, die bisherigen Vorstellungen über die Struktur der Atome durch neue Modelle zu ersetzen. Wesentliche neue Erkenntnisse brachten die Streuversuche, die druch E. Rutherford und seine Mitarbeiter im Jahr 1909 ausgeführt wurden.
Beim rutherfordschen Streuversuch wurde eine extrem dünne Goldfolie in einer Apparatur eingebaut
. Rund um die Goldfolie wurde ein Fotografieschirm aufgespannt, der auf radiaktive Strahlung empfindlich ist. Danach wurde die Goldfolie mit Alpha-Strahlen (positiv geladene Helium-Ionen) beschossen. Die Erwartung, dass die grossen, schweren Alphateilchen in der Goldschicht mit etwa 1000 Goldatom-Schichten (!) stecken bleiben würden, tratt nicht ein. Die Ergebnisse ezigten:
1. Der Grossteil der Alphateilchen drang ohne Ablenkung geradlinig durch die Goldfolie hindurch
2. Einige wenige wurden stark stark abgelenkt. Die Alpha-Strahlen müssen also auf etwas positives, massenhaltiges gestossen sein im Atom. Rutherford leitete daraus ein neues Atommodell ab, bei dem anders als beim Thomsonschen Atommodell das Atom aus einem positiv geladenen massereichen Kern und einer negativ geladenen Hülle besteht.
Nach dem rutherfordschen Atommodell besteht das Atom aus einem punktförmigen, massereichen, positiv geladenen Kern und einer viel grösseren kugelförmigen, negativ geladenen Hülle, die die positive Kernladung kompensiert. Dies erklärt, wieso einige Alphateilchen stark und andere gar nicht abgelenkt wurden, denn immer wenn ein solches Teilchen auf den positiven Kern trifft, wird es stark abgelenkt.
Kern-Hülle-Modell
Kern
- Winzig klein, ca. 10-15m
- Positiv geladen: enthält Protonen
- Enthält fast die gesamte Masse des Atomes
- Enthält Neutronen
Hülle
- Im Vergleich zum Kern riesig gross, ca. 10-8m --> Angenommen der Kern hat die Grösse eines Tennisballes, so beträgt der Radius der Hülle 50 km
- Negativ geladen: enthält Elektronen
- Hat fast keine Masse
Zusammenhänge
- Gleich viele Protonen wie Elektronen, daher ist ein Atom neutral.
- Die Masse der Hülle ist vernachlässigbar, der Atomkern enthält fast die gesamte Masse.
- Die Ausdehnung des Atomkerns ist auch vernachlässigbar.
Problem 1
Wieso stossen sich die Protonen im Kern nicht gegenseitig ab?
Erklärung: Wenn Protonen und Neutronen zusammenkommen, entsteht eine extrem starke neue Anziehungskraft, die Kernkraft. Sie tritt jedoch nur auf kurze Distanz auf. Ein Neutron kann sich in ein Proton und ein Elektron verwandeln und umgekehrt. Dies passiert ständig, so entsteht die Kernkraft. Je nach Zahlenverhältnis zwischen Protonen und Neutronen kann die Anziehungskraft sehr stabil oder sehr instabil sein. Wenn die Anziehungskraft gering ist, kann es zerfallen, dadurch entsteht Radioaktivität.
Problem 2
Wieso fallen die Elektronen nicht in den Kern, wenn sich die beiden unterschiedlichen Ladungen des Elektrons und des Protons anziehen?
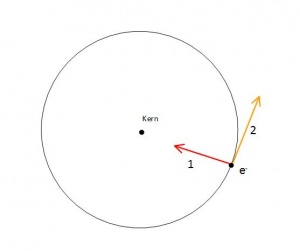
Erklärung: Zentrifugalkraft (Planetenmodell)
- 1) Anziehungskraft Elektron - Proton
- 2) Zentrifugalkraft des Elektrons
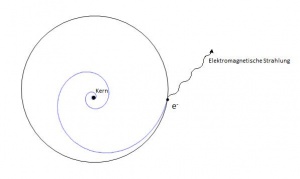
Die Erklärung, dass die Zentrifugalkraft des Elektrons die Anziehungskraft zwischen Elektron und Kern kompensiert, kann nicht stimmen, weil nach klassischer Physik bei sich rhythmisch bewegenden entgegengesetzt geladenen Körpern elektromagnetische Strahlung entsteht.
Folge: Das Elektron verliert Energie in Form der elektromagnetischen Strahlung und würde in den Kern fallen. Tatsache: Elektronen, die weiter vom Kern weg sind, haben mehr Energie.
--> Das Modell, dass das Elektron ein Teilchen ist, stimmt nicht. Es handelt sich um eine Mischung zwischen einem Teilchen und einer Welle. Näheres zu diesem Thema findet man unter Das unfassbare Elektron
Berechnung der Anzahl der Elementarteilchen eines Atoms
Um die Anzahl herauszufinden, benötigt man ein Periodensystem. Die Ordnungszahl ist gleichzeitig auch die Protonenzahl. Da die Ladung des Atoms neutral sein muss, ist die Elektronenzahl gleich gross wie die Protonenzahl. Aus der Protonenzahl und der Atommasse lässt sich dann die Neutronenzahl bestimmen. Man weiss, dass ein Proton und ein Neutron die Masse 1 Unit haben. Die Differenz der Atommasse und der Ordnungszahl ergibt folglich die Neutronenzahl.
- Beispiele:
| Element | Symbol | Atommasse | Anzahl p+ | Anzahl e- | Anzahl n° |
|---|---|---|---|---|---|
| Wasserstoff: | H | 1u | 1 | 1 | 1-1=0 |
| Helium: | He | 4u | 2 | 2 | 4-2=2 |
| Gold: | Au | 197u | 79 | 79 | 197-79=118 |
| Chlor: | Cl | ca. 35u | 17 | 17 | 35-17=18 |
Zusammenhänge
- Anzahl p+ = Anzahl e-
- Anzahl n° = Massenzahl - Anzahl p+
- Ordnungszahl = Anzahl p+ (= Anzahl e-)
Die Anzahl Protonen in einem Atom bestimmt das Element. Ist die Protonenzahl bekannt, so kann man das Element im Periodensysem anhand der Ordnungszahl herausfinden, denn die Ordnungszahl entspricht der Anzahl Protonen in einem Atom. Sind z.B. 22 Protonen in einem Atom, so haldelt es sich um Titan, bei 47 Protonen ist es Silber.
Definitionen
- Nukleid: Atome mit einer definierten Anzahl Neutronen und Protonen
- Isotope: Atome mit gleicher Anzahl Prononen und verschiedener Neutronenzahl
- Reinelemente: Bestehen aus einem Nukleid
- Mischelemente: aus verschiedenen Isotopen
Quellen
- Chemieunterlagen
- Chemieduden
- Was ist was Band 3: Atomenergie
- Bild Thomson Atommodell: http://de.academic.ru/pictures/dewiki/116/thomsonsches_atommodell.png
- Bild Rutherford Streuversuch: http://www.u-helmich.de/che/09/03-atombau/streuv1.jpg
- Bild Rutherford Streuversuch 2: http://de.wikipedia.org/w/index.php?title=Datei:Rutherford_gold_foil_experiment_results.svg&filetimestamp=20051230195122
- Bild Rutherford Atommodell: http://www.bertlnetz.de/chemie/bilder/ruato_gr.png
- Ich habe immer gesagt Enthusiasten dieses seit Jahren. cialis online