Die Reaktionsenthalpie ΔH: Unterschied zwischen den Versionen
(→Berechnung der Reaktionsenthalpie) |
|||
| (56 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
| − | Die Reaktionsenthalpie ∆H ist der Energieumsatz bei konstantem Druck | + | Die Reaktionsenthalpie ∆H ist der Energieumsatz bei einer mit konstantem Druck durchgeführten chemischen Reaktion. Sie ist also diejenige Energie, die freigesetzt (exotherme Reaktion) bzw. aufgebracht (endotherme Reaktion) werden muss, damit die Bindungen der Edukte gelöst, und die Bindungen der Produkte gebildet werden können. |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
== Lebewesen == | == Lebewesen == | ||
| Zeile 15: | Zeile 10: | ||
In der Technik kommt der Temperatur der Reaktionsprodukte eine wichtige Bedeutung zu. Bei Verbrennungen (Motor, Gasturbine) wird immer Energie in Form von Wärme frei. Hierbei möchte man wissen mit welcher Temperatur die Produkte zur Verfügung stehen um z.B. herauszufinden, wie viel Wärme (Energie) man gewinnen kann. | In der Technik kommt der Temperatur der Reaktionsprodukte eine wichtige Bedeutung zu. Bei Verbrennungen (Motor, Gasturbine) wird immer Energie in Form von Wärme frei. Hierbei möchte man wissen mit welcher Temperatur die Produkte zur Verfügung stehen um z.B. herauszufinden, wie viel Wärme (Energie) man gewinnen kann. | ||
| + | == Messung der Reaktionsenthalpie == | ||
| + | |||
| + | Die Enthalpie einer Reaktion ist zum Unterschied zu den Enthalpien von Einzelstoffen mit Hilfe eines Kalorimeters messbar. Bei exothermen Reaktionen wird bekannterweise überschüssige Energie in Form von Wärme an die Umgebung abgegeben. Der Kalorimeter misst diese abgegebene Wärme und kann so auf die Reaktionsenthalpie schliessen. Bei der endothermen Reaktion ist das genau umgekehrt. Es muss Energie aufgebracht werden, damit die Reaktion ablaufen kann. Es wird also Wärme von der Umgebung (in diesem Falle vom Kalorimeter) aufgenommen. Der Kalorimeter kann diese Wärme wiederum messen und dadurch auf die Enthalpie schliessen. | ||
| + | |||
| + | == Berechnung der Reaktionsenthalpie == | ||
| + | |||
| + | '''ΔH<sub>R</sub> = ∑ΔH<sub>Produkte</sub> - ∑ΔH<sub>Edukte</sub>''' | ||
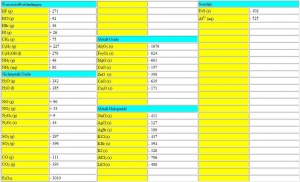
| + | [[image:Standard-Bildungsenthalpien-Tabelle.jpg|thumb|right|Beispiel einer Tabelle mit molaren Standard-Bildungsenthalpien von Stoffen in kJ/mol]] | ||
| − | = | + | Zur Berechnung der Reaktionsenthalpie nimmt man die Differenz der Bildungsenthalpien der Produkte und der Edukte. Diese Bildungsenthalpien sind tabellarisch (Bild rechts) einzusehen und können so übernommen werden, um ΔH<sub>R</sub> zu berechnen. Die Bildungsenthalpien sind zu Standardbedingungen (Temperatur = 293.15 K (~25°C), Druck = 1.013 bar) angegeben. Die Bildungsenthalpie von Elementen in ihrem energieärmsten Zustand ist definitionsgemäss = 0. |
| + | Ist der Energieinahlt der Produkte geringer als der der Edukte (ΔH < 0), so liegt eine exotherme Reaktion vor. | ||
| + | Umgekehrt dazu steht die endotherme Reaktion, bei der der Energieinhalt der Produkte grösser ist als der der Edukte (ΔH > 0). | ||
| − | + | === Beispiel Bestimmung des Heizwertes von Ethanol (C<sub>2</sub>H<sub>5</sub>OH<sub>(l)</sub>)=== | |
| + | C<sub>2</sub>H<sub>5</sub>OH<sub></sub> + 3O<sub>2</sub> → 2 CO<sub>2</sub> + 3H<sub>2</sub>O | ||
| + | ΔH<sub>R</sub> = (2 x -393kJ/Mol)+(3 x -242kJ/Mol) - (-278kJ/Mol) | ||
| + | = -786kJ/Mol - 726kJ/Mol + 278kJ/Mol | ||
| + | = -1234 kJ/Mol (-> exotherme Reaktion!) | ||
| + | Zu beachten ist hierbei, dass O<sub>2</sub> als Element mit der Bildungsenthalpie 0 gehandhabt wird und daher in der Berechnung keine Rolle spielt | ||
| + | Genaueres dazu findet ihr unter [[Berechnung der Reaktionsenthalpie]]. | ||
| + | ==Endotherm und Exotherm== | ||
| + | [[image:Endotherm.JPG|left|Endotherme Reaktion]] [[image:Exotherm.JPG|right|Exotherme Reaktion]] | ||
| Zeile 49: | Zeile 62: | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
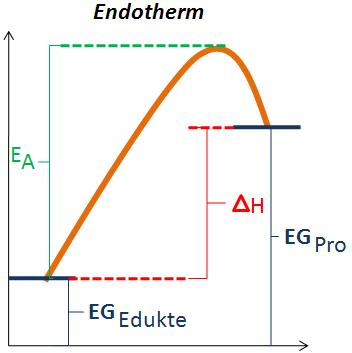
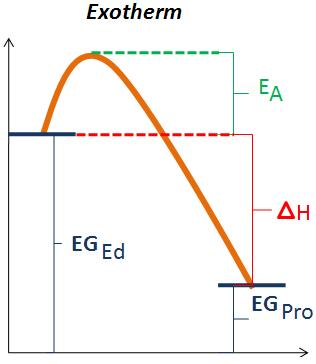
| − | + | Auf diesen Skizzen ist eine exotherme und eine endotherme Reaktion dargestellt. (E<sub>A</sub>) steht für die Aktivierungsenergie. Diese Aktivierungsenergie kann als Schwellenwert angesehen werden, der überschritten werden muss, damit die Reaktion ablaufen kann. Die Aktivierungsenergie ist aber nicht mit der Energie zu verwechseln, die bei einer endothermen Reaktion zugeführt werden muss. Sie entspricht lediglich dem Barrierenwert, der durch den Zusammenstoss zweier Teilchen überwunden werden muss, damit die chemische Reaktion abläuft. | |
| + | Die Reaktionsgeschwindigkeit ist abhängig von der Aktivierungsenergie. Ist die Aktivierungsenergie klein, so läuft die Reaktion schnell ab. Ist sie jedoch gross, läuft sie langsam ab. | ||
| + | (EG<sub>Ed</sub>)bedeutet Energiegehalt der Edukte und steht für die potenzielle Energie der Edukte, sowie (EG<sub>Pro</sub>) für die potenzielle Energie der Produkte steht. | ||
| + | Bei einer exothermen Reaktion ist ΔH negativ (ΔH<0), das heisst die Wärme wird an die Umgebung abgegeben. | ||
| + | Bei einer endothermen Reaktion ist ΔH positiv (ΔH>0), weil die Energiedifferenz mit der Wärme aus der Umgebung ausgeglichen wird, das heisst die Umgebung verliert an Wärme. | ||
| − | = | + | =Quellen= |
| − | + | * Notizen Chemieunterricht R.Deuber | |
| − | + | * Chemie Unterrichtsbuch "Element" | |
| + | * Tabelle Bildungsenthalpien [http://www.tgs-chemie.de/bildungsenthalpien.htm] | ||
Aktuelle Version vom 23. Juni 2010, 10:56 Uhr
Die Reaktionsenthalpie ∆H ist der Energieumsatz bei einer mit konstantem Druck durchgeführten chemischen Reaktion. Sie ist also diejenige Energie, die freigesetzt (exotherme Reaktion) bzw. aufgebracht (endotherme Reaktion) werden muss, damit die Bindungen der Edukte gelöst, und die Bindungen der Produkte gebildet werden können.
Inhaltsverzeichnis
Lebewesen
Offene Systeme wie Lebewesen tauschen mit ihrer Umwelt ständig Energie und Stoffe aus. Bei den zahllosen chemischen Reaktionen z.B. im Körper werden ständig Edukte in Produkte umgewandelt. Hierbei spielt der Energieumsatz eine wichtige Rolle, da wir Energie zum Überleben benötigen und es entscheidend ist wie viel bei einer Reaktion verbraucht wird und wie viel noch in den Produkten vorhanden ist.
Technik
In der Technik kommt der Temperatur der Reaktionsprodukte eine wichtige Bedeutung zu. Bei Verbrennungen (Motor, Gasturbine) wird immer Energie in Form von Wärme frei. Hierbei möchte man wissen mit welcher Temperatur die Produkte zur Verfügung stehen um z.B. herauszufinden, wie viel Wärme (Energie) man gewinnen kann.
Messung der Reaktionsenthalpie
Die Enthalpie einer Reaktion ist zum Unterschied zu den Enthalpien von Einzelstoffen mit Hilfe eines Kalorimeters messbar. Bei exothermen Reaktionen wird bekannterweise überschüssige Energie in Form von Wärme an die Umgebung abgegeben. Der Kalorimeter misst diese abgegebene Wärme und kann so auf die Reaktionsenthalpie schliessen. Bei der endothermen Reaktion ist das genau umgekehrt. Es muss Energie aufgebracht werden, damit die Reaktion ablaufen kann. Es wird also Wärme von der Umgebung (in diesem Falle vom Kalorimeter) aufgenommen. Der Kalorimeter kann diese Wärme wiederum messen und dadurch auf die Enthalpie schliessen.
Berechnung der Reaktionsenthalpie
ΔHR = ∑ΔHProdukte - ∑ΔHEdukte
Zur Berechnung der Reaktionsenthalpie nimmt man die Differenz der Bildungsenthalpien der Produkte und der Edukte. Diese Bildungsenthalpien sind tabellarisch (Bild rechts) einzusehen und können so übernommen werden, um ΔHR zu berechnen. Die Bildungsenthalpien sind zu Standardbedingungen (Temperatur = 293.15 K (~25°C), Druck = 1.013 bar) angegeben. Die Bildungsenthalpie von Elementen in ihrem energieärmsten Zustand ist definitionsgemäss = 0. Ist der Energieinahlt der Produkte geringer als der der Edukte (ΔH < 0), so liegt eine exotherme Reaktion vor. Umgekehrt dazu steht die endotherme Reaktion, bei der der Energieinhalt der Produkte grösser ist als der der Edukte (ΔH > 0).
Beispiel Bestimmung des Heizwertes von Ethanol (C2H5OH(l))
C2H5OH + 3O2 → 2 CO2 + 3H2O
ΔHR = (2 x -393kJ/Mol)+(3 x -242kJ/Mol) - (-278kJ/Mol) = -786kJ/Mol - 726kJ/Mol + 278kJ/Mol = -1234 kJ/Mol (-> exotherme Reaktion!)
Zu beachten ist hierbei, dass O2 als Element mit der Bildungsenthalpie 0 gehandhabt wird und daher in der Berechnung keine Rolle spielt
Genaueres dazu findet ihr unter Berechnung der Reaktionsenthalpie.
Endotherm und Exotherm
Auf diesen Skizzen ist eine exotherme und eine endotherme Reaktion dargestellt. (EA) steht für die Aktivierungsenergie. Diese Aktivierungsenergie kann als Schwellenwert angesehen werden, der überschritten werden muss, damit die Reaktion ablaufen kann. Die Aktivierungsenergie ist aber nicht mit der Energie zu verwechseln, die bei einer endothermen Reaktion zugeführt werden muss. Sie entspricht lediglich dem Barrierenwert, der durch den Zusammenstoss zweier Teilchen überwunden werden muss, damit die chemische Reaktion abläuft.
Die Reaktionsgeschwindigkeit ist abhängig von der Aktivierungsenergie. Ist die Aktivierungsenergie klein, so läuft die Reaktion schnell ab. Ist sie jedoch gross, läuft sie langsam ab.
(EGEd)bedeutet Energiegehalt der Edukte und steht für die potenzielle Energie der Edukte, sowie (EGPro) für die potenzielle Energie der Produkte steht.
Bei einer exothermen Reaktion ist ΔH negativ (ΔH<0), das heisst die Wärme wird an die Umgebung abgegeben.
Bei einer endothermen Reaktion ist ΔH positiv (ΔH>0), weil die Energiedifferenz mit der Wärme aus der Umgebung ausgeglichen wird, das heisst die Umgebung verliert an Wärme.
Quellen
- Notizen Chemieunterricht R.Deuber
- Chemie Unterrichtsbuch "Element"
- Tabelle Bildungsenthalpien [1]