Wichtige Nichtmetall-Elemente: Unterschied zwischen den Versionen
(→Verwendung:) |
(→Erhitzen von Schwefel:) |
||
| (69 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 3: | Zeile 3: | ||
=Wichtige Nichtmetalle= | =Wichtige Nichtmetalle= | ||
| − | == Kohlenstoff == | + | == A) Kohlenstoff == |
| − | Kohlenstoff (C) kommt in der Natur | + | Kohlenstoff (C) kommt in der Natur einerseits als reines Element (Diamant/Graphit), andererseits aber auch in Verbindungen vor. Des weiteren ist Kohlenstoff der Grundbaustein allen Lebens bzw. aller organischen Stoffe. Jegliche Zellen im Körper bestehen aus Kohlenstoff, sowie auch Nährstoffe wie Kohlenhydrate, Fette, Proteine etc. Kohlenstoff ist also extrem wichtig für alles Leben. Man unterscheidet allgemein zwischen organischen Stoffen (enthalten C-Atome) und anorganischen Stoffen (ohne C-Atome), wodurch die Chemie auch in organische und anorganische Chemie unterteilt wird. |
| − | |||
| − | |||
| − | + | Aufgrund seiner besonderen Elektronenkonfiguration (halbgefüllte L-Schale) besitzt es die Fähigkeit zur Bildung von komplexen Molekülen und ist das Element, welches nach Wasserstoff die meisten Verbindungen aller Elemente bilden kann (Wasserstoff steht an erster Stelle, weil die meisten Kohlenstoffverbindungen auch Wasserstoff enthalten). | |
| − | |||
| + | Es existieren zwei verschiedene Modifikationen von elementarem Kohlenstoff: Diamant und Graphit. Diese Stoffe bestehen zwar beide aus C-Atomen, weisen aber aufgrund ihrer differenzierten Struktur unterschiedliche Eigenschaften auf. | ||
=== Diamant === | === Diamant === | ||
| Zeile 29: | Zeile 27: | ||
* Der Diamant leitet keine Elektrizität → Die Elektronen sind stark gebunden und können sich nicht frei bewegen. | * Der Diamant leitet keine Elektrizität → Die Elektronen sind stark gebunden und können sich nicht frei bewegen. | ||
| − | * Der Diamant ist durchsichtig | + | * Der Diamant ist durchsichtig, absorbiert also kein Licht, kann es dafür aber stark brechen → Auch dies ist damit zu erklären, dass nur stark gebundene Elektronen vorhanden sind. |
====Verwendung:==== | ====Verwendung:==== | ||
| Zeile 35: | Zeile 33: | ||
* Als Schmuck sehr begehrt. Seine Fähigkeit, dass Licht zu brechen, macht ihn besonders wertvoll und schön. | * Als Schmuck sehr begehrt. Seine Fähigkeit, dass Licht zu brechen, macht ihn besonders wertvoll und schön. | ||
| − | |||
| − | |||
=== Graphit === | === Graphit === | ||
| Zeile 44: | Zeile 40: | ||
[[image:127575.jpg.352147.jpg]] | [[image:127575.jpg.352147.jpg]] | ||
| − | Die Struktur der Ebenen ist hexagonal bzw. die Ebenen sind Wabenförmig, wobei Jedes C-Atom 3 Elektronenpaarbindungen hat. Die Bindungen zwischen den Atomen, welche in der Ebene liegen | + | Die Struktur der Ebenen ist hexagonal bzw. die Ebenen sind Wabenförmig, wobei Jedes C-Atom 3 Elektronenpaarbindungen hat. Die Ebenen untereinander sind nur locker über Van-der-Waals-Kräfte miteinander Verbunden. Die Bindungen zwischen den Atomen, welche in der Ebene liegen sind relativ stark. Im Gegensatz dazu ist die Bindungsenergie zwischen den einzelnen Schichten deutlich geringer. |
====Eigenschaften:==== | ====Eigenschaften:==== | ||
| − | * Graphit ist elektrisch Leitfähig → Er enthält elektrisch geladene Teilchen, welche sich frei bewegen können. Es handelt sich hierbei um die | + | * Graphit ist elektrisch Leitfähig → Er enthält elektrisch geladene Teilchen, welche sich frei bewegen können. Es handelt sich hierbei um die Valenzelektronen, welche sich zwischen den Graphitschichten aufhalten (Siehe Bild der Graphitstruktur). |
| + | |||
| + | * Graphit kann, im Gegensatz zu Diamant, Licht absorbieren und ist deshalb schwarz → Die Ursache dieses Phänomens sind die schwach gebundenen Elektronen. | ||
| + | |||
| + | * Graphit hat ebenfalls einen sehr hohen Schmelzpunkt (4000°C) → Auch Graphit besteht aus Riesenmolekülen. | ||
| + | |||
| + | * Die Graphitschichten lassen sich aufgrund der schwachen Kräfte schichtweise abtragen. | ||
| − | * Graphit | + | * Graphit ist weich und hat eine viel niedrigere Dichte (2,26 g/cm3) als Diamant → Diese Tatsache ist aufgrunde der verschiedenen Gitterstrukturen zu erklären. |
| + | ====Verwendung:==== | ||
| − | Graphit | + | * Als Mine von Bleistiften |
| − | + | * Als Aktivkohle (In Gasmasken, Tabletten etc.) | |
| + | * Bei einer Elektrolyse (Der Graphit wird dabei als Elektroden verwendet) | ||
| + | * Als Schmiermittel | ||
| + | Bei diesen Punkten spielt die Tatsache eine Rolle, dass zwischen den Schichten im Graphitgitter grosse Abstände herrschen, wodurch sich die einzelnen Schichten leicht abtragen lassen. | ||
| − | ==== | + | == B) Schwefel == |
| − | + | ||
| + | Schwefel kommt in der Natur sowohl in elmentarer Form, als auch in Verbindungen vor. In den USA, Mexiko, Sizilien, Japan und Polen sind riesige Lager elementaren Schwefels zu finden. Als Verbindung ist er in zahlreichen Mineralien und in einigen Schwermetallen zu finden. Interessant ist die Tatsache, dass Schwefel das Element mit der grössten Vielfallt an Strukturen ist. | ||
| + | |||
| + | ====Erhitzen von Schwefel:==== | ||
| + | Die Veränderung der Strukturen beim Erhitzen liefert wichtige Zusammenhänge zwischen der Struktur und den Eigenschaften | ||
| + | |||
| + | Die Temperatur nimmt von links nach rechts immer weiter zu. | ||
| + | |||
| + | |||
| + | [[image:Schwefel23.gif]] | ||
| + | |||
| + | |||
| + | * 1. Bei Raumtemperatur ist der Schwefel gelb und fest. Die Schwefelmoleküle bestehen aus 8 S-Atomen, welche ringförmig angeordnet sind. Die Struktur des Schwefels in diesem Zustand kann man sich als Krone vorstellen. | ||
| + | |||
| + | * 2. Wird der Schwefel nun erhitzt, beginnt er bei ca. 119°C zu schmelzen. Dabei bleibt die Farbe noch gelb und auch an der Struktur verändert sich noch nichts. Erst nach einiger Zeit verändert sich die Farbe schliesslich in ein gelb-orange und die S-Atome, welche zuvor noch Kronförmig angeordnet waren, fallen nun auseinander und bilden kleinere Molekülketten. Die Bindungen brechen also, womit die Veränderung der Farbe zu erklären ist. | ||
| + | |||
| + | * 3. Nach einer weiteren Phase des Erhitzens, wird der Schwefel wieder dickflüssig und seine Farbe ändert sich in ein dunkelrot-braun. Die zuvor noch kurzen Molekülketten verbinden sich nun zu langen Molekülketten, was die Dickflüssigkeit des Schwefels verursacht. | ||
| + | |||
| + | * 4. Erhitzt man den Schwefel weiter, wird er wieder dünnflüssig und er wird langsam schwarz. Der Grund, weshalb der Schwefel wieder dünnflüssig wird, ist folgender: Durch die nun bereits sehr hohe Temperatur findet ein Bindungsbruch der langen Molekülketten statt. Das heisst, die langen Molekülketten "zerbrechen" in kürzere Molekülketten und es besteht wieder eine Situation wie bei Punkt 2. | ||
| + | |||
| + | * 5. Wird schlussendlich eine Temperatur von ca. 445°C erreicht, wird der Schwefel gasförmig. | ||
| + | |||
| + | [[image:Schwefel2.jpg|thumb|right|]] | ||
| + | |||
| + | ====Plastischen Schwefel herstellen:==== | ||
| + | |||
| + | Es gibt eine Möglichkeit, plastischen Schwefel herzustellen, sowie er im dem Bild auf der rechten Seite erkennbar ist. Dazu muss neben dem Erwärmen nicht mehr viel getan werden. Es reicht, wenn der flüssige, heisse Schwefel in einer kalten Flüssigkeit wie zum Beispiel Wasser abgeschreckt wird. Das heisst man beschleunigt einfach den Mechanismus des Abkühlens. Dadurch, dass die langen Molekülketten, wie sie im flüssigen Zustand vorhanden sind, keine Zeit haben, wieder eine kronenförmige Struktur einzugehen, bleiben sie vorhanden und bewirken so, dass der Schwefel plastisch wird. | ||
==Phosphor== | ==Phosphor== | ||
| Zeile 69: | Zeile 101: | ||
Mehrstündiges Erhitzen von weißem Phosphor auf etwa 260 °C unter Luftabschluss führt zu rotem Phosphor | Mehrstündiges Erhitzen von weißem Phosphor auf etwa 260 °C unter Luftabschluss führt zu rotem Phosphor | ||
| + | |||
| + | Die Struktur von Phosphor weist eine Tetraederfrom auf. | ||
===Roter Phosphor=== | ===Roter Phosphor=== | ||
| Zeile 76: | Zeile 110: | ||
=Halogene= | =Halogene= | ||
Als Halogene bezeichnet man die Nichtmetalle der 7.Hauptgruppe gleich vor den Edelgasen. Ihnen fehlt nur noch ein Elektron zur vollen Valenzschale weshalb sie sehr reaktionsfreudig sind. Die Halogene bilden sehr häufig Salze in Verbindung mit Metallen | Als Halogene bezeichnet man die Nichtmetalle der 7.Hauptgruppe gleich vor den Edelgasen. Ihnen fehlt nur noch ein Elektron zur vollen Valenzschale weshalb sie sehr reaktionsfreudig sind. Die Halogene bilden sehr häufig Salze in Verbindung mit Metallen | ||
| − | (Halogene = Salzbildner), weshalb sie in der Natur nicht in elementarer Form vorzufinden sind. | + | (Halogene = Salzbildner), weshalb sie in der Natur nicht in elementarer Form vorzufinden sind. Dies wird durch die Summenformeln verdeutlicht: F2, Cl2, etc. |
| − | Zu den Halogenen gehören Fluor, Chlor, Brom, Iod und Astat (siehe Übersicht).Die Reaktionsfreudigkeit, beziehungsweise die Ionisierungseneregie und die Elektronegativität (siehe polare Bindung) ist bekanntlich rechtsoben im Periodensytem am grössten, also bei Fluor welches das Element mit den stärksten Anziehungskräften ist. Mit zunehmendere | + | Zu den Halogenen gehören Fluor, Chlor, Brom, Iod und Astat (siehe Übersicht).Die Reaktionsfreudigkeit, beziehungsweise die Ionisierungseneregie und die Elektronegativität (siehe polare Bindung) ist bekanntlich rechtsoben im Periodensytem am grössten, also bei Fluor welches das Element mit den stärksten Anziehungskräften ist. Mit zunehmendere Anzahl Schalen sinkt diese Anziehungskraft und somit auch die Reaktionsfreudigkeit von Fluor nach Astat immer mehr. |
=Edelgase= | =Edelgase= | ||
| Zeile 85: | Zeile 119: | ||
Es sind die Elemente: Helium, Neon, Argon, Krypton, Xenon und Radon. | Es sind die Elemente: Helium, Neon, Argon, Krypton, Xenon und Radon. | ||
Alle Edelgase sind farb- und geruchlose, nicht brennbare und kaum wasserlösliche Gase. | Alle Edelgase sind farb- und geruchlose, nicht brennbare und kaum wasserlösliche Gase. | ||
| + | Edelgase haben nicht die Tendenz dazu, Elektronen aufzunehmen → Es ist kein Platz mehr in der Valenzschale vorhanden. | ||
| + | Edelgase haben nicht die Tendent dazu, Elektronen abzugeben → Die Valenzelektronen werden sehr stark angezogen. | ||
Ihre Atome weisen in der Außenschale acht Elektronen auf. Eine Ausnahme dabei ist Helium, das nur zwei Elektronen in der Außenschale besitzt; da die erste Schale nicht mehr Elektronen binden kann, hat das Atom trotzdem ebenfalls die höchstmögliche Anzahl an Außenelektronen. | Ihre Atome weisen in der Außenschale acht Elektronen auf. Eine Ausnahme dabei ist Helium, das nur zwei Elektronen in der Außenschale besitzt; da die erste Schale nicht mehr Elektronen binden kann, hat das Atom trotzdem ebenfalls die höchstmögliche Anzahl an Außenelektronen. | ||
| Zeile 97: | Zeile 133: | ||
* Bild Diamantstruktur: http://upload.wikimedia.org/wikipedia/commons/2/22/Diamond_Cubic-F_lattice_animation.gif | * Bild Diamantstruktur: http://upload.wikimedia.org/wikipedia/commons/2/22/Diamond_Cubic-F_lattice_animation.gif | ||
* Bild Graphitstruktur: http://www.wissenschaft-online.de/sixcms/media.php/912/thumbnails/127575.jpg.352147.jpg | * Bild Graphitstruktur: http://www.wissenschaft-online.de/sixcms/media.php/912/thumbnails/127575.jpg.352147.jpg | ||
| + | * 2 Bilder + Textteile Schwefel: http://www.cumschmidt.de/sm_schwefel.htm | ||
Aktuelle Version vom 21. Juni 2010, 22:23 Uhr
Inhaltsverzeichnis
Wichtige Nichtmetalle
A) Kohlenstoff
Kohlenstoff (C) kommt in der Natur einerseits als reines Element (Diamant/Graphit), andererseits aber auch in Verbindungen vor. Des weiteren ist Kohlenstoff der Grundbaustein allen Lebens bzw. aller organischen Stoffe. Jegliche Zellen im Körper bestehen aus Kohlenstoff, sowie auch Nährstoffe wie Kohlenhydrate, Fette, Proteine etc. Kohlenstoff ist also extrem wichtig für alles Leben. Man unterscheidet allgemein zwischen organischen Stoffen (enthalten C-Atome) und anorganischen Stoffen (ohne C-Atome), wodurch die Chemie auch in organische und anorganische Chemie unterteilt wird.
Aufgrund seiner besonderen Elektronenkonfiguration (halbgefüllte L-Schale) besitzt es die Fähigkeit zur Bildung von komplexen Molekülen und ist das Element, welches nach Wasserstoff die meisten Verbindungen aller Elemente bilden kann (Wasserstoff steht an erster Stelle, weil die meisten Kohlenstoffverbindungen auch Wasserstoff enthalten).
Es existieren zwei verschiedene Modifikationen von elementarem Kohlenstoff: Diamant und Graphit. Diese Stoffe bestehen zwar beide aus C-Atomen, weisen aber aufgrund ihrer differenzierten Struktur unterschiedliche Eigenschaften auf.
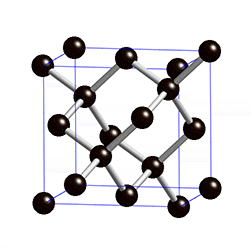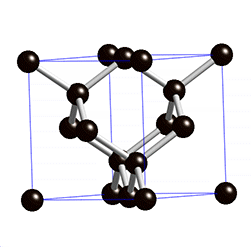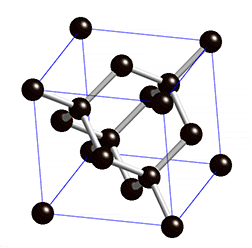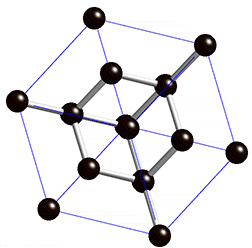
Diamant
Struktur:
Die Diamant-Struktur hat, wie auf dem Bild erkennbar, eine kubische Form. Jedes Kohlenstoffatom ist tetraedisch mit 4 weiteren Kohlenstoffatomen verbunden.
Eigenschaften:
- Der Diamant ist extrem hart und hat eine hohe Dichte (3.51g/cm3) → Die Kohlenstoffatome haben durch diese gitterförmige Anordnung einen sehr starken Zusammenhalt.
- Der Diamant hat einen hohen Schmelzpunkt (3550°C) → Die Moleküle des Diamantes sind extrem gross. Man spricht von sogenannten Riesenmolekülen und je grösser die Moleküle (Teilchen) eines Stoffes sind, desto höher ist dessen Schmelzpunkt.
- Der Diamant leitet keine Elektrizität → Die Elektronen sind stark gebunden und können sich nicht frei bewegen.
- Der Diamant ist durchsichtig, absorbiert also kein Licht, kann es dafür aber stark brechen → Auch dies ist damit zu erklären, dass nur stark gebundene Elektronen vorhanden sind.
Verwendung:
- Als Werkzeug zum Schneiden, Schleifen, Bohren, Fräsen etc.
- Als Schmuck sehr begehrt. Seine Fähigkeit, dass Licht zu brechen, macht ihn besonders wertvoll und schön.
Graphit
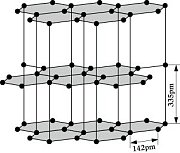
Struktur:
Die Struktur der Ebenen ist hexagonal bzw. die Ebenen sind Wabenförmig, wobei Jedes C-Atom 3 Elektronenpaarbindungen hat. Die Ebenen untereinander sind nur locker über Van-der-Waals-Kräfte miteinander Verbunden. Die Bindungen zwischen den Atomen, welche in der Ebene liegen sind relativ stark. Im Gegensatz dazu ist die Bindungsenergie zwischen den einzelnen Schichten deutlich geringer.
Eigenschaften:
- Graphit ist elektrisch Leitfähig → Er enthält elektrisch geladene Teilchen, welche sich frei bewegen können. Es handelt sich hierbei um die Valenzelektronen, welche sich zwischen den Graphitschichten aufhalten (Siehe Bild der Graphitstruktur).
- Graphit kann, im Gegensatz zu Diamant, Licht absorbieren und ist deshalb schwarz → Die Ursache dieses Phänomens sind die schwach gebundenen Elektronen.
- Graphit hat ebenfalls einen sehr hohen Schmelzpunkt (4000°C) → Auch Graphit besteht aus Riesenmolekülen.
- Die Graphitschichten lassen sich aufgrund der schwachen Kräfte schichtweise abtragen.
- Graphit ist weich und hat eine viel niedrigere Dichte (2,26 g/cm3) als Diamant → Diese Tatsache ist aufgrunde der verschiedenen Gitterstrukturen zu erklären.
Verwendung:
- Als Mine von Bleistiften
- Als Aktivkohle (In Gasmasken, Tabletten etc.)
- Bei einer Elektrolyse (Der Graphit wird dabei als Elektroden verwendet)
- Als Schmiermittel
Bei diesen Punkten spielt die Tatsache eine Rolle, dass zwischen den Schichten im Graphitgitter grosse Abstände herrschen, wodurch sich die einzelnen Schichten leicht abtragen lassen.
B) Schwefel
Schwefel kommt in der Natur sowohl in elmentarer Form, als auch in Verbindungen vor. In den USA, Mexiko, Sizilien, Japan und Polen sind riesige Lager elementaren Schwefels zu finden. Als Verbindung ist er in zahlreichen Mineralien und in einigen Schwermetallen zu finden. Interessant ist die Tatsache, dass Schwefel das Element mit der grössten Vielfallt an Strukturen ist.
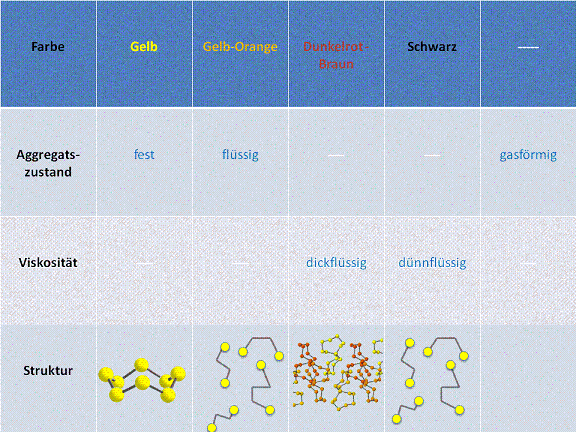
Erhitzen von Schwefel:
Die Veränderung der Strukturen beim Erhitzen liefert wichtige Zusammenhänge zwischen der Struktur und den Eigenschaften
Die Temperatur nimmt von links nach rechts immer weiter zu.
- 1. Bei Raumtemperatur ist der Schwefel gelb und fest. Die Schwefelmoleküle bestehen aus 8 S-Atomen, welche ringförmig angeordnet sind. Die Struktur des Schwefels in diesem Zustand kann man sich als Krone vorstellen.
- 2. Wird der Schwefel nun erhitzt, beginnt er bei ca. 119°C zu schmelzen. Dabei bleibt die Farbe noch gelb und auch an der Struktur verändert sich noch nichts. Erst nach einiger Zeit verändert sich die Farbe schliesslich in ein gelb-orange und die S-Atome, welche zuvor noch Kronförmig angeordnet waren, fallen nun auseinander und bilden kleinere Molekülketten. Die Bindungen brechen also, womit die Veränderung der Farbe zu erklären ist.
- 3. Nach einer weiteren Phase des Erhitzens, wird der Schwefel wieder dickflüssig und seine Farbe ändert sich in ein dunkelrot-braun. Die zuvor noch kurzen Molekülketten verbinden sich nun zu langen Molekülketten, was die Dickflüssigkeit des Schwefels verursacht.
- 4. Erhitzt man den Schwefel weiter, wird er wieder dünnflüssig und er wird langsam schwarz. Der Grund, weshalb der Schwefel wieder dünnflüssig wird, ist folgender: Durch die nun bereits sehr hohe Temperatur findet ein Bindungsbruch der langen Molekülketten statt. Das heisst, die langen Molekülketten "zerbrechen" in kürzere Molekülketten und es besteht wieder eine Situation wie bei Punkt 2.
- 5. Wird schlussendlich eine Temperatur von ca. 445°C erreicht, wird der Schwefel gasförmig.
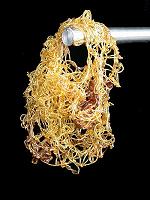
Plastischen Schwefel herstellen:
Es gibt eine Möglichkeit, plastischen Schwefel herzustellen, sowie er im dem Bild auf der rechten Seite erkennbar ist. Dazu muss neben dem Erwärmen nicht mehr viel getan werden. Es reicht, wenn der flüssige, heisse Schwefel in einer kalten Flüssigkeit wie zum Beispiel Wasser abgeschreckt wird. Das heisst man beschleunigt einfach den Mechanismus des Abkühlens. Dadurch, dass die langen Molekülketten, wie sie im flüssigen Zustand vorhanden sind, keine Zeit haben, wieder eine kronenförmige Struktur einzugehen, bleiben sie vorhanden und bewirken so, dass der Schwefel plastisch wird.
Phosphor
Für Phosphor gibt es 2 Modifikationen:
Weisser Phosphor
Weißer Phosphor ist die flüchtigste und reaktivste Modifikation des Phosphors. Er ist durchscheinend und wachsartig. In fein verteiltem Zustand entzündet sich weißer Phosphor an der Luft von selbst.
Mehrstündiges Erhitzen von weißem Phosphor auf etwa 260 °C unter Luftabschluss führt zu rotem Phosphor
Die Struktur von Phosphor weist eine Tetraederfrom auf.
Roter Phosphor
Der rote Phosphor ist schichtweise angeordnet (wie Graphit).
Halogene
Als Halogene bezeichnet man die Nichtmetalle der 7.Hauptgruppe gleich vor den Edelgasen. Ihnen fehlt nur noch ein Elektron zur vollen Valenzschale weshalb sie sehr reaktionsfreudig sind. Die Halogene bilden sehr häufig Salze in Verbindung mit Metallen (Halogene = Salzbildner), weshalb sie in der Natur nicht in elementarer Form vorzufinden sind. Dies wird durch die Summenformeln verdeutlicht: F2, Cl2, etc.
Zu den Halogenen gehören Fluor, Chlor, Brom, Iod und Astat (siehe Übersicht).Die Reaktionsfreudigkeit, beziehungsweise die Ionisierungseneregie und die Elektronegativität (siehe polare Bindung) ist bekanntlich rechtsoben im Periodensytem am grössten, also bei Fluor welches das Element mit den stärksten Anziehungskräften ist. Mit zunehmendere Anzahl Schalen sinkt diese Anziehungskraft und somit auch die Reaktionsfreudigkeit von Fluor nach Astat immer mehr.
Edelgase
Als Edelgase werden die Elemente der 8. Hauptgruppe des Periodensystems bezeichnet. Es sind die Elemente: Helium, Neon, Argon, Krypton, Xenon und Radon. Alle Edelgase sind farb- und geruchlose, nicht brennbare und kaum wasserlösliche Gase. Edelgase haben nicht die Tendenz dazu, Elektronen aufzunehmen → Es ist kein Platz mehr in der Valenzschale vorhanden. Edelgase haben nicht die Tendent dazu, Elektronen abzugeben → Die Valenzelektronen werden sehr stark angezogen.
Ihre Atome weisen in der Außenschale acht Elektronen auf. Eine Ausnahme dabei ist Helium, das nur zwei Elektronen in der Außenschale besitzt; da die erste Schale nicht mehr Elektronen binden kann, hat das Atom trotzdem ebenfalls die höchstmögliche Anzahl an Außenelektronen. Edelgase erfüllen als einzige alleinstehende Atome die Oktettregel, was zur Folge hat, dass sie reaktionsunfähig sind.
Beispiele:
Xenon-Leuchten (weil sie nicht reagieren)
Quellen
- Chemieunterlagen
- Bild Diamantstruktur: http://upload.wikimedia.org/wikipedia/commons/2/22/Diamond_Cubic-F_lattice_animation.gif
- Bild Graphitstruktur: http://www.wissenschaft-online.de/sixcms/media.php/912/thumbnails/127575.jpg.352147.jpg
- 2 Bilder + Textteile Schwefel: http://www.cumschmidt.de/sm_schwefel.htm