Eigenschaften von Salzen: Unterschied zwischen den Versionen
| (9 dazwischenliegende Versionen von einem anderen Benutzer werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
| + | [[image:Meersalz.jpg|thumb|right|Gewinnung von Salz - Salz ist für jedes Lebewesen notwendig, zuviel kann aber zum Tod führen]] | ||
Die Eigenschaften der Salze zeichnen sich durch hohe Schmelz- und Siedepunkte aus. Sie sind sehr hart, aber spröde. Salze bestehen aus Ionen, die sich durch ionische Bindungen zusammenhalten. Nur Salzlösungen und geschmolzene Salze leiten den Strom. Häufig besitzen sie eine gute Löslichkeit in Wasser ([[Die Löslichkeit von Salzen]]). | Die Eigenschaften der Salze zeichnen sich durch hohe Schmelz- und Siedepunkte aus. Sie sind sehr hart, aber spröde. Salze bestehen aus Ionen, die sich durch ionische Bindungen zusammenhalten. Nur Salzlösungen und geschmolzene Salze leiten den Strom. Häufig besitzen sie eine gute Löslichkeit in Wasser ([[Die Löslichkeit von Salzen]]). | ||
== Schmelz- und Siedetemperaturen == | == Schmelz- und Siedetemperaturen == | ||
| − | Durch die Struktur des Ionengitters sind Salze bei Raumtemperatur immer Feststoffe. Ihre hohen Schmelz- und Siedepunkte (Bsp. Schmelzpunkt (T<sub>m</sub>) von Na<sup>+</sup>Cl<sup>-</sup>: 801°C) zeigen, dass zwischen den Ionen im Gitter starke Anziehungskräfte wirken, diese sind sehr viel grösser als die Anziehungskräfte zwischen Molekülen. Die Schmelz- und Siedepunkte von Salzen steigen mit zunehmender | + | Durch die Struktur des Ionengitters sind Salze bei Raumtemperatur immer Feststoffe. Ihre hohen Schmelz- und Siedepunkte (Bsp. Schmelzpunkt (T<sub>m</sub>) von Na<sup>+</sup>Cl<sup>-</sup>: 801°C) zeigen, dass zwischen den Ionen im Gitter starke Anziehungskräfte wirken, diese sind sehr viel grösser als die Anziehungskräfte zwischen Molekülen. Die Schmelz- und Siedepunkte von Salzen steigen mit zunehmender Ionenladung, weil die Anziehungskräfte stärker werden. |
| − | |||
| − | + | == Härte == | |
| − | == | ||
[[image:Spalten_eines_Kochsalzkristalls.jpg|thumb|right|Abb. 1 Spalten eines Kochsalzkristalls]] | [[image:Spalten_eines_Kochsalzkristalls.jpg|thumb|right|Abb. 1 Spalten eines Kochsalzkristalls]] | ||
| − | Salze sind sehr hart aber brechen oft auseinander. Sie setzen sich aus Ionengittern zusammen, darin hat es positive Kationen (in Abb. 1 grün) und negative Anionen (in Abb. 1 grau). Wenn auf ein Ionengitter ein genug grosser Druck ausgeübt wird, kommt es zu einer Verschiebung der Gitterebenen und gleichgeladene Teilchen treffenaufeinander, welche sich gegenseitig abstossen. Das Ionengitter bricht auseinander. Diese spezielle Eigenschaft von Salzen nennt man Sprödigkeit. | + | Salze sind sehr hart aber brechen oft auseinander. Sie setzen sich aus Ionengittern ([[Bildung des Ionengitters]]) zusammen, darin hat es positive Kationen (in Abb. 1 grün) und negative Anionen (in Abb. 1 grau). Wenn auf ein Ionengitter ein genug grosser Druck ausgeübt wird, kommt es zu einer Verschiebung der Gitterebenen und gleichgeladene Teilchen treffenaufeinander, welche sich gegenseitig abstossen. Das Ionengitter bricht auseinander. Diese spezielle Eigenschaft von Salzen nennt man Sprödigkeit. |
| − | Salze sind | + | Salze sind hart und je höher die Gitterenergie eines Salzes, desto härter ist es, dies wird mit der Mohschen Härteskala (Tabelle unten) gemessen. Ein Rubin z.B. zählt zu den Edelsteinen und ist daher ein auch Salz, er hat einen Härtegrad von 9. Das heisst die Gitterenergie (Energie, die frei wird wenn das Gitter zerstört wird) ist sehr hoch und man muss viel Kraft aufwenden um ihn zu brechen. Noch härter ist beinahe nur noch der Diamant, dieser besitzt aber kein Ionengitter und ist somit kein Salz. |
| − | |||
{| class="wikitable" style="text-align:center" | {| class="wikitable" style="text-align:center" | ||
| Zeile 66: | Zeile 64: | ||
| + | == Mischkristallbildung == | ||
| − | + | Salze sind nicht gut mischbar. Denn Kationen und Anionen passen je nur mit ganz wenigen anderen Kationen und Anionen zusammen, denn im Ionengitter gibt es zwischen den gleich geladenen Ionen auch starke Abstossungskräfte. Damit also die Anziehungskräfte überwiegen, müssen Winkel und Abstände sehr genau übereinstimmen. "Unpassende" Ionen kann man also nur sehr schlecht in ein gegebenes Ionengitter einfügen. Und um ein Salz herzustellen braucht also es eine Art "Gitterfähigkeit". Wenn die Puzzleteilchen also nicht zusammenpassen kann sich kein Salz bilden. Deshalb werden nur selten Mischkristalle gebildet. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| Zeile 93: | Zeile 72: | ||
== Wasserlöslichkeit == | == Wasserlöslichkeit == | ||
| − | Salze sind oft gut wasserlöslich. Auch beim Lösen muss die Gitterenergie überwunden werden. Dennoch lösen sich viele Salze unter Energieabgabe bzw. ohne sichtbare äussere Energiezufuhr. Wassermoleküle sind | + | Salze sind oft gut wasserlöslich. Auch beim Lösen muss die Gitterenergie überwunden werden. Dennoch lösen sich viele Salze unter Energieabgabe bzw. ohne sichtbare äussere Energiezufuhr. Wassermoleküle sind Dipole und werden von den Salzionen angezogen. Die Energie, die bei der Ausbildung einer Hydrathülle frei wird nennt man Hydratationsenergie. Oft ist diese grösser, als die Gitterenergie oder nur wenig kleiner. Dann wird der fehlende Energiebetrag von der Wärmeenergie des Wassers geliefert. Ist die Gitterenergie aber viel grösser, so besitzen die Salze nur eine geringe Löslichkeit. |
| − | |||
| + | Weiteres über Löslichkeit von Salzen unter: [[Die Löslichkeit von Salzen]] | ||
== Leitfähigkeit == | == Leitfähigkeit == | ||
| − | [[image: | + | [[image:Kochsalz_geloest.jpg|thumb|right|(Abb. 3) gelöstes Kochsalz, indem Strom fliessen kann]] |
| − | Ein festes Salz besitzt keine | + | Ein festes Salz besitzt keine elektrische Leitfähigkeit, da die Teilchen in einem Gitter angeordnet sind. Die Leitfähigkeit setzt erst ein, wenn ein Salz gelöst oder geschmolzen ist. In diesen Zuständen sind die Teilchen geladen und frei beweglich, was die Voraussetzung für elektrische Leitfähigkeit ist. |
| − | |||
| − | |||
| Zeile 128: | Zeile 105: | ||
* http://de.academic.ru/pictures/dewiki/68/Diamond_Cubic-F_lattice_animation.gif (Abb. 2) | * http://de.academic.ru/pictures/dewiki/68/Diamond_Cubic-F_lattice_animation.gif (Abb. 2) | ||
* http://www.zum.de/Faecher/Materialien/beck/chemkurs/cs11-12.htm | * http://www.zum.de/Faecher/Materialien/beck/chemkurs/cs11-12.htm | ||
| + | * http://www.schule-bw.de/unterricht/faecher/nwt/unterrichtseinheiten/einheiten/salz_pics/loes.gif (Abb. 3) | ||
[[Kategorie: Chemie]] | [[Kategorie: Chemie]] | ||
Aktuelle Version vom 18. Mai 2020, 15:52 Uhr
Die Eigenschaften der Salze zeichnen sich durch hohe Schmelz- und Siedepunkte aus. Sie sind sehr hart, aber spröde. Salze bestehen aus Ionen, die sich durch ionische Bindungen zusammenhalten. Nur Salzlösungen und geschmolzene Salze leiten den Strom. Häufig besitzen sie eine gute Löslichkeit in Wasser (Die Löslichkeit von Salzen).
Inhaltsverzeichnis
Schmelz- und Siedetemperaturen
Durch die Struktur des Ionengitters sind Salze bei Raumtemperatur immer Feststoffe. Ihre hohen Schmelz- und Siedepunkte (Bsp. Schmelzpunkt (Tm) von Na+Cl-: 801°C) zeigen, dass zwischen den Ionen im Gitter starke Anziehungskräfte wirken, diese sind sehr viel grösser als die Anziehungskräfte zwischen Molekülen. Die Schmelz- und Siedepunkte von Salzen steigen mit zunehmender Ionenladung, weil die Anziehungskräfte stärker werden.
Härte
Salze sind sehr hart aber brechen oft auseinander. Sie setzen sich aus Ionengittern (Bildung des Ionengitters) zusammen, darin hat es positive Kationen (in Abb. 1 grün) und negative Anionen (in Abb. 1 grau). Wenn auf ein Ionengitter ein genug grosser Druck ausgeübt wird, kommt es zu einer Verschiebung der Gitterebenen und gleichgeladene Teilchen treffenaufeinander, welche sich gegenseitig abstossen. Das Ionengitter bricht auseinander. Diese spezielle Eigenschaft von Salzen nennt man Sprödigkeit.
Salze sind hart und je höher die Gitterenergie eines Salzes, desto härter ist es, dies wird mit der Mohschen Härteskala (Tabelle unten) gemessen. Ein Rubin z.B. zählt zu den Edelsteinen und ist daher ein auch Salz, er hat einen Härtegrad von 9. Das heisst die Gitterenergie (Energie, die frei wird wenn das Gitter zerstört wird) ist sehr hoch und man muss viel Kraft aufwenden um ihn zu brechen. Noch härter ist beinahe nur noch der Diamant, dieser besitzt aber kein Ionengitter und ist somit kein Salz.
| Mineral | Härte (Mohs) | Bemerkungen |
|---|---|---|
| Talk | 1 | mit Fingernagel schabbar |
| Gips oder Halit | 2 | mit Fingernagel ritzbar |
| Calcit (Kalkspat) | 3 | mit Kupfermünze ritzbar |
| Fluorit (Flussspat) | 4 | mit Taschenmesser|Messer gut ritzbar |
| Apatit oder Mangan | 5 | mit Messer noch ritzbar; das härteste menschliche Gewebe Zahnschmelz hat diesen Härtegrad |
| Orthoklas (Feldspat) | 6 | mit Stahlfeile ritzbar |
| Quarz | 7 | ritzt Fensterglas |
| Topas | 8 | |
| Rubin | 9 | Eine Varietät von Rubin ist Saphir |
| Diamant | 10 | härtestes natürlich vorkommendes Mineral; nur von sich selbst und (unter Hitzeeinwirkung) von Bornitrid ritzbar |
Mischkristallbildung
Salze sind nicht gut mischbar. Denn Kationen und Anionen passen je nur mit ganz wenigen anderen Kationen und Anionen zusammen, denn im Ionengitter gibt es zwischen den gleich geladenen Ionen auch starke Abstossungskräfte. Damit also die Anziehungskräfte überwiegen, müssen Winkel und Abstände sehr genau übereinstimmen. "Unpassende" Ionen kann man also nur sehr schlecht in ein gegebenes Ionengitter einfügen. Und um ein Salz herzustellen braucht also es eine Art "Gitterfähigkeit". Wenn die Puzzleteilchen also nicht zusammenpassen kann sich kein Salz bilden. Deshalb werden nur selten Mischkristalle gebildet.
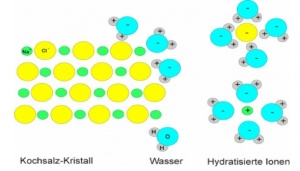
Wasserlöslichkeit
Salze sind oft gut wasserlöslich. Auch beim Lösen muss die Gitterenergie überwunden werden. Dennoch lösen sich viele Salze unter Energieabgabe bzw. ohne sichtbare äussere Energiezufuhr. Wassermoleküle sind Dipole und werden von den Salzionen angezogen. Die Energie, die bei der Ausbildung einer Hydrathülle frei wird nennt man Hydratationsenergie. Oft ist diese grösser, als die Gitterenergie oder nur wenig kleiner. Dann wird der fehlende Energiebetrag von der Wärmeenergie des Wassers geliefert. Ist die Gitterenergie aber viel grösser, so besitzen die Salze nur eine geringe Löslichkeit.
Weiteres über Löslichkeit von Salzen unter: Die Löslichkeit von Salzen
Leitfähigkeit
Ein festes Salz besitzt keine elektrische Leitfähigkeit, da die Teilchen in einem Gitter angeordnet sind. Die Leitfähigkeit setzt erst ein, wenn ein Salz gelöst oder geschmolzen ist. In diesen Zuständen sind die Teilchen geladen und frei beweglich, was die Voraussetzung für elektrische Leitfähigkeit ist.
Quellen
- Chemieunterlagen
- Romeo Scheidegger, Allg. u. Anorg. Chemie (2006) 6.3.2. Charakteristische Eig. v. Salzen
- http://de.academic.ru/pictures/dewiki/68/Diamond_Cubic-F_lattice_animation.gif (Abb. 2)
- http://www.zum.de/Faecher/Materialien/beck/chemkurs/cs11-12.htm
- http://www.schule-bw.de/unterricht/faecher/nwt/unterrichtseinheiten/einheiten/salz_pics/loes.gif (Abb. 3)