Aufbauprinzip der Elektronenhülle: Unterschied zwischen den Versionen
| (6 dazwischenliegende Versionen von 3 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
| − | Die Elektronenhülle wird auch Atomhülle genannt. Alle in der Chemie wichtigen Eigenschaften hängen vom Aufbau der Elektronenhülle ab. Denn bei einer chemischen Reaktion gibt es einzig eine Veränderung der äussersten Elektronen, im Atomkern passiert nichts. | + | Die Elektronenhülle wird auch Atomhülle genannt. Alle in der Chemie wichtigen Eigenschaften hängen vom Aufbau der |
| + | Elektronenhülle ab. Denn bei einer chemischen Reaktion gibt es einzig eine Veränderung der äussersten Elektronen, im Atomkern | ||
| + | passiert nichts. | ||
| + | == Das Aufbauprinzip der Elektronenhülle == | ||
| + | === Das Energiediagramm === | ||
| + | [[Bild:Energiediagramm.JPG|thumb| Energiediagramm]] | ||
| − | == | + | ==== Schalen ==== |
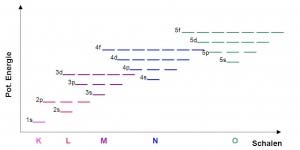
| − | + | Durch die Quantisierung der Energie kommen Elektronen nur in ganz bestimmten Energieniveaux um den Atomkern vor. Wir nennen diese Spähren oder Schalen. In einer Schale können sich mehrere Elektronen aufhalten. Die verschiedenen Schalen werden, vom Atomkern nach aussen, als K, L , M, N und O-Schalen bezeichnet. | |
| − | + | Die Vorstellung, dass sich die Elektronen in Kreisbahnen um den Atomkern bewegen ist vermutlich falsch. Man nimmt heute an, dass es Raumbereiche gibt, in welchen die Elektronen mit einer bestimmten Wahrscheinlichkeit anzutreffen sind. | |
| − | + | ==== Unterschalen ==== | |
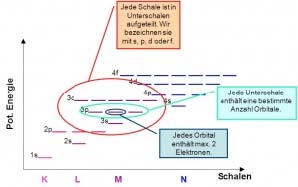
| − | + | Es wird weiter jede Schale in Unterschalen geteilt. Diese Unterschalen werden als s, p, d und f-Unterschalen bezeichnet. Die maximale mögliche Anzahl Elektronen einer jeweiligen Unterschale ist immer gleich. | |
| + | ==== Orbitale ==== | ||
| + | [[Bild:Unterschalen.JPG|thumb| Energiediagramm ]] | ||
| + | Als Orbitale bezeichnet man Raumbereiche in welchen eine grosse Wahrscheinlichkeit besteht die Elektronen anzutreffen. Dabei sind die Orbitale nicht mit den Unterschalen zu verwechseln. Ein Orbital kann immer von zwei Elektronen mit unterschiedlichem Spin besetzt sein. Das heisst eine p-Unterschale setzt sich aus drei Orbitalen zusammen, eine d-Unterschale aus fünf und eine f-Unterschale aus sieben. | ||
| + | Jede Elektronenhülle besteht also mindestens aus der K-Schale mit der 1s-Unterschale und dem 1s-Orbital mit mindestens einem Elektron. Dies ist der Fall beim Wasserstoffatom. | ||
| + | ==== Überlappung der Unterschalen ==== | ||
| + | [[Bild:Ueberlappung.JPG|thumb| Energiediagramm ]] | ||
| + | Der Energieabstand zwischen den Schalen wird mit zunehmendem Abstand zum Kern immer geringer. Dies führt dazu, dass sich die Energieniveaus der Schalen überschneiden: Bei der M-Schale haben wir eine s-, eine p- und eine d-Unterschale. Die 3d-Unterschale liegt aber energetisch höher als die 4s-Unterschale. | ||
| + | Die Elektronen nehmen den wahrscheinlichsten und energiegünstigsten Zustand ein und besetzten also die 4s-Unterschale vor der 3d-Unterschale. Das selbe Prinzip gilt für alle d- und s-Unterschalen und dies führt dazu, dass in der äussersten Schale maximal 8 Elektronen vorkommen können, welche sich immer in der s- und p-Unterschale befinden. | ||
| + | Diese 8 Aussenelektronen oder auch Valenzelektronen sind nicht so stark gebunden wie die Elektronen in den inneren Unterschalen und sind somit von Bedeutung bei chemischen Reaktionen. | ||
| − | == | + | === Aufbaugesetze === |
| − | + | Im Wesentlichen gibt es bei der Verteilung der Elektronen auf die Elektronenhülle drei Grundprinzipien die zu beachten sind: | |
| − | + | *Energieprinzip | |
| − | + | *Pauliprinzip | |
| − | + | *Hund‘sche Regel | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| + | ==== Das Energieprinzip ==== | ||
| + | Alle Elektronen werden vom Atomkern angezogen. Die Coulomb-Kraft sorgt dafür, dass jene Elektronen, die näher beim Kern sind, stärker angezogen werden und diese sind auch energieärmer. Die äusseren Elektronen sind energiereicher und werden nicht so stark vom Kern angezogen. Trotz der Anziehungskräfte fallen sie nicht in den Kern. Grund dafür ist der Wellencharakter der Elektronen der durch die Quantisierung der Energie zustande kommt. Elektronen können sich nur in bestimmten Feldern um den Atomkern bewegen, in welchen sie in positiver Interferenz schwingen und somit in stabiler Lage bleiben können. | ||
| + | ==== Das Pauliprinzip ==== | ||
| + | Das Pauliprinzip besagt, dass pro Orbital maximal zwei Elektronen mit | ||
| + | umgekehrtem Spin vorhanden sein können. Der „Spin“ der Elektronen lässt | ||
| + | sich als Drehung des Elektrons, um die eigene Achse deuten. Befinden sich | ||
| + | zwei Elektronen im gleichen Orbital, so muss der Spin unterschiedlich sein. | ||
| + | ==== Die Hund‘sche Regel ==== | ||
| + | [[Bild:Hundscheregel.JPG|thumb|Energiediagramm]] | ||
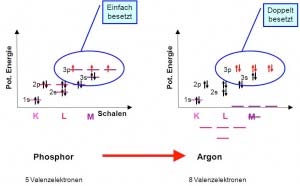
| + | Bei der Besetzung von energiegleichen Orbitalen, also von Orbitalen die sich in | ||
| + | der gleichen Unterschale befinden, gibt es folgende Regel: Jedes Orbital wird | ||
| + | erst einfach besetzt und erst anschliessend kommt das zweite Elektron dazu. | ||
| + | Diese Regel nennt man die Hund’sche Regel. Sie wird durch die gleiche | ||
| + | Ladung der Elektronen bestimmt. Wie bekannt, stossen sich gleiche Ladungen | ||
| + | ab, weshalb Elektronen versuchen so weit wie möglich voneinander entfernt zu sein. So werden durch diese Abstossung zuerst alle | ||
| + | Orbitale einfach besetzt und erst dann aufgefüllt. | ||
== Quellen == | == Quellen == | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| + | *Chemieunterlagen | ||
| + | *Elemente; Magyar, Liebhart, Jelinek; öbv&hpt Verlag; 2. Auglage, Nachdruck 2005 | ||
| + | *http://www.energiewelten.de/elexikon/lexikon/seiten/htm/020202_Atomhuelle_und_Atomkern_Kernphysik.htm | ||
| + | *http://www.pas-berlin.de/chemie/ch-e1/atombau/atombau.html | ||
| + | *http://www.chempage.de/theorie/atome.htm | ||
| + | *http://www.hamburger-bildungsserver.de/welcome.phtml?unten=/klima/energie/enk-12.html | ||
| + | *http://www.tgs-chemie.de/nebeng5.gif | ||
== Weblinks == | == Weblinks == | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | *Swisseduc (http://swisseduc.ch/chemie/) – Unterrichtsserver für Chemie | |
| + | *Mediawiki Hilfeseite (http://meta.wikimedia.org/wiki/Help:Contents#For_editors) – So kann der Link näher beschrieben | ||
| + | werden | ||
Aktuelle Version vom 6. Juni 2010, 20:19 Uhr
Die Elektronenhülle wird auch Atomhülle genannt. Alle in der Chemie wichtigen Eigenschaften hängen vom Aufbau der Elektronenhülle ab. Denn bei einer chemischen Reaktion gibt es einzig eine Veränderung der äussersten Elektronen, im Atomkern passiert nichts.
Inhaltsverzeichnis
Das Aufbauprinzip der Elektronenhülle
Das Energiediagramm
Schalen
Durch die Quantisierung der Energie kommen Elektronen nur in ganz bestimmten Energieniveaux um den Atomkern vor. Wir nennen diese Spähren oder Schalen. In einer Schale können sich mehrere Elektronen aufhalten. Die verschiedenen Schalen werden, vom Atomkern nach aussen, als K, L , M, N und O-Schalen bezeichnet.
Die Vorstellung, dass sich die Elektronen in Kreisbahnen um den Atomkern bewegen ist vermutlich falsch. Man nimmt heute an, dass es Raumbereiche gibt, in welchen die Elektronen mit einer bestimmten Wahrscheinlichkeit anzutreffen sind.
Unterschalen
Es wird weiter jede Schale in Unterschalen geteilt. Diese Unterschalen werden als s, p, d und f-Unterschalen bezeichnet. Die maximale mögliche Anzahl Elektronen einer jeweiligen Unterschale ist immer gleich.
Orbitale
Als Orbitale bezeichnet man Raumbereiche in welchen eine grosse Wahrscheinlichkeit besteht die Elektronen anzutreffen. Dabei sind die Orbitale nicht mit den Unterschalen zu verwechseln. Ein Orbital kann immer von zwei Elektronen mit unterschiedlichem Spin besetzt sein. Das heisst eine p-Unterschale setzt sich aus drei Orbitalen zusammen, eine d-Unterschale aus fünf und eine f-Unterschale aus sieben.
Jede Elektronenhülle besteht also mindestens aus der K-Schale mit der 1s-Unterschale und dem 1s-Orbital mit mindestens einem Elektron. Dies ist der Fall beim Wasserstoffatom.
Überlappung der Unterschalen
Der Energieabstand zwischen den Schalen wird mit zunehmendem Abstand zum Kern immer geringer. Dies führt dazu, dass sich die Energieniveaus der Schalen überschneiden: Bei der M-Schale haben wir eine s-, eine p- und eine d-Unterschale. Die 3d-Unterschale liegt aber energetisch höher als die 4s-Unterschale. Die Elektronen nehmen den wahrscheinlichsten und energiegünstigsten Zustand ein und besetzten also die 4s-Unterschale vor der 3d-Unterschale. Das selbe Prinzip gilt für alle d- und s-Unterschalen und dies führt dazu, dass in der äussersten Schale maximal 8 Elektronen vorkommen können, welche sich immer in der s- und p-Unterschale befinden.
Diese 8 Aussenelektronen oder auch Valenzelektronen sind nicht so stark gebunden wie die Elektronen in den inneren Unterschalen und sind somit von Bedeutung bei chemischen Reaktionen.
Aufbaugesetze
Im Wesentlichen gibt es bei der Verteilung der Elektronen auf die Elektronenhülle drei Grundprinzipien die zu beachten sind:
- Energieprinzip
- Pauliprinzip
- Hund‘sche Regel
Das Energieprinzip
Alle Elektronen werden vom Atomkern angezogen. Die Coulomb-Kraft sorgt dafür, dass jene Elektronen, die näher beim Kern sind, stärker angezogen werden und diese sind auch energieärmer. Die äusseren Elektronen sind energiereicher und werden nicht so stark vom Kern angezogen. Trotz der Anziehungskräfte fallen sie nicht in den Kern. Grund dafür ist der Wellencharakter der Elektronen der durch die Quantisierung der Energie zustande kommt. Elektronen können sich nur in bestimmten Feldern um den Atomkern bewegen, in welchen sie in positiver Interferenz schwingen und somit in stabiler Lage bleiben können.
Das Pauliprinzip
Das Pauliprinzip besagt, dass pro Orbital maximal zwei Elektronen mit umgekehrtem Spin vorhanden sein können. Der „Spin“ der Elektronen lässt sich als Drehung des Elektrons, um die eigene Achse deuten. Befinden sich zwei Elektronen im gleichen Orbital, so muss der Spin unterschiedlich sein.
Die Hund‘sche Regel
Bei der Besetzung von energiegleichen Orbitalen, also von Orbitalen die sich in der gleichen Unterschale befinden, gibt es folgende Regel: Jedes Orbital wird erst einfach besetzt und erst anschliessend kommt das zweite Elektron dazu. Diese Regel nennt man die Hund’sche Regel. Sie wird durch die gleiche Ladung der Elektronen bestimmt. Wie bekannt, stossen sich gleiche Ladungen ab, weshalb Elektronen versuchen so weit wie möglich voneinander entfernt zu sein. So werden durch diese Abstossung zuerst alle Orbitale einfach besetzt und erst dann aufgefüllt.
Quellen
- Chemieunterlagen
- Elemente; Magyar, Liebhart, Jelinek; öbv&hpt Verlag; 2. Auglage, Nachdruck 2005
- http://www.energiewelten.de/elexikon/lexikon/seiten/htm/020202_Atomhuelle_und_Atomkern_Kernphysik.htm
- http://www.pas-berlin.de/chemie/ch-e1/atombau/atombau.html
- http://www.chempage.de/theorie/atome.htm
- http://www.hamburger-bildungsserver.de/welcome.phtml?unten=/klima/energie/enk-12.html
- http://www.tgs-chemie.de/nebeng5.gif
Weblinks
- Swisseduc (http://swisseduc.ch/chemie/) – Unterrichtsserver für Chemie
- Mediawiki Hilfeseite (http://meta.wikimedia.org/wiki/Help:Contents#For_editors) – So kann der Link näher beschrieben
werden