Repetition: Grundbegriffe: Unterschied zwischen den Versionen
K (1 Version) |
|
(kein Unterschied)
| |
Aktuelle Version vom 7. Oktober 2008, 18:22 Uhr
Grundlagen: Begriffe, die im Unterricht oft vorkommen und oft gebraucht werden.
Inhaltsverzeichnis
Stoffe und ihre Eigenschaften
Stoff – Gegenstand
Chemische Stoffe erkennt man an ihren Eigenschaften. Diese sind von der Grösse und Gestalt der Gegenstände unabhängig und bei festgelegten Bedingungen (Druck, Temperatur) konstant.
Eigenschaften
Die physikalischen Eigenschaften eines Stoffs lassen sich messen oder beobachten, ohne dass sich der Stoff verändert. Wichtige physikalische Eigenschaften sind:
• Schmelztemperatur Tm und Siedetemperatur Tb
(to melt (engl.): schmelzen, to boil: kochen)
• Glanz, Farbe, Geruch
• Dichte, Härte, Verformbarkeit, Leitfähigkeit für Strom und Wärme
• Löslichkeit in einem bestimmten Lösungsmittel (z.B. Wasser), Kristallform
Normbedingungen
Die Normbedingungen, bei denen die Eigenschaften eines Stoffs normalerweise gemessen werden, sind:
Temperatur: T = 0˚C (273 Kelvin)
Druck: p = 1013 hPa (= 1,013 bar, = 1 Atmosphäre)
Dichte
Die Dichte eines Stoffs ist die Masse, die in einem cm3 enthalten ist. Sie ist von T und p abhängig.
Dichte = Masse/Volumen r = m/V (r : (gr.): rho)
Einheit: g/cm3
Härte
Die Härte eines festen Stoffs wird durch den Vergleich der Ritzbarkeit mit den Vergleichssubstanzen der Härteskala nach Mohs bewertet. Die Skala reicht von Talk mit Härte 1 bis Diamant mit Härte 10.
Teilchenmodell
Stoffe bestehen aus kleinsten Teilchen, die sich ständig bewegen. Die Geschwindigkeit nimmt mit steigender Temperatur zu. Es gibt drei Arten kleinster Teilchen:
Atome
Edelgase bestehen aus einzelnen Atomen (z.B. Helium). Atome sind nicht elektrisch geladen.
Moleküle
Moleküle sind Teilchen aus mehreren miteinander verbundenen Atomen. Wasser besteht z.B. aus Molekülen.
Ionen
Ionen sind elektrisch geladene Teilchen. Diese können einzelne Atome oder mehrere verbunden Atome sein. Salze bestehen aus positiv und negativ geladenen Ionen.
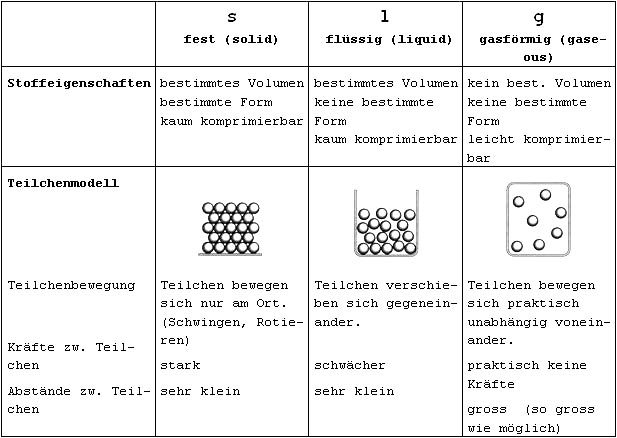
Aggregatszustände
Stoffe können je nach Druck und Temperatur im festen (s), flüssigen (l) oder gasförigen (g) Zustand vorliegen.
Änderungen des Aggregatszustandes sind mit Energieumsatz verbunden:
Schmelzen und Verdampfen / Verdunsten bewirken eine Abkühlung, Kondensieren und Erstarren bewirken eine Erwärmung.
Kristalle
Kristalle sind feste Körper, die von regelmässig angeordneten ebenen Flächen begrenzt sind. Sie sind die sichtbare Folge der regelmässigen Teilchenanordnung im Gitter. Die meisten Feststoffe sind kristallin. Kristalle bilden sich beim Erstarren einer Flüssigkeit oder beim Eindampfen einer Lösung, die einen Feststoff enthält („Kristallzucht“)
Fragen
1. Welche der folgenden Begriffe bezeichnen Stoffe? (Richtiges ankreuzen)
O Zucker O Eisenrad O Wasser O Schnur O Blei O Kalk O Papierblatt
2. Welche der folgenden Eigenschaften sind Stoffeigenschaften?
O Umfang O Geschmack O Härte O Volumen O Masse O Glanz O Temperatur O Geruch O Elastizität O Farbe
3. Warum schwimmt ein schweres Stück Holz im Wasser, während eine viel leichtere Eisenkugel untergeht?
4. Warum kann sich das Wasser eines Sees erwärmen, ohne sich mit dem kälteren Wasser der unteren Schichten zu vermischen?
5. Tragen Sie die Abkürzungen für die Einheit bei jeder Grösse ein und ergänzen Sie die Felder der Tabelle mit ja oder nein:
6. Wie müsste folgende Aussage ergänzt werden: „Festkörper haben ein konstantes Volumen“?
7. Warum werden wohl kälteempfindliche Kulturen in kalten Frühlingsnächten beregnet?
Tip: Das Wasser gefriert auf der Pflanzenoberfläche.
8. Erklären Sie mit Hilfe des Teilchenmodells, warum sich beim Verdampfen einer Flüssigkeit das Volumen, aber nicht die Masse ändert.
Chemische Reaktionen
Physikalischer Vorgang
Die beteiligten Stoffe verändern sich nicht. Ihre Eigenschaften bleiben identisch. z.B. Brechen von Holz, Sieden von Wasser
Chemischer Vorgang
Bei chemischen Vorgängen werden Stoffe umgewandelt, d.h. aus den Ausgangsstoffen (Edukte) entstehen Endstoffe (Produkte) mit neuen Eigenschaften . Edukte reagieren immer in einem bestimmten Massenverhältnis miteinander. Stimmt das Massenverhältnis bei einer Reaktion nicht, bleibt nach der Reaktion eine gewisse Menge der überschüssigen Edukte übrig.
Reaktionsgleichung
Eine chemische Reaktion kann durch eine Reaktionsgleichung beschrieben werden, z.B.:
2 H2 + O2 → 2 H2O
Wasserstoff und Sauerstoff reagieren zu Wasser
Beim Aufstellen einer Reaktionsgleichung müssen zuerst die Formeln der Edukte und Produkte aufgeschrieben werden (Wasserstoff kommt als H2, Sauerstoff als O2, und Wasser als H2O vor) . Anschliessend muss die Reaktionsgleichung ausgeglichen werden, d.h. die Art und Anzahl der Atome müssen bei den Edukten und Produkten gleich sein. Dazu verändert man die sog. „stöchiometrischen Faktoren“, d.h. die Anzahl der beteiligten Teilchen, bis diese Bedingung erfüllt ist. (Stöchiometrie: chemisches Rechnen).
Energie
Als Energie bezeichnet man die Fähigkeit eines Systems, Arbeit zu leisten. Verschiedene Energieformen wie Wärme, Licht, chemische, elektrische oder mechanische Energie können ineinander umgewandelt werden. Energie kann weder hergestellt noch zerstört werden!
Energieinhalt
Jedem Stoff kann eine bestimmte Energie zugeordnet werden (chemische Energie) Sie ist von der Stoffart und der Masse abhängig.
Energieumsatz
Bei jeder chemischen Reaktion wird Energie umgesetzt, was z.B. zu Aenderungen der Temperatur oder zu Lichterscheinungen führt.
exotherm
Das Reaktionssystem gibt Energie an die Umgebung ab (ex (lat.): aus, d.h. „Energie geht aus dem System weg“). Dies führt meist zu einer Erwärmung.
Ursache: Die Edukte sind energiereicher als die Produkte und die „Ueberschussenergie“ wird abgegeben.
endotherm
Das Reaktionssystem nimmt Energie aus der Umge-bung auf (endo (lat.): in, hinein), d.h. „Energie wird aus der Umgebung ins System aufgenommen“. Dies führt meist zu einer Abkühlung.
Ursache: Die Edukte sind energieärmer als die Produkte. Die „fehlende Energie“ wird aus der Umgebung aufgenommen, die dadurch abkühlt.
Fragen
1. Welche der folgenden Aussagen sind richtig? (zutreffendes ankreuzen)
O Bei einem exothermen Vorgang muss Energie zugeführt werden.
O Bei einer endothermen Reaktion sind die Produkte energie-reicher als die Edukte.
O Die Edukte reagieren nur, wenn sie im richtigen Verhältnis gemischt sind.
O Bei einer Verbrennung sind die Produkte energieärmer als die Edukte
O Bei einem endothermen Vorgang wird der Umgebung Energie entzogen.
O Bei chemischen Vorgängen ändern die Stoffe ihre Eigenschaf-ten.
O Chemische Reaktionen sind Stoffumwandlungen.
O Bei der Verbrennung von Benzin entsteht Energie.
2. Nennen Sie drei physikalische und drei chemische Vorgänge und erklären Sie jeweils, woran man dies erkennt.
3. Gibt es Reaktionen, bei denen die Temperatur vor und nach der Reaktion gleich ist?
4. Eisen reagiert mit Chlor:
Fe + Cl2 → FeCl3
Stöchiometrisch stimmt die Gleichung noch nicht. Kann ich – um die Gleichung stöchiometrisch auszugleichen – statt FeCl3 FeCl2 schreiben? Begründen Sie ihre Aussage.
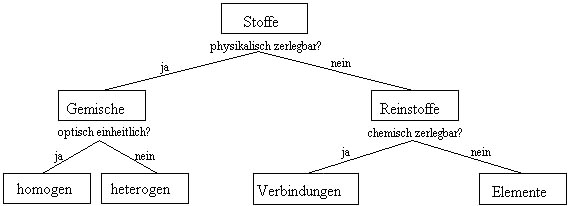
Einteilung der Stoffe
Arten von Gemischen
Gemische können nach den Aggregatszustand der beteiligten Stoffe eingeteilt werden (s: fest, l: flüssig, g: gasförmig), sowie in homogene und heterogene Gemische. In der untenstehenden Tabelle sind zusätzlich einige Fraktionierverfahren zur Trennung erwähnt. Sie werden anschliessend kurz beschrieben.
Trennung von Gemischen in Reinstoffe: Fraktionierverfahren
Fraktionierverfahren sind physikalische Verfahren, um die Reinstoffe eines Gemisches voneinander zu trennen. Jedes Fraktionierverfahren beruht auf einer Stoffeigenschaft, in der sich die zu trennenden Stoffe unterscheiden (sog. Trennkriterium). Die beteiligten Stoffe und ihre Eigenschaften ändern sich dabei nicht.
Fragen
1. Welche der folgenden Aussagen lassen erkennen, dass Luft ein Stoffgemisch ist? (zutreffendes ankreuzen)
O Luft kann durch Abkühlen verflüssigt werden.
O Verbrennt man Benzin in Luft, bleibt immer etwas Luft übrig.
O Die Dichte der Luft nimmt mit steigendem Druck zu.
2. Ordnen Sie die folgenden Stoffe ein: Zuckerwasser, Granit, Aluminium, Seifenwasser, Alkohol, Sauerstoff, Luft, Rauch
Reinstoffe:
Homogene Gemische:
Heterogene Gemische:
3. Durch welches Verfahren kann man ein Gemisch aus Aluminiumpulver und Kochsalz trennen? Beschreiben Sie Fraktionierverfahren und Trennkriterien.
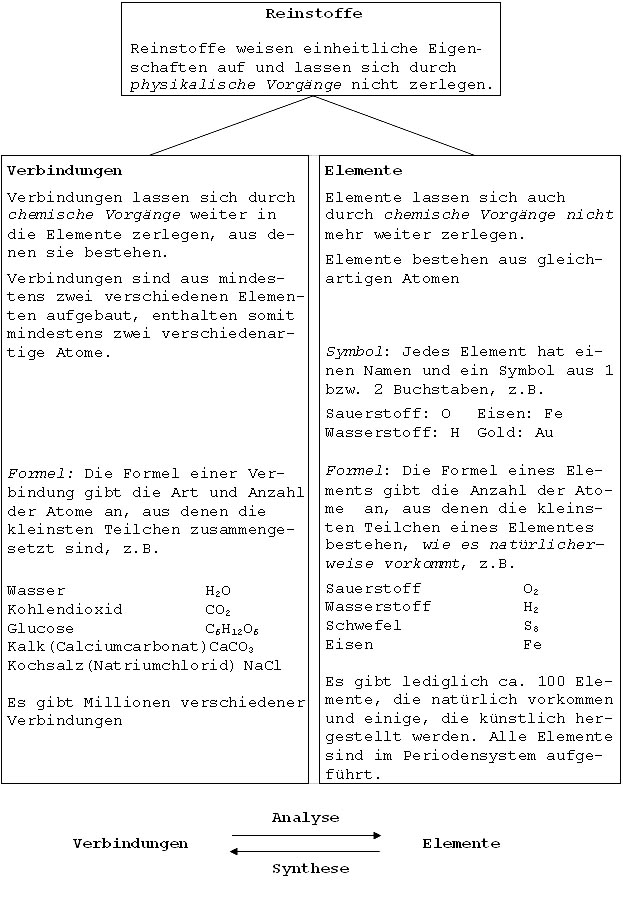
Arten von Reinstoffen
Analyse: Zersetzung einer Verbindung (in kleinere Verbindungen bzw. in die Elemente)
Synthese: Herstellung einer Verbindung (aus kleineren Verbindungen bzw. aus den Elementen)
Zusammenfassung: Einteilung von Stoffen
Fragen
1. Vor Ihnen stehen zwei Flaschen mit Flüssigkeiten. Die eine enthält einen Reinstoff, die andere ein homogenes Gemisch. Wie können Sie die beiden unterscheiden?
2. Ordnen Sie die Stoffe der folgenden Tabelle ein, indem Sie die richtigen Spalten ankreuzen.
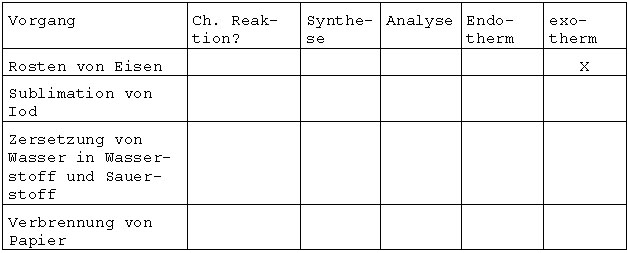
3. Ergänzen Sie die folgende Tabelle durch Kreuze in den zutreffenden Spalten