Die polare Bindung: Unterschied zwischen den Versionen
K (1 Version) |
|
(kein Unterschied)
| |
Version vom 7. Oktober 2008, 17:22 Uhr
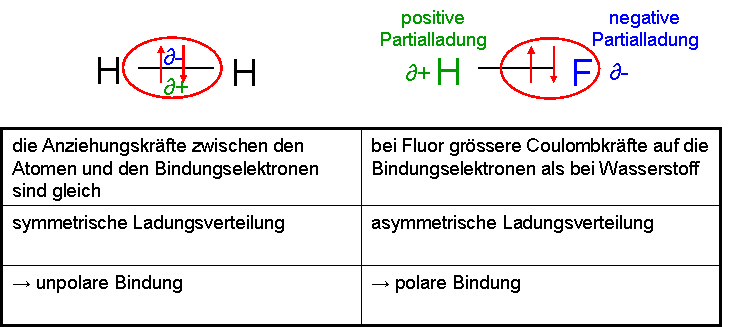
Unter einer polaren Bindung versteht man eine Bindung zwischen zwei Nichtmetallen (siehe Wichtige Nichtmetall-Elemente), welche untereinander eine stark unterschiedliche Elektronegativität aufweisen, dadurch entsteht eine asymmetrische Ladungsverteilung und somit zwei Pole → polare Bindung.
Inhaltsverzeichnis
Polare-unpolare Bindung
Die Elektronegativität
Definition
Die Elektronegativität (ΔEN) ist ein Mass für die Anziehungskraft eines Atoms. Kennt man die Anziehungskräfte beider Atome einer Bindung so lässt sich mit dem Unterschied dieser beiden Werte feststellen ob die Bindung polar oder unpolar ist.
Die Eletkronegativität der Nichtmetalle
(Lässt sich auch im Periodensystem ablesen)
→ die Edelgase haben keine Elektronegativität, weil sie ja bereits volle Schalle haben und deshalb keine weiteren Elektronen anziehen
Das Mass für Bindungspolarität: ΔEN
ΔEN = ENAtom 1- ENAtom 2
ΔEN > 0.5 → polare Bindung
Die Stärke der polaren Bindung
Die polare Bindung ist die stärkste Elektronenpaarbindung und somit auch die stärkste Bindung zwischen zwei Nichtmetallen.
→ polare Bindungen sind starke Bindungen
→ polare Bindungen sind leicht zu bilden
→ bei der Bildung der Bindung wird Energie frei
Quellen
-Chemie-Unterricht Notitzen
-Graphics made by Urs Wegmann