Die Löslichkeit von Salzen: Unterschied zwischen den Versionen
Armax (Diskussion | Beiträge) (→A) Löslichkeit: Ausgangslage) |
Armax (Diskussion | Beiträge) (→C) Exp.: Energetische Betrachtung) |
||
| Zeile 247: | Zeile 247: | ||
FOLIEN VON HERRN DEUBER: HIER!!!!!! | FOLIEN VON HERRN DEUBER: HIER!!!!!! | ||
| − | == C) | + | == C) Experiment: Energetische Betrachtung == |
'''Vorgehen:''' | '''Vorgehen:''' | ||
| − | [[Datei:Tabelle | + | [[Datei:Tabelle Salze1.png|700px|thumb|left|Messen der Temperatur beim Lösen einiger Salze (endotherm / exotherm)]] |
| + | |||
| Zeile 272: | Zeile 273: | ||
'''Ergebnisse:''' | '''Ergebnisse:''' | ||
| − | Es gibt sowohl gut lösliche Salze, die sich exotherm wie endotherm lösen | + | Es gibt sowohl gut lösliche Salze, die sich exotherm wie endotherm lösen. Wenn Delta H kleiner als Null ist, hat das System "Energie" aus dem Wasser aufgenommen, um die Gitterenergie des Salzes zu überwinden und hat somit dessen Temperatur gesenkt. Wenn es eine exotherme Reaktion ist, dann gibt die Reaktion, die Aufbrechung des Gitters, "Energie" an das umliegende Wasser ab, die Temperatur steigt und Delta H ist grösser als Null. |
| − | Bei | + | Bei schlecht löslichen Salzen ist die Gitterenergie zu gross und müsste zuerst überwunden werden bzw. kann gar nicht überwunden werden von den Wasserteilchen. |
== Wird gelöscht (Hydration) == | == Wird gelöscht (Hydration) == | ||
Version vom 21. Juni 2024, 09:51 Uhr
Aufgrund der starken Anziehungskräfte von Ionen sind Salze grundsätzlich nur in hydrophilen Lösungsmitteln löslich. Für die Löslichkeit allgemein: Siehe Löslichkeit
Inhaltsverzeichnis
- 1 Exp.: Wie lösen sich verschiedene Salze in Wasser ? Def. Löslichkeit
- 2 A) Löslichkeit: Ausgangslage
- 3 B) Lösungsvorgang von Salzen
- 4 C) Experiment: Energetische Betrachtung
- 5 Wird gelöscht (Hydration)
- 6 D) Faktoren, welche die Löslichkeit beeinflussen
- 7 E) Kristallwasser
- 8 F) Exsikkator
- 9 Quellen
- 10 Weblinks
Exp.: Wie lösen sich verschiedene Salze in Wasser ? Def. Löslichkeit
Vorgehen:
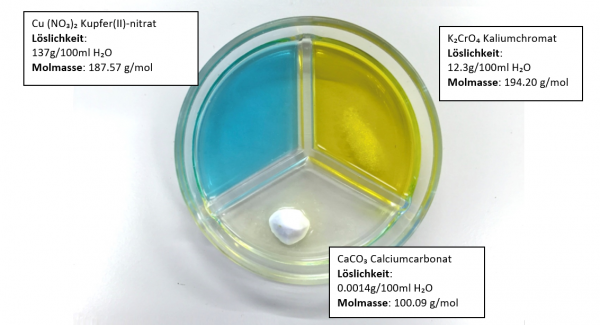
Von den drei Salzen Cu(NO₃)₂, K₂CrO₄ und CaCO₃ wird je gleich viel (ein Löffel) in eine dreigeteilte Petrischale gegeben. Diese Petrischale ist mit Wasser gefüllt. Welches Salz löst sich wie gut?
Ergebnis:
Cu(NO₃)₂ : hat sich komplett aufgelöst.
K₂CrO₄ : hat sich teilweise aufgelöst.
CaCO₃ : hat sich fast nicht aufgelöst.
Bei diesem Experiment erkennt man sehr grosse Unterschiede in der Löslichkeit von Salzen.
Das heisst: Salze lösen sich verschieden gut in Wasser.
A) Löslichkeit: Ausgangslage
Salze sind unterschiedlich gut löslich. Wir benötigen ein Mass für die Löslichkeit !
Definition:
Bei der Löslichkeit handelt es sich um die Eigenschaft, welche beschreibt ob und in welchem Umfang sich ein Salz in einem Lösungsmittel maximal löst.
Wenn die maximale Menge eines Salzes in einer Lösung gelöst ist, spricht man von einer gesättigten Lösung. Überschüssiges Salz wird als Bodensatz sichtbar.
Falls über die Löslichkeitsgrenze hinaus ein weiteres Salz hinzugefügt wird, kann dieses sich nicht mehr lösen und bildet ebenfalls einen Bodensatz.
Einheit:
Gramm pro Liter (g/L) oder Mol pro Liter (mol/L).
Umrechnung: von g/L in mol/L:
1. Molare Masse:
Um die Umrechnung durchführen zu können, braucht man die molare Masse. Diese gibt an, wie viel Gramm ein Mol des Stoffes wiegt und hat die Einheit Gramm pro Mol (g/mol).Diese findet man im Periodensystem, in dem man die Atommasse der gelösten Stoffes addiert.
2. Dreisatz Rechnung:
Die Konzentration in mol/L ist gesucht. Gegeben ist die molare Masse in g/mol.
Um die Konzentration einer Lösung in Mol pro Liter aus der Masse der Substanz in Gramm pro Mol zu berechnen, gehen wir in mehreren Schritten vor.
Zuerst rechnen wir die Anzahl Mol aus mit einer gegebenen Masse:
Molmasse Kupfer(II)-nitrat: 187.55g/mol
Über eine Dreisatz Rechnung kann man die Molanzahl der gewünschten Menge berechnen. Angenommen wir hätten 10 Gramm Kupfer(II)-nitrat gelöst.
187.55 g = 1 Mol
1 g = 0.00533191 Mol
10 g = 0.0533191 Mol
Dieses Ergebniss muss man jetzt noch durch die Anzahl an Volumen teilen, also in diesem Beispiel wären es 1 Liter, da mol/L immer auf 1 Liter geht.
0.0533191/1 = 0.0533191 mol/L
Dies ist nun die Konzentration von Kupfer(II)-nitrat in einem Liter Wasser.
Schlussfolgerung:
1. Warum lösen sich Salze überhaupt?
2. Welche Faktoren bestimmen die Löslichkeit?
B) Lösungsvorgang von Salzen
Grundlegendes:
1. Warum lösen sich Salze überhaupt?
Folgende drei Aspekte spielen bei der Lösung von Salzen in Wasser eine entscheidende Rollen:
- Die Wahrscheinlichkeit der Teilchenbewegung - Entropie ΔS
- Das Zusammenspiel der Gitterenergie, welche überwunden werden muss
- Die Hydrationsenergie, welche mithilft.
Beispiel: Lösen von NaCl (Kochsalz) in Wasser:
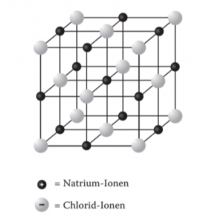
Hier sehen Sie eine Abbildung von einem NaCl Gitter:
Die schwarzen Punkte stellen die positiv geladenen Natrium-Kationen dar.
Die grauen Punkte stellen die negativ geladenen Chlorid-Anionen dar.
Kationen = Positiv geladenes Ion
Anionen = Negativ geladenes Ion
Zusammen bilden sie ein Ionengitter.
Wichtig zu wissen:
Das Ionengitter ist kein starrer, sondern ein kinetischer Zustand und die Ionen bewegen sich ständig. Sie "schubsen" sich ständig gegenseitig und werden auch von den Wassermolekülen angerempelt.
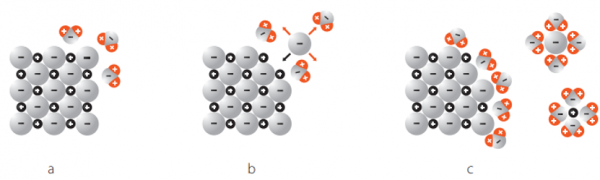
Nun geben wir das NaCl in Wasser:
a
Hier sieht man, wie sich die Wasserionen an das Ionengitter von NaCl kleben. Das passiert, weil Wasser ein Dipol ist.
Das heisst aber noch nicht, dass sich das Ionengitter nun löst.
b
Hier sieht man, wie sich ein Chlorid-Ion von dem Gitter löst. Das passiert durch die zufällige Teilchenbewegung und die Wahrscheinlichkeit: Entropie.
Dieser Vorgang heisst: Hydration
Von all den Bewegungsmöglichkeiten, welche das Chlorid-Ion hat, sind eine Mehrheit weg vom Gitter. Die Wahrscheinlichkeit, dass das Chlorid-Ion sich nachher wieder genau an die Ausgangsposition bewegt ist sehr unwahrscheinlich. - Entropie = "Es geschieht, was wahrscheinlich ist".
So wird die Gitterenergie überwunden. Nun sieht man, wie sich die positiven Sauerstoff (O) Pole des Wassers sich an die negativ geladenen Chlorid-Ionen kleben. Das passiert, weil sich negativ und positiv anzieht.
c
Hier sieht man, wie sich die positiven Sauerstoffatome (O) der Wassermoleküle, sich an die negativ geladenen Chlorid-Ionen kleben.
Und darunter sieht man, wie sich die negativen Wasserstoffatome (H) der Wassermoleküle, sich an die positiv geladenen Natrium-Ionen kleben.
Das passiert, weil sich negativ und positiv anzieht.
Detaillierte Zusammenfassung
FOLIEN VON HERRN DEUBER: HIER!!!!!!
C) Experiment: Energetische Betrachtung
Vorgehen:
Ergebnisse:
Es gibt sowohl gut lösliche Salze, die sich exotherm wie endotherm lösen. Wenn Delta H kleiner als Null ist, hat das System "Energie" aus dem Wasser aufgenommen, um die Gitterenergie des Salzes zu überwinden und hat somit dessen Temperatur gesenkt. Wenn es eine exotherme Reaktion ist, dann gibt die Reaktion, die Aufbrechung des Gitters, "Energie" an das umliegende Wasser ab, die Temperatur steigt und Delta H ist grösser als Null.
Bei schlecht löslichen Salzen ist die Gitterenergie zu gross und müsste zuerst überwunden werden bzw. kann gar nicht überwunden werden von den Wasserteilchen.
Wird gelöscht (Hydration)
Definition:
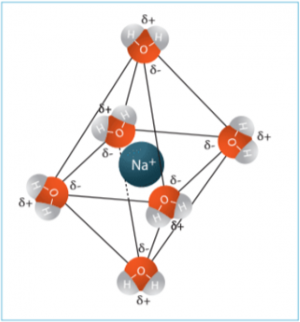
Hydration ist der Prozess, bei dem Wassermoleküle die Ionen eines gelösten Salzes umgeben und stabilisieren. Dies geschieht, weil Wasser ein stark polares Molekül ist und dadurch in der Lage ist, die Ionen eines Salzes effektiv zu lösen und in der Lösung zu halten.
Wichtig zu wissen:
Das Ionengitter ist kein starrer, sondern ein kinetischer Zustand und die Ionen bewegen sich ständig. Sie "schubsen" sich ständig gegenseitig und werden auch von den Wassermolekülen angerempelt.
Hydratation von Kationen: Sauerstoffatome der Wassermoleküle, die eine negative Partialladung tragen, richten sich zu den Kationen aus und lösen sie aus dem Gitter.
Hydratation von Anionen: Wasserstoffatome der Wassermoleküle, die eine positive Partialladung tragen, richten sich zu den Anionen aus und lösen diese heraus.
Dieser Prozess der Hydratation ist energetisch günstig und hilft, die starken elektrostatischen Anziehungskräfte zwischen den Ionen zu überwinden, was zur Auflösung des Salzes im Wasser führt.
Detaillierte Erklärung des Hydrationsprozesses im Zusammenhang mit der Löslichkeit von Salzen:
Die Entropie beschreibt das Mass an Unordnung oder Zufälligkeit in einem System. Wenn sich ein Salz in Wasser löst, erhöht sich die Entropie, weil die festen Ionen aus dem geordneten Kristallgitter in eine ungeordnete Lösung übergehen.
Schritt 1 – Auflösen des Salzes: Wenn ein Salz, wie Natriumchlorid (NaCl), in Wasser gegeben wird, zerfällt es in seine Bestandteile: Natrium-Ionen (Na⁺) und Chlorid-Ionen (Cl⁻). Dieser Vorgang des Auflösens wird durch die Anziehungskraft zwischen den geladenen Ionen und den polaren Wassermolekülen unterstützt.
Schritt 2 – Hydratation der Ionen: Nach der Dissoziation umgeben Wassermoleküle die einzelnen Ionen. Wasser ist ein polares Molekül, was bedeutet, dass es eine positive und eine negative Seite hat. Die positiv geladenen Wasserstoffatome des Wassermoleküls richten sich zu den negativ geladenen Anionen (wie Cl⁻) aus, während die negativ geladenen Sauerstoffatome zu den positiv geladenen Kationen (wie Na⁺) weisen. Dieser Prozess wird als Hydratation oder Solvatation bezeichnet.
Schritt 3 – Energieaspekte der Hydratation: Die Hydratation der Ionen ist ein exothermer Prozess, bei dem Energie in Form von Hydratationsenergie freigesetzt wird. Diese freigesetzte Energie trägt dazu bei, die Gitterenergie des Salzes (die Energie, die benötigt wird, um das ionische Gitter auseinanderzubrechen) zu überwinden. Wenn die Hydratationsenergie die Gitterenergie übersteigt, löst sich das Salz leicht im Wasser auf.
D) Faktoren, welche die Löslichkeit beeinflussen
Ausgangslage
2. Welche Faktoren bestimmen die Löslichkeit ?
Gut lösliche Salze:
Die Hydrationsenergie ist höher als die Gitterenergie.
Die Reaktion ist exotherm.
Eine günstige Entropie ist vorhanden.
Mittel-Gut lösliche Salze:
Die Gitterenergie ist leicht höher als die Hydrationsenergie.
Diese Art von Reaktionen sind oft endotherm
Eine günstige Entropie ist vorhanden.
Hier kann die Gitterenergie nur durch die günstige Entropie überwunden werden, da diese der Hydrationsenergie hilft.
Nicht / kaum lösliche Salze:
Die Gitterenergie ist sehr gross. - viel grösser als die Hydrationsenergie. - Somit ist es fast unmöglich das Gitter aufzubrechen.
Siehe Abbildung in "C) Energetische Betrachtung Experiment"
Ionengrösse und -ladung: (in Gitterenergie enthalten)
Kleine Ionen:
Kleinere Ionen haben höhere Ladungsdichten (Ladung pro Volumeneinheit), was zu stärkeren elektrostatischen Anziehungskräften zwischen den Ionen führt. Diese stärkeren Kräfte machen es schwieriger, das Ionengitter zu brechen und die Ionen in Lösung zu bringen.
Höhere Ladungen:
Ionen mit höherer Ladung (z.B. Al³⁺ oder Fe³⁺) haben ebenfalls stärkere elektrostatische Anziehungskräfte im Ionengitter, was die Löslichkeit verringert. Dies ist darauf zurückzuführen, dass mehr Energie erforderlich ist, um diese starken Anziehungskräfte zu überwinden und die Ionen in Lösung zu bringen.
Grosse Ionen mit kleinen Ladungen sind also besser löslich als kleine Ionen mit grossen Ladungen.
E) Kristallwasser
Unter Kristallwasser versteht man Wasser, das im Kristallgitter eines Salzes eingebaut ist. Viele Salze bilden Hydrate, in denen Wassermoleküle in die Kristallstruktur integriert sind. Ein bekanntes Beispiel für ein solches Hydrat ist Cobalt(II)-chlorid-Hexahydrat.
Bsp: Geheimtinte
Co2+Cl21- * 6H2O(s)
Cobalt bildet mit 6 Wassermolekülen ein Komplexion:
[CO(6H2O)6]2+
Im Cobaltchlorid Hexahydrat ist jetzt dieses Komplexion und noch zwei Chlorionen enthalten.
Und zwar ist jedes Cobaltion von 8 Gegenionen umgeben, zwei davon Chlorionen und sechs Wassermoleküle.
Geheimtinte wird sichtbar, sobald man ein damit beschriebenes Blatt erhitzt.
| CO2+CL21- * 6H2O(s) | → | CO2+CL21-(s) + 6H2O(g) |
| Cobaltchlorid Hexahydrat | Cobaltchlorid(Wasserfrei) |
Wenn das Kristallwasser im Ionengitter verdampft, bleibt Cobaltchlorid übrig und wird sichtbar.
Cobalt(II)-chlorid-Hexahydrat (rosa) verwandelt sich in wasserfreies Cobalt(II)-chlorid (blau), sobald das Kristallwasser verdampft.
Dadurch wird die "unsichtbare" Schrift sichtbar.
F) Exsikkator
ERKLÄREN
Quellen
- Chemienotizen des 2. Jahres an der KsBa
- Chemiebuch
- Bilder von Herrn Deuber
- BingAI inkl. Quellenangaben