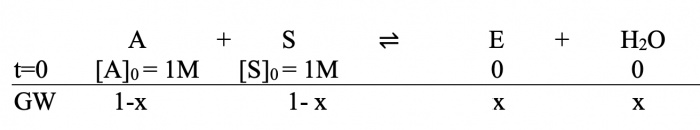Die Berechnung von Gleichgewichtskonzentrationen: Unterschied zwischen den Versionen
| (29 dazwischenliegende Versionen von einem anderen Benutzer werden nicht angezeigt) | |||
| Zeile 6: | Zeile 6: | ||
Kennt man also K, so kann man Aussagen über die Lage des Gleichgewichts einer Reaktion machen. Wir wissen dann, ob eine Reaktion überhaupt abläuft, die Produktekonzentration überwiegt, das Gleichgewicht in der Mitte ist, oder ob allenfalls die Edukte überwiegen. | Kennt man also K, so kann man Aussagen über die Lage des Gleichgewichts einer Reaktion machen. Wir wissen dann, ob eine Reaktion überhaupt abläuft, die Produktekonzentration überwiegt, das Gleichgewicht in der Mitte ist, oder ob allenfalls die Edukte überwiegen. | ||
| + | |||
| + | |||
| + | [[Datei:Tabelle.jpg|700px]] | ||
| + | |||
| + | |||
| + | == Die Berechnung an einem Beispiel == | ||
| + | |||
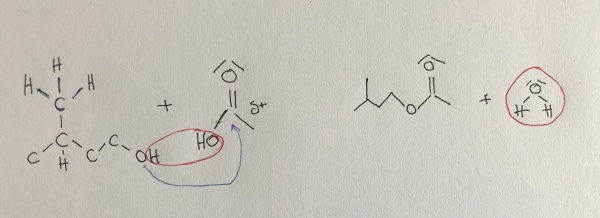
| + | Synthese von Bananenesther | ||
| + | |||
| + | [[Datei:ReaktionMS.jpg|600px]] | ||
| + | |||
| + | 3-Methyl-butanol + Essigsäure ⇌ Essigsäure-3-methyl-butyl-ester + Wasser | ||
| + | (Die Hydroxylgruppe verbindet | ||
| + | sich mit der Essigsäure) | ||
| + | |||
| + | |||
| + | Berechnung: | ||
| + | |||
| + | [[Datei:MWG.jpg|700px]] | ||
| + | |||
| + | Die anfänglichen Edukte sind also gegeben (die Produkte am Anfang noch 0). | ||
| + | Gesucht ist [E]GW also [E] im Gleichgewichtszustand, wobei K=4 sei. | ||
| + | |||
| + | Wir setzen nun die gesuchte [E]GW als x, entsprechend werden die Edukte im GW zu 1-x: | ||
| + | |||
| + | Lösungsweg: | ||
| + | |||
| + | [[Datei:AnfGW.jpg|700px]] | ||
| + | |||
| + | Nun setzen wir in MWG ein: | ||
| + | |||
| + | [[Datei:rechenweg.jpg|700px]] | ||
| + | |||
| + | Die Lösung ist also x1 = 2/3 M, da es nicht möglich ist, dass aus 1 M Alkohol und Säure 2 Mol Ester werden. | ||
| + | |||
| + | x1 = 2/3 → [E]GW = 2/3 Mol (ca. 0.667 Mol) | ||
| + | |||
| + | [H2O]GW = 2/3 Mol (ca. 0.667 Mol) | ||
| + | |||
| + | [S]GW & [A]GW = 1/3 Mol (ca. 0.333 Mol) | ||
| + | |||
| + | Ausbeute: Hergestellte Menge : Maximal mögliche Menge = 0.667 M : 1M = 66,7% | ||
| + | |||
| + | |||
| + | Variante: nimmt man [S]0 = 2M, so wird x1= 0.84 x2= 3.15 (wieder nicht möglich) | ||
| + | |||
| + | Dann wäre: → [E]GW = 0.84 M → und die Ausbeute 84% | ||
| + | |||
| + | |||
| + | == Quellen == | ||
| + | * Chemieunterlagen | ||
| + | |||
| + | == Weblinks == | ||
| + | * [http://swisseduc.ch/chemie/ Swisseduc] – Unterrichtsserver für Chemie | ||
| + | * [http://meta.wikimedia.org/wiki/Help:Contents#For_editors Mediawiki Hilfeseite] – So kann der Link näher beschrieben werden | ||
Aktuelle Version vom 10. Dezember 2022, 14:35 Uhr
Inhaltsverzeichnis
Einführung: Bedeutung von K
Die Gleichgewichtskonstante K gibt ein Verhältnis von Mengen der bei einer chemischen Reaktion beteiligten Stoffe wieder. Liegen die Edukte und Produkte der Reaktion in dem durch die Gleichgewichtskonstante gegebenen Verhältnis vor, so befindet sich die Reaktion im chemischen Gleichgewicht. Dann findet kein Nettofluss durch die Reaktion statt.
Der Fluss durch die Hinreaktion ist gleich dem Fluss durch die Rückreaktion!
Kennt man also K, so kann man Aussagen über die Lage des Gleichgewichts einer Reaktion machen. Wir wissen dann, ob eine Reaktion überhaupt abläuft, die Produktekonzentration überwiegt, das Gleichgewicht in der Mitte ist, oder ob allenfalls die Edukte überwiegen.
Die Berechnung an einem Beispiel
Synthese von Bananenesther
3-Methyl-butanol + Essigsäure ⇌ Essigsäure-3-methyl-butyl-ester + Wasser
(Die Hydroxylgruppe verbindet
sich mit der Essigsäure)
Berechnung:
Die anfänglichen Edukte sind also gegeben (die Produkte am Anfang noch 0). Gesucht ist [E]GW also [E] im Gleichgewichtszustand, wobei K=4 sei.
Wir setzen nun die gesuchte [E]GW als x, entsprechend werden die Edukte im GW zu 1-x:
Lösungsweg:
Nun setzen wir in MWG ein:
Die Lösung ist also x1 = 2/3 M, da es nicht möglich ist, dass aus 1 M Alkohol und Säure 2 Mol Ester werden.
x1 = 2/3 → [E]GW = 2/3 Mol (ca. 0.667 Mol)
[H2O]GW = 2/3 Mol (ca. 0.667 Mol)
[S]GW & [A]GW = 1/3 Mol (ca. 0.333 Mol)
Ausbeute: Hergestellte Menge : Maximal mögliche Menge = 0.667 M : 1M = 66,7%
Variante: nimmt man [S]0 = 2M, so wird x1= 0.84 x2= 3.15 (wieder nicht möglich)
Dann wäre: → [E]GW = 0.84 M → und die Ausbeute 84%
Quellen
- Chemieunterlagen
Weblinks
- Swisseduc – Unterrichtsserver für Chemie
- Mediawiki Hilfeseite – So kann der Link näher beschrieben werden