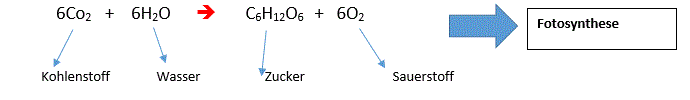Freiwillige und unfreiwillige Reaktionen: Unterschied zwischen den Versionen
(Die Seite wurde neu angelegt: „''Definition:'' Läuft eine Reaktion bei Standardbedingungen (Raumtemperatur 25°C=298K, normaler Luftdruck 1013 hPa) '''freiwillig''' ab, spricht man von eine…“) |
|||
| Zeile 1: | Zeile 1: | ||
| − | ''Definition:'' Läuft eine Reaktion bei Standardbedingungen (Raumtemperatur 25°C=298K, normaler Luftdruck 1013 hPa) ''' | + | ''Definition:'' Läuft eine Reaktion bei Standardbedingungen (Raumtemperatur 25°C=298K, normaler Luftdruck 1013 hPa) '''spontan''' ab, spricht man von einer freiwilligen Reaktion, das '''Mass für die Freiwilligkeit''' ist die '''freie Enthalpie ΔG''' unter Einfluss der [[Die Reaktionsenthalpie ΔH| Reaktionsenthalpie ΔH]], der [[Die Entropie ΔS|Entropie ΔS]] und der Temperatur. |
==Grundlegendes== | ==Grundlegendes== | ||
| − | Es kann zwischen '''drei Arten von Reaktionsabläufen''' unterschieden werden, dabei muss in jedem Fall beachtet werden, dass die '''Zeit''' '''keinen Einfluss auf die | + | Es kann zwischen '''drei Arten von Reaktionsabläufen''' unterschieden werden, dabei muss in jedem Fall beachtet werden, dass die '''Zeit''' '''keinen Einfluss auf die Freiwilligkeit''' hat. |
| − | * | + | * Freiwillige Reaktionen, rasch ablaufend |
Beispiele: | Beispiele: | ||
- Verbrennen von weissem Phosphor: Unter Standardbedingungen (Raumtemperatur, 1013 hPa Druck) läuft diese Reaktion spontan und sehr schnell ab, sobald weisser Phosphor in Berührung mit dem Luftbestandteil Sauerstoff kommt. Das ist der Grund, wieso weisser Phosphor im Chemielabor unter Wasser aufbewahrt werden muss. | - Verbrennen von weissem Phosphor: Unter Standardbedingungen (Raumtemperatur, 1013 hPa Druck) läuft diese Reaktion spontan und sehr schnell ab, sobald weisser Phosphor in Berührung mit dem Luftbestandteil Sauerstoff kommt. Das ist der Grund, wieso weisser Phosphor im Chemielabor unter Wasser aufbewahrt werden muss. | ||
| Zeile 10: | Zeile 10: | ||
Diese Reaktionen laufen selbständig und vollständig ab, alle Produkte reagieren miteinander zu Edukten. | Diese Reaktionen laufen selbständig und vollständig ab, alle Produkte reagieren miteinander zu Edukten. | ||
| − | * | + | * Freiwillige Reaktionen, langsam ablaufend |
Beispiel: | Beispiel: | ||
- Oxidieren von Papier: Bei Raumtemperatur vergilbt Papier, es reagiert mit dem Luftbestandteil Sauerstoff. Diese Reaktion kann durch das Aufbringen einer Aktivierungsenergie (in diesem Fall: heisse Flamme) extrem beschleunigt werden. | - Oxidieren von Papier: Bei Raumtemperatur vergilbt Papier, es reagiert mit dem Luftbestandteil Sauerstoff. Diese Reaktion kann durch das Aufbringen einer Aktivierungsenergie (in diesem Fall: heisse Flamme) extrem beschleunigt werden. | ||
Merke: Die Geschwindigkeit, mit der eine Reaktion abläuft, kann durch das Ändern der Reaktionsbedingungen beeinflusst werden. | Merke: Die Geschwindigkeit, mit der eine Reaktion abläuft, kann durch das Ändern der Reaktionsbedingungen beeinflusst werden. | ||
| − | * | + | * Unfreiwillige Reaktionen |
Dies sind Reaktionen, die ohne äusseren Zwang nicht ablaufen. | Dies sind Reaktionen, die ohne äusseren Zwang nicht ablaufen. | ||
Beispiel: | Beispiel: | ||
- Bildung von Erdöl: Wäre die Bildung von Erdöl eine spontane Reaktion, wären wohl alle Energieprobleme der Menschheit gelöst. Will man Erdöl synthetisieren, muss Energie beispielsweise in Form von Druck oder einer gewissen Temperatur in die Reaktion eingebracht werden. | - Bildung von Erdöl: Wäre die Bildung von Erdöl eine spontane Reaktion, wären wohl alle Energieprobleme der Menschheit gelöst. Will man Erdöl synthetisieren, muss Energie beispielsweise in Form von Druck oder einer gewissen Temperatur in die Reaktion eingebracht werden. | ||
| − | == | + | ==Freiwillig oder unfreiwillig?== |
| − | Um festzustellen, ob eine Reaktion | + | Um festzustellen, ob eine Reaktion freiwillig ist oder nicht, muss das Mass für die Freiwilligkeit, die '''freie Enthalpie ΔG''' betrachtet werden. |
Es gilt: '''ΔG = ΔH - ΔS * T''', T=absolute Temperatur in K bzw. für Standardbedingungen: ''ΔG° = ΔH° - ΔS° * 298'' | Es gilt: '''ΔG = ΔH - ΔS * T''', T=absolute Temperatur in K bzw. für Standardbedingungen: ''ΔG° = ΔH° - ΔS° * 298'' | ||
| Zeile 29: | Zeile 29: | ||
* Schritt 3: Einsetzen der errechneten Werte in die Gleichung ΔG = ΔH - ΔS * T | * Schritt 3: Einsetzen der errechneten Werte in die Gleichung ΔG = ΔH - ΔS * T | ||
| − | * Ergibt sich einen Wert für '''ΔG°<0''', verläuft die Reaktion ''' | + | * Ergibt sich einen Wert für '''ΔG°<0''', verläuft die Reaktion '''freiwillig''' (exergonisch) in einem abgeschlossenen System (kein Energie- und Stoffaustausch mit der Umgebung ist möglich, beispielsweise Gefäss im Vakuum, das im ganzen Innenkörper mit Spiegeln ausgekleidet ist (sonst können Lichtstrahlen (Form von Energie) entweichen)). |
| − | * Ergibt sich einen Wert für '''ΔG°>0''', verläuft die Reaktion ''' | + | * Ergibt sich einen Wert für '''ΔG°>0''', verläuft die Reaktion '''unfreiwillig''' (endergonisch) in einem abgeschlossenen System. In einem geschlossenen (Stoffaustausch nicht möglich, Energieaustausch möglich) oder offenen System (Stoffaustausch möglich, Energieaustausch möglich) wäre durch das Zuführen von Energie (beispielsweise Umgebungstemperatur) ein Reaktionsverlauf möglich. |
==Ergänzung: Triebkräfte chemischer Reaktionen== | ==Ergänzung: Triebkräfte chemischer Reaktionen== | ||
| Zeile 55: | Zeile 55: | ||
===Offenes System:=== | ===Offenes System:=== | ||
| − | Wenn man Eisenwolle verbrennt, entsteht Eisenoxid. Wiegt man die Masse vorher und nachher, dann hat die Masse zugenommen. Aber laut dem | + | Wenn man Eisenwolle verbrennt, entsteht Eisenoxid. Wiegt man die Masse vorher und nachher, dann hat die Masse zugenommen. Aber laut dem Massenerhaltungsgesetzt muss die Masse gleich wiegen wie am Anfang. |
Diese Reaktion hat eben in ein offenes System reagiert, daher hat es auch mit Sauerstoff reagiert (verbunden). Dementsprechend wiegt es mehr wie am Anfang. Daher wurde hier das Masserhaltungsgesetzt trotzdem erfüllt, weil mehr Stoff dazu kam. | Diese Reaktion hat eben in ein offenes System reagiert, daher hat es auch mit Sauerstoff reagiert (verbunden). Dementsprechend wiegt es mehr wie am Anfang. Daher wurde hier das Masserhaltungsgesetzt trotzdem erfüllt, weil mehr Stoff dazu kam. | ||
Alltagsbeispiel: Wasserkochen; von aussen wärme (Energie) liefern und es fängt an zu verdampfen. Ausserdem kann man Stoffe hinzufügen (zum Beispiel Nudeln). | Alltagsbeispiel: Wasserkochen; von aussen wärme (Energie) liefern und es fängt an zu verdampfen. Ausserdem kann man Stoffe hinzufügen (zum Beispiel Nudeln). | ||
Version vom 7. September 2022, 15:24 Uhr
Definition: Läuft eine Reaktion bei Standardbedingungen (Raumtemperatur 25°C=298K, normaler Luftdruck 1013 hPa) spontan ab, spricht man von einer freiwilligen Reaktion, das Mass für die Freiwilligkeit ist die freie Enthalpie ΔG unter Einfluss der Reaktionsenthalpie ΔH, der Entropie ΔS und der Temperatur.
Inhaltsverzeichnis
- 1 Grundlegendes
- 2 Freiwillig oder unfreiwillig?
- 3 Ergänzung: Triebkräfte chemischer Reaktionen
- 3.1 1.Freiwillige Reaktion: Knallgasreaktion
- 3.2 2.Unfreiwillige Reaktion: z.B Wasserflasche mit Kohlensäure
- 3.3 Definition von Freiwillige Reaktionen: Freiwillige Reaktionen laufen in einem abgeschlossenen System von alleine ab.
- 3.4 Beispiele zu den Thermodynamischen Systemen:
- 3.5 Offenes System:
- 3.6 Geschlossenes System:
- 3.7 Abgeschlossenes System:
- 4 Bemerkungen
- 5 Beispielaufgaben
- 6 Quellen
- 7 Weblinks
Grundlegendes
Es kann zwischen drei Arten von Reaktionsabläufen unterschieden werden, dabei muss in jedem Fall beachtet werden, dass die Zeit keinen Einfluss auf die Freiwilligkeit hat.
- Freiwillige Reaktionen, rasch ablaufend
Beispiele: - Verbrennen von weissem Phosphor: Unter Standardbedingungen (Raumtemperatur, 1013 hPa Druck) läuft diese Reaktion spontan und sehr schnell ab, sobald weisser Phosphor in Berührung mit dem Luftbestandteil Sauerstoff kommt. Das ist der Grund, wieso weisser Phosphor im Chemielabor unter Wasser aufbewahrt werden muss. - Lösen einer Vielzahl von Salzen in Wasser Diese Reaktionen laufen selbständig und vollständig ab, alle Produkte reagieren miteinander zu Edukten.
- Freiwillige Reaktionen, langsam ablaufend
Beispiel: - Oxidieren von Papier: Bei Raumtemperatur vergilbt Papier, es reagiert mit dem Luftbestandteil Sauerstoff. Diese Reaktion kann durch das Aufbringen einer Aktivierungsenergie (in diesem Fall: heisse Flamme) extrem beschleunigt werden. Merke: Die Geschwindigkeit, mit der eine Reaktion abläuft, kann durch das Ändern der Reaktionsbedingungen beeinflusst werden.
- Unfreiwillige Reaktionen
Dies sind Reaktionen, die ohne äusseren Zwang nicht ablaufen. Beispiel: - Bildung von Erdöl: Wäre die Bildung von Erdöl eine spontane Reaktion, wären wohl alle Energieprobleme der Menschheit gelöst. Will man Erdöl synthetisieren, muss Energie beispielsweise in Form von Druck oder einer gewissen Temperatur in die Reaktion eingebracht werden.
Freiwillig oder unfreiwillig?
Um festzustellen, ob eine Reaktion freiwillig ist oder nicht, muss das Mass für die Freiwilligkeit, die freie Enthalpie ΔG betrachtet werden. Es gilt: ΔG = ΔH - ΔS * T, T=absolute Temperatur in K bzw. für Standardbedingungen: ΔG° = ΔH° - ΔS° * 298
- Schritt 1: Abschätzen der Reaktionsenthalpie
- Schritt 2: Abschätzen der Entropie ΔS, Eruierung der Temperatur falls diese von 298 K abweicht
- Schritt 3: Einsetzen der errechneten Werte in die Gleichung ΔG = ΔH - ΔS * T
- Ergibt sich einen Wert für ΔG°<0, verläuft die Reaktion freiwillig (exergonisch) in einem abgeschlossenen System (kein Energie- und Stoffaustausch mit der Umgebung ist möglich, beispielsweise Gefäss im Vakuum, das im ganzen Innenkörper mit Spiegeln ausgekleidet ist (sonst können Lichtstrahlen (Form von Energie) entweichen)).
- Ergibt sich einen Wert für ΔG°>0, verläuft die Reaktion unfreiwillig (endergonisch) in einem abgeschlossenen System. In einem geschlossenen (Stoffaustausch nicht möglich, Energieaustausch möglich) oder offenen System (Stoffaustausch möglich, Energieaustausch möglich) wäre durch das Zuführen von Energie (beispielsweise Umgebungstemperatur) ein Reaktionsverlauf möglich.
Ergänzung: Triebkräfte chemischer Reaktionen
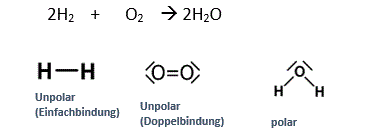
1.Freiwillige Reaktion: Knallgasreaktion
Ein Ballon wird mit Wasserstoff aufgeblasen. Wenn man diesen Ballon anzündet, so schmilzt der Ballon und der innere Wasserstoff reagiert mit dem äusseren Sauerstoff.
Es ist eine freiwillige Reaktion, weil die Edukte Energiereicher sind als die Produkte.
2.Unfreiwillige Reaktion: z.B Wasserflasche mit Kohlensäure
Jedoch lauft die Fotosynthese in diesem Beispiel nicht Freiwillig ab!
Definition von Freiwillige Reaktionen: Freiwillige Reaktionen laufen in einem abgeschlossenen System von alleine ab.
Beispiele zu den Thermodynamischen Systemen:
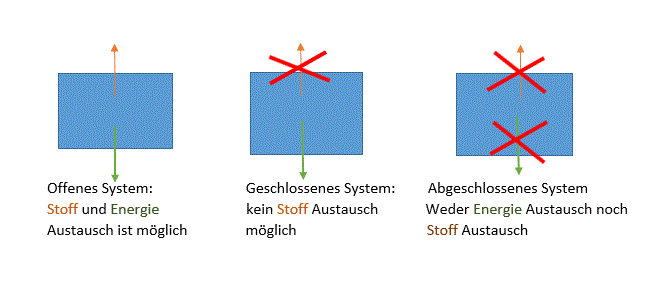
Offenes System:
Wenn man Eisenwolle verbrennt, entsteht Eisenoxid. Wiegt man die Masse vorher und nachher, dann hat die Masse zugenommen. Aber laut dem Massenerhaltungsgesetzt muss die Masse gleich wiegen wie am Anfang. Diese Reaktion hat eben in ein offenes System reagiert, daher hat es auch mit Sauerstoff reagiert (verbunden). Dementsprechend wiegt es mehr wie am Anfang. Daher wurde hier das Masserhaltungsgesetzt trotzdem erfüllt, weil mehr Stoff dazu kam. Alltagsbeispiel: Wasserkochen; von aussen wärme (Energie) liefern und es fängt an zu verdampfen. Ausserdem kann man Stoffe hinzufügen (zum Beispiel Nudeln).
Geschlossenes System:
Wenn man auf ein Reagenzglas den Stöpsel fest reindrückt. Dann kann es nicht zu einem Stoffaustausch kommen, weil nichts mehr durch den Stöpsel durchdringen kann. Energie kann aber trotzdem zugeführt oder abgeführt werden. Zum Beispiel erhitzt man es oder man kühlt es. Alltagsbeispiel: Taschenwärmer; es ist ein geschlossenes System, d.h man kann kein Stoff reintun, aber man kann ihn erwärmen, wenn man das Metallteil knickt.
Abgeschlossenes System:
Hier ist kein Stoffaustausch oder Energieaustausch möglich. Im Labor hat man spezielle Gefässe, in denen man flüssigen Stickstoff auffüllt, denn man will nicht, dass dieser flüssige Stickstoff nach aussen gelangt und auch nicht dass dieser sich auf Zimmertemperatur erwärmt. Alltagsbeispiel: Thermoskanne; muss geschlossen sein, sodass kein Kaffee raustritt, ausserdem wird versucht, die Energie Übertragung von Wärme durch Isolation zu verhindern. Dadurch kann der warme Kaffee warm bleiben, obwohl es draussen kalt ist. Allerdings gibt es kein perfektes abgeschlossenes System, denn irgendwie wird die Energie doch übertragen! Somit wird der warme Kaffee beim längeren stehen doch kalt.
Bemerkungen
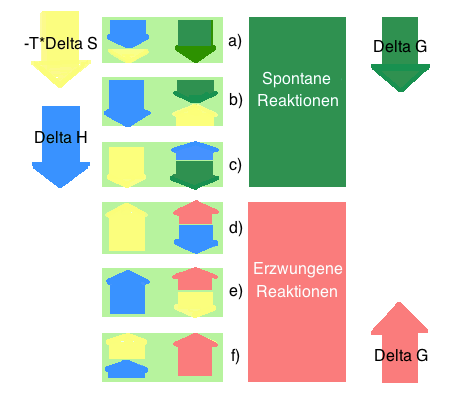
- Grundsätzlich gibt es einen Reaktionstyp, der immer spontan ist, zwei, bei denen es von der Grösse des günstigen und ungünstigen Faktors abhöngt, und einen Reaktionstyp, der immer unspontan ist:
a) ∆H < 0 also günstig*, ∆S > 0 also ebenfalls günstig, somit ist ∆G immer spontan, d.h. ∆G < 0
b) ∆H < 0 also günstig, ∆S < 0 also ungünstig
- Wenn der günstige Enthalpiefaktor ∆H grösser ist als der ungünstige Entropiefaktor ∆S, dann ist ∆G < 0, spontan
- Wenn der günstige Enthalpiefaktor ∆H kleiner ist als der ungünstige Entropiefaktor ∆S, dann ist ∆G > 0, unspontan
c) ∆H > 0 also ungünstig, ∆S > 0 also günstig
- Wenn der ungünstige Enthalpiefaktor ∆H grösser ist als der günstige Entropiefaktor ∆S, dann ist ∆G > 0, unspontan
- Wenn der ungünstige Enthalpiefaktor ∆H kleiner ist als der günstige Entropiefaktor ∆S, dann ist ∆G < 0, spontan
d) ∆H > 0 also ungünstig, ∆S < 0 also ungünstig, somit ist ∆G immer unspontan, d.h. ∆G > 0*
- günstig : begünstigt einen spontanen Reaktionsablauf
- ungünstig : beungünstigt einen spontanen Reaktionsablauf
- Einfluss der Temperatur T: Bei sehr niedriger Temperatur bewegen sich die Teilchen kaum, die Unordnung ist deshalb gering, es dominieren die Kräfte zwischen den Teilchen. Je höher die Temperatur, umso höher die Unordnung der Teilchen, und umso entscheidender für die Reaktion wird die Entropie ΔS. Die Temperatur spielt für die Entscheidung, ob eine Reaktion ablaufen wird, nur bei Dilemmareaktionen (Beispiele b) - e) ) eine Rolle.
Beispielaufgaben
Hier: Vier Typen chemischer Reaktionen
Quellen
- Chemieunterlagen Buch "Elemente"
- Unterrichtsstoff Herr Deuber
Weblinks
- Swisseduc – Unterrichtsserver für Chemie