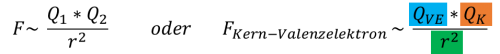Metalle und Nichtmetalle: Unterschied zwischen den Versionen
| Zeile 85: | Zeile 85: | ||
* Abnahme der Abschirmung → Zunahme der Anziehungskraft <font color="green">(günstig)</font> | * Abnahme der Abschirmung → Zunahme der Anziehungskraft <font color="green">(günstig)</font> | ||
| − | Nicht ganz eindeutige Situation durch zwei <font color="green">günstige</font> Faktoren für die Zunahme der Anziehungskräfte, jedoch einen <font color="red">ungünstigen</font> Faktor, der eher für die Abnahme der Anziehungskräfte spricht. Aufgrund der Überzahl der günstigen Faktoren kann jedoch angenommen werden, dass eine Zunahme der Anziehungskraft stattfindet. | + | Nicht ganz eindeutige Situation durch zwei <font color="green">günstige</font> Faktoren für die Zunahme der Anziehungskräfte, jedoch einen <font color="red">ungünstigen</font> Faktor, der eher für die Abnahme der Anziehungskräfte spricht. Aufgrund der Überzahl der günstigen Faktoren kann jedoch angenommen werden, dass eine Zunahme der Anziehungskraft stattfindet. Eine experimentelle Überprüfung bestätigt diese Annahme: |
<br>'''Die Anziehungskraft zwischen Kern und Valenzelektronen nimmt innerhalb einer Gruppe von unten nach oben zu!'''</br> | <br>'''Die Anziehungskraft zwischen Kern und Valenzelektronen nimmt innerhalb einer Gruppe von unten nach oben zu!'''</br> | ||
| Zeile 122: | Zeile 122: | ||
====Wichtigste Metallgruppen im Periodensystem==== | ====Wichtigste Metallgruppen im Periodensystem==== | ||
| + | |||
| + | Ganz allgemein kann man feststellen, dass die Elemente nach unten und nach links im Periodensystem metallischer werden. Dies ist die Folge der Veränderung der Anziehungskräfte zwischen Kern und Valenzelektronen, wie im oberen Kapitel erklärt wurde. Diese Tendenz, der Zunahme des metallischen Charakters nach unten und links kann gut in den Hauptgruppen beobachtet werden. Die Alkalimetalle (1. Hauptgruppe) und die Erdalkalimetalle (2. Hauptgruppe) bestehen ganz aus Metallen. Ab der dritten Hauptgruppe sind nur noch die unteren Elemente Metalle. Je weiter nach rechts und oben man im Periodensystem sucht, desto weniger Metalle findet man. | ||
| + | |||
[[image:Kalium.JPG|thumb|right|Kalium luftdicht abgeschlossen; für eine detailliertere Sicht siehe [http://www.seilnacht.com/Lexikon/019pse2.JPG]]] | [[image:Kalium.JPG|thumb|right|Kalium luftdicht abgeschlossen; für eine detailliertere Sicht siehe [http://www.seilnacht.com/Lexikon/019pse2.JPG]]] | ||
| Zeile 155: | Zeile 158: | ||
====Wichtigste Nichtmetallgruppen im Periodensystem==== | ====Wichtigste Nichtmetallgruppen im Periodensystem==== | ||
| − | *'''Chalkogene''' ist der Übername für die Elemente der [[Wichtige_Hauptgruppen#6._Hauptgruppe|6. Hauptgruppe]]. Diese Gruppe besteht nicht einheitlich aus Nichtmetallen. Nach unten nimmt der metallische Charakter zu, weswegen die untersten Elemente Halbmetalle sind. | + | Ganz allgemein kann man feststellen, dass die Elemente nach oben und nach rechts im Periodensystem nichtmetallischer werden. Dies ist die Folge der Veränderung der Anziehungskräfte zwischen Kern und Valenzelektronen, wie im oberen Kapitel erklärt wurde. Diese Tendenz, der Zunahme des nichtmetallischen Charakters nach oben und rechts kann gut in den Hauptgruppen beobachtet werden. Die Edelgase (8. Hauptgruppe) bestehen ganz aus Nichtmetallen. Die Halogene (7. Hauptgruppe) bestehen, bis auf die untersten zwei Elemente auch aus Nichtmetallen. Bei der 6. Hauptgruppe sind "nur" die obersten drei Elemente Nichtmetalle. Je weiter nach links und unten man im Periodensystem sucht, desto weniger Nichtmetalle findet man. |
| − | Die Elemente dieser Gruppe sind: Sauerstoff (NiMe), Schwefel(NiMe), Selen(NiMe), Tellur (HMe) und Pollonium (HMe). | + | |
| + | *'''Chalkogene''' ist der Übername für die Elemente der [[Wichtige_Hauptgruppen#6._Hauptgruppe|6. Hauptgruppe]]. Diese Gruppe besteht nicht einheitlich aus Nichtmetallen. Nach unten nimmt der metallische Charakter zu, weswegen die untersten Elemente Halbmetalle sind. Die Elemente dieser Gruppe sind: Sauerstoff (NiMe), Schwefel(NiMe), Selen(NiMe), Tellur (HMe) und Pollonium (HMe). | ||
<blockquote>'''Sauerstoff''' ist das wichtigste Nichtmetall. Es ist an vielen Verbrennungsprozessen und der Korrosion beteiligt. Ausserdem wird es von fast allen Organismen zum Leben gebraucht.</blockquote> | <blockquote>'''Sauerstoff''' ist das wichtigste Nichtmetall. Es ist an vielen Verbrennungsprozessen und der Korrosion beteiligt. Ausserdem wird es von fast allen Organismen zum Leben gebraucht.</blockquote> | ||
| Zeile 169: | Zeile 173: | ||
===Bindungen=== | ===Bindungen=== | ||
| − | * '''Metall - Metall''' = [[Struktur_und_Eigenschaften_der_Metalle| | + | [[image:Das_Periodensystem_und_die_drei_Bindungsarten.png|500px|none|thumb|right|none|Das Periodensystem und die drei Bindungsarten; für eine detailliertere Sicht siehe [http://www.rdeuber.ch/chemiewiki/index.php?title=Datei:Das_Periodensystem_und_die_drei_Bindungsarten.png]]] |
| + | |||
| + | * '''Metall - Metall''' = <font color="blue">Metallbindung</font> (mehr dazu findest Du [[Struktur_und_Eigenschaften_der_Metalle|hier]].) | ||
Bsp.: Legierungen wie Bronze Cu + Sn | Bsp.: Legierungen wie Bronze Cu + Sn | ||
| Zeile 176: | Zeile 182: | ||
| − | * '''Nichtmetall - Nichtmetall''' = [[Einfache_Molek%C3%BCle| | + | * '''Nichtmetall - Nichtmetall''' = <font color=#D7DF01>Elektronenpaarbindung</font> (mehr dazu findest Du [[Einfache_Molek%C3%BCle|hier]].) |
Bsp.: Wasser: H<sub>2</sub>O | Bsp.: Wasser: H<sub>2</sub>O | ||
| Zeile 183: | Zeile 189: | ||
| − | * '''Metall - Nichtmetall''' = [[Bildung_des_Ionengitters| | + | * '''Metall - Nichtmetall''' = <font color="red">Ionenbindung</font> (mehr dazu findest Du [[Bildung_des_Ionengitters|hier]].) |
Bsp.: Natriumchlorid Na + Cl | Bsp.: Natriumchlorid Na + Cl | ||
Version vom 12. Juni 2020, 07:14 Uhr
Inhaltsverzeichnis
Charakter von Metallen und Nichtmetallen
Metalle und Nichtmetalle: Einleitung
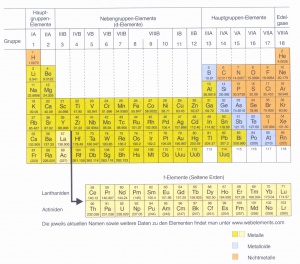
Das Periodensystem besteht aus 118 Elementen und ist in drei Elementarten gegliedert. Die meisten Elemente gehören den Metallen an und befinden sich im Periodensystem auf der linken Seite eher unten. Ganz rechts und eher oben befinden sich die Nichtmetalle. Beide Arten werden durch die Halbmetalle, die dazwischen liegen, verbunden. Der Unterschied zwischen den metallischen und nichtmetallischen Elementen spielt eine besonders wichtige Rolle bei der Einordnung der Eigenschaften und dem Reaktionsverhalten der Elemente.
Eigenschaften
Metallische Elemente weisen auf der stofflichen Ebene im Gegensatz zu nichtmetallischen Elementen bestimmte Eigenschaften auf. Diese sind:
- Metallischer Glanz
- Hohe elektrische Leitfähigkeit
- Hohe Wärmeleitfähigkeit
- Hohe Verformbarkeit
Genauere Erklärungen zu den Eigenschaften findest Du hier.
Reaktionsverhalten
Ein Atom, das seine Valenzelektronen stark bindet und noch Platz in seiner Valenzschale aufweist, kann einem Atom mit schwächeren Bindungskräften die Valenzelektronen entreissen. Der metallische oder nichtmetallische Charakter eines Elements bestimmt, ob es eher dazu neigt, in einer Reaktion Elektronen aufzunehmen oder abzugeben. Metallische Elemente haben die Tendenz Elektronen abzugeben, nichtmetallische Elemente nehmen eher Elektronen auf. Elektronegativität ist ein quantitativer Ausdruck für diese Tendenz. Ist diese hoch, nimmt das Element eher Elektronen auf und umgekehrt. Die Ursache warum Elemente entweder die Tendenz haben, Elektronen aufzunehmen oder abzugeben, wird im nächsten Abschnitt genauer erklärt.
Die Coulombkraft
Die Ursache für die Unterschiede der Eigenschaften und des Reaktionsverhaltens der einzelnen Elemente liegt in der Struktur der Atome, besser gesagt in der Anziehungskraft, mit der ein Atomkern seine Valenzelektronen anzieht. Schon kleine Unterschiede in diesen Anziehungskräften können grosse Unterschiede von Stoffeigenschaften (Energiegehalt, Schmelz- und Siedepunkt, chemische Reaktivität) zur Folge haben. Diese Anziehungskraft, mit der Atome ihre Valenzelektronen anziehen wird durch das Coulombgesetz (Coulombkraft) beschrieben:
Die Anziehungskraft zwischen einem Atomkern und seinem Valenzelektron entspricht also dem Produkt der Ladung des Valenzelektrons und der abgeschirmten Ladung (siehe nächsten Abschnitt Einflussfaktoren) des Kerns geteilt durch das Quadrat des Atomradius.
Um die Coulombkraft eines Atoms zu bestimmen, müssen drei wichtige Einflussfaktoren berücksichtigt werden:
- Kernladungszahl
Die Kernladungszahl bestimmt sowohl die Kernladung als auch die Menge der Elektronen in der Atomhülle.
- Atomradius
Der Atomradius bestimmt den Abstand zwischen dem Atomkern und der Atomhülle mit den äusseren (Valenz-) Elektronen des Atoms.
- Ladung des Valenzelektrons
Ein Valenzelektron hat immer die gleiche Ladung (−1,602 176 634 · 10−19 C). Dieser Einflussfaktor ist darum immer konstant.
- Abschirmung
Die Anziehungskraft (Coulombkraft) wird ausserdem davon beeinflusst, wie viele Elektronen sich zwischen dem Kern und den Valenzelektronen in der Atomhülle befinden. Dies liegt daran, dass die Abstossung zwischen den Valenzelektronen und den inneren Elektronen die Anziehungskraft zwischen dem Atomkern und den Valenzelektronen abschwächt. Diesen Effekt nennt man Abschirmung.
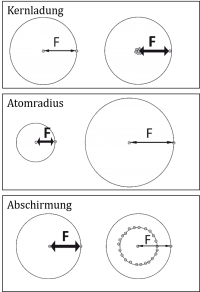
Einfluss der Einflussfaktoren auf die Anziehungskraft (Coulombkraft)
- Kernladungszahl
Je grösser die Kernladungszahl, desto grösser ist die Anziehungskraft.
- Atomradius
Je grösser der Atomradius (Abstand zwischen Kern und Elektron) desto kleiner ist die Anziehungskraft
- Abschirmung
Je grösser die Abschirmung durch innere Elektronenschalen, desto kleiner ist die Anziehungskraft.
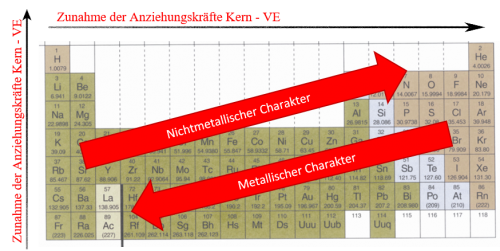
Die Coulombkraft im Periodensystem – Systematische Veränderung der Anziehungskräfte
Veränderung innerhalb einer Periode von links nach rechts:
Je weiter nach rechts im Periodensystem desto:
- Höher die Kernladungszahl (Zunahme) → Zunahme der Anziehungskraft (günstig)
- Kleiner der Atomradius (Abnahme), bedingt durch die Zunahme der Kernladung, welche eine "Selbstverstärkung", also eine stärkere Anziehung der Valenzelektronen zum Kern und darum einen kleineren Atomradius zur Folge hat. → Zunahme der Anziehungskraft (günstig)
- Keine Änderung der Abschirmung → Keine Auswirkung auf Anziehungskraft (neutral)
Eindeutige Situation durch zwei günstige und einen neutralen Faktor für die Zunahme der Anziehungskräfte:
Die Anziehungskraft zwischen Kern und Valenzelektronen nimmt innerhalb einer Periode von links nach rechts zu!
Veränderung innerhalb einer Gruppe von unten nach oben:
Je weiter nach oben im Periodensystem desto:
- Tiefer die Kernladungszahl (Abnahme) → Abnahme der Anziehungskraft (ungünstig)
- Kleiner der Atomradius (Abnahme) → Zunahme der Anziehungskraft (günstig)
- Abnahme der Abschirmung → Zunahme der Anziehungskraft (günstig)
Nicht ganz eindeutige Situation durch zwei günstige Faktoren für die Zunahme der Anziehungskräfte, jedoch einen ungünstigen Faktor, der eher für die Abnahme der Anziehungskräfte spricht. Aufgrund der Überzahl der günstigen Faktoren kann jedoch angenommen werden, dass eine Zunahme der Anziehungskraft stattfindet. Eine experimentelle Überprüfung bestätigt diese Annahme:
Die Anziehungskraft zwischen Kern und Valenzelektronen nimmt innerhalb einer Gruppe von unten nach oben zu!
Elektronendiebe und Elektronenopfer
Elektronenopfer sind Elemente, die aufgrund ihrer eher schwachen Anziehungskraft zwischen dem Kern und den Valenzelektronen bei einem Kontakt mit einem anderen Stoff tendenziell eher Elektronen abgeben. → Metalle sind Elektronenopfer.
Elektronendiebe sind Elemente, die aufgrund ihrer eher starken Anziehungskraft zwischen dem Kern und den Valenzelektronen bei einem Kontakt mit einem anderen Stoff tendenziell eher Elektronen aufnehmen. → Nichtmetalle sind Elektronendiebe.
Stärkster Elektronendieb
Zunahme der Anziehungskräfte innerhalb einer Periode von links nach rechts, und innerhalb einer Gruppe von unten nach oben: Also muss das Element ganz oben rechts der stärkste Elektronendieb sein. → Helium, aber:
Helium hat tatsächlich die stärksten Anziehungskräfte auf seine Valenzelektronen, ist aber ein Edelgas. Das bedeutet, dass seine Valenzschale voll ist. Ein weiteres aufgenommenes Elektron würde eine neue Schale mit bedeutend grösserem Radius und bedeutend schwächeren Anziehungskräften bedeuten. Edelgase sind deswegen weder Elektronenopfer noch Elektronendiebe.
Das Element, das sich am weitesten rechts oben befindet und zusätzlich noch Platz in seiner Valenzschale aufweist, also der stärkste Elektronendieb ist, ist Fluor.
Leichtestes Elektronenopfer
Abnahme der Anziehungskräfte innerhalb einer Periode von rechts nach links, und innerhalb einer Gruppe von oben nach unten: Also muss das Element ganz unten links das schwächste Elektronenopfer sein. → Francium
Mehr Informationen
Metalle

Die ersten Metalle wurden 7000 v. Chr. entdeckt. Sie waren für die Menschheit von grosser Bedeutung zum Beispiel um Werkzeuge, Waffen oder Schmuck herzustellen. Sogar zwei Zeitalter wurden nach ihnen benannt; die Bronzezeit und die Eisenzeit. Metalle haben die Tendenz Elektronen abzugeben. Sie kommen in der Natur nur in Verbindungen mit Nichtmetallen (z.B. Erze, Salze) vor. Nur Edelmetalle, wie Gold, Silber, Platin und Kupfer sind als gediegene Metalle in der Natur zu finden. Lässt man Metalle (ausser Edelmetalle) an der freien Luft, oxidieren sie schnell (Bsp.: Eisen rostet). Dabei nimmt der Sauerstoff aus der Luft den Metallen die Valenzelektronen.
Metallatome ordnen sich im elementaren, festen Zustand in Metallgittern an. Im Gegensatz zum Ionengitter bilden sie Metallbindungen, bei denen sich freibewegliche Elektronen ausserhalb der positiv geladenen Atomrümpfe befinden.
Wichtigste Metallgruppen im Periodensystem
Ganz allgemein kann man feststellen, dass die Elemente nach unten und nach links im Periodensystem metallischer werden. Dies ist die Folge der Veränderung der Anziehungskräfte zwischen Kern und Valenzelektronen, wie im oberen Kapitel erklärt wurde. Diese Tendenz, der Zunahme des metallischen Charakters nach unten und links kann gut in den Hauptgruppen beobachtet werden. Die Alkalimetalle (1. Hauptgruppe) und die Erdalkalimetalle (2. Hauptgruppe) bestehen ganz aus Metallen. Ab der dritten Hauptgruppe sind nur noch die unteren Elemente Metalle. Je weiter nach rechts und oben man im Periodensystem sucht, desto weniger Metalle findet man.

- Alkalimetalle gehören zu der 1. Hauptgruppe und weisen genau ein Valenzelektron auf. Zu dieser Gruppe gehören Lithium, Natrium, Kalium, Rubidium, Caesium und Francium. Sie gehören zu den Leichtmetallen. Durch ihre geringe Dichte können sie auf dem Wasser schwimmen. Diese Metalle sind allgemein gut wasserlöslich. Ausserdem reagieren sie schnell mit dem Sauerstoff in der Luft, weswegen sie in einer Flüssigkeit unter Luftverschluss aufbewahrt werden.
Ausnahme: Wasserstoff gehört nicht zu den Alkalimetallen, obwohl es sich in der gleichen Gruppe des Periodensystems befindet! Es ist kein Metall, sondern ein Gas, gehört also zu den Nichtmetallen. Innerhalb der Nichtmetalle ist es zu schwach, um Elektronen aufzunehmen.
- Erdalkalimetalle gehören zu der 2. Hauptgruppe und weisen zwei Valenzelektronen auf. Beryllium, Magnesium, Calcium, Strontium, Barium und Radium gehören zu dieser Gruppe. Ihre Eigenschaften sind ähnlich wie die der Alkalimetalle. Sie sind ähnlich gut in Wasser löslich. Auch sie werden luftdicht in Flüssigkeit aufbewahrt. In der Natur kommen sie im Boden in Verbindungen vor. Bsp.: Ca2+Co32- = Gips
Legierungen
Legierungen nennt man die Verbindungen von mindestens zwei Metallen. Diese Metallverbindungen haben meist andere Eigenschaften als ihre Ursprungsmetalle, wie beispielsweise höhere Korrosionsbeständigkeit oder eine grössere Härte. Für die Industrie werden daher kaum reine Metalle verwendet, da ihre Legierungen grössere Vorteile bieten.
Ausnahme: Elektrische Leitungen: Reine Metalle werden oft für elektrische Leitungen verwendet, da sie eine höhere elektrische Leitfähigkeit aufweisen als die meisten Legierungen. Beispiele für Legierungen:
- Bronze: je nach Mischung gut verformbar, Cu + Sn
- Messing: meistens korrosionsbeständig, Cu + Zn
- Chromstahl: korrosionsbeständig, Fe + Cr
Nichtmetalle

Nichtmetalle haben die Tendenz Elektronen von anderen Elementen (Metallen) aufzunehmen, um ihre Valenzschale zu füllen. Nichtmetalle weisen nicht die charakteristischen Eigenschaften der Metalle auf. Im Gegensatz zu den Metallen gehen sie Ionenbindungen und Elektronenpaarbindungen ein.
Wichtigste Nichtmetallgruppen im Periodensystem
Ganz allgemein kann man feststellen, dass die Elemente nach oben und nach rechts im Periodensystem nichtmetallischer werden. Dies ist die Folge der Veränderung der Anziehungskräfte zwischen Kern und Valenzelektronen, wie im oberen Kapitel erklärt wurde. Diese Tendenz, der Zunahme des nichtmetallischen Charakters nach oben und rechts kann gut in den Hauptgruppen beobachtet werden. Die Edelgase (8. Hauptgruppe) bestehen ganz aus Nichtmetallen. Die Halogene (7. Hauptgruppe) bestehen, bis auf die untersten zwei Elemente auch aus Nichtmetallen. Bei der 6. Hauptgruppe sind "nur" die obersten drei Elemente Nichtmetalle. Je weiter nach links und unten man im Periodensystem sucht, desto weniger Nichtmetalle findet man.
- Chalkogene ist der Übername für die Elemente der 6. Hauptgruppe. Diese Gruppe besteht nicht einheitlich aus Nichtmetallen. Nach unten nimmt der metallische Charakter zu, weswegen die untersten Elemente Halbmetalle sind. Die Elemente dieser Gruppe sind: Sauerstoff (NiMe), Schwefel(NiMe), Selen(NiMe), Tellur (HMe) und Pollonium (HMe).
Sauerstoff ist das wichtigste Nichtmetall. Es ist an vielen Verbrennungsprozessen und der Korrosion beteiligt. Ausserdem wird es von fast allen Organismen zum Leben gebraucht.
- Halogene nennt man die Elemente der 7. Hauptgruppe, die alle (bis auf Astat) Nichtmetalle sind: Fluor, Chlor, Brom, Iod (und Astat → Halbmetall), Tennessine. Diese bezeichnet man auch mit dem Namen "Salzbildner". Diese Elemente sind im elementaren Zustand sehr reaktionsfreudig (Fluor ist der stärkste Elektronendieb), farbig und sie reagieren mit Metallen zu Salzen (Bsp. Kochsalz: NaCl) und mit Wasserstoff zu Halogenwasserstoffen (Bsp. Bromwasserstoff: HBr).
- Edelgase sind die Elemente der 8. Hauptgruppe und alles Nichtmetalle. Sie besitzen 8 Valenzelektronen und können somit kein weiteres Elektron mehr aufnehmen, weswegen sie nur unter extremen Bedingungen mit anderen Elementen reagieren. Dieser Tatsache nach haben sie auch ihren Namen bekommen. Sie wurden erst spät in der Geschichte der Menschen entdeckt, da sie nicht sehr häufig sind, nicht reagieren und somit immer gasförmig sind. Zu den Edelgasen gehören: Helium, Neon, Argon, Krypton, Xenon, Radon und Oganesson.
Bindungen
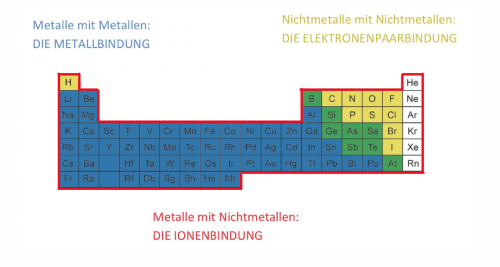
- Metall - Metall = Metallbindung (mehr dazu findest Du hier.)
Bsp.: Legierungen wie Bronze Cu + Sn

- Nichtmetall - Nichtmetall = Elektronenpaarbindung (mehr dazu findest Du hier.)
Bsp.: Wasser: H2O

- Metall - Nichtmetall = Ionenbindung (mehr dazu findest Du hier.)
Bsp.: Natriumchlorid Na + Cl

Halbmetalle

Die kleine Gruppe der Halbmetalle besteht aus Stoffen, die teilweise Eigenschaften der Metalle oder/und der Nichtmetalle besitzen.
Zu der Gruppe der Halbmetalle gehören folgende Elemente: Bor, Silicium, Germanium, Arsen, Selen, Antimon, Tellur, Polonium und Astat.
Halbmetalle sind grundsätzlich Halbleiter. Das bedeutet, dass ihre elektrische Leitfähigkeit zwischen der von Metallen (Leitern) und Nichtmetallen (Nichtleitern) liegt. Ihre Leitfähigkeit steigt mit zunehmender Temperatur (Heissleiter).
Video Simpleclub
Dieses Video eignet sich gut zur Einführung ins Thema Metalle und Nichtmetalle.
https://www.youtube.com/watch?v=UIlCND3AdCI
0.00-1.26: Das Video beginnt mit den vier Haupteigenschaften, die ein Metall erfüllen muss. (Leitfähigkeit, Wärmeleitfähigkeit, Verformbarkeit, metallischer Glanz)
1.26-2.32: Dann wird im Periodensystem erklärt, wo sich Metalle, Halbmetalle und Nichtmetalle befinden.
- Merke: 2.07: aufgrund ihrer Eigenschaft «nicht so elektrisch leitfähig» zu sein, werden die Halbmetalle auch Halbleiter genannt.
- Merke: 2.26: Wir unterscheiden nicht zwischen Metallen und Übergangsmetallen. Wir kategorisieren Übergangsmetalle auch als Metalle.
2.32-3.06: Anschliessend werden Bindungsarten angesprochen (Ionenbindungen, Metallbindung)
- Merke: 2.55: Wir sprechen bei einer Bindung zwischen zwei Metallen grundsätzlich von einer Metallbindung.
- Merke: 2.55: Es gibt zusätzlich eine dritte Bindungsart, die Elektronenpaarbindung, die auftritt, wenn zwei Nichtmetalle miteinander eine Verbindung eingehen.
3.06-4.40: Einteilung der Metalle nach Eigenschaften
- Merke: 3.06-3.31: Die Unterteilung der Metalle in Leicht- und Schwermetalle wird im Chemieunterricht in diesem Kapitel nicht genauer besprochen.
4.40-5.24: Zusammenfassung des Videos
Quellen
- Deuber, Roger: Das Periodensystem. Metalle und Nichtmetalle Arbeitsblatt V, in: MINT-ETH Zürich, gelesen am: 25.05.2020.
- Nichtmetalle, in: Wikipedia, https://de.wikipedia.org/wiki/Nichtmetalle, heruntergeladen am: 25.05.2020.
- Rutherford online, in: Uniterra, http://www.uniterra.de/rutherford/, heruntergeladen am: 25.05.2020.
- Chemie-simpleclub: Metalle & Halbmetalle – REMAKE. 21.10.2018. https://www.youtube.com/watch?v=UIlCND3AdCI, heruntergeladen am: 25.05.2020.