C Das Periodensystem: Unterschied zwischen den Versionen
(→Ein Element) |
(→Ein Element) |
||
| Zeile 52: | Zeile 52: | ||
| − | === Ein Element === | + | === Ein Element im PSE === |
Eine Zelle im Periodensystem stellt jeweils ein Element dar. Sie werden mit Abkürzungen ihrer lateinischen Namen gekennzeichnet. Oben auf der linken Seite findet man die Ordnungszahl. Anhand der Ordnungszahl sind die Elemente nummeriert. Ausserdem stellt sie die Anzahl Protonen und Elektronen im Atom dar. Dies ist logisch, da Elemente neutral sind d.h. es müssen gleichviele Protonen wie Elektronen vorhanden sein. | Eine Zelle im Periodensystem stellt jeweils ein Element dar. Sie werden mit Abkürzungen ihrer lateinischen Namen gekennzeichnet. Oben auf der linken Seite findet man die Ordnungszahl. Anhand der Ordnungszahl sind die Elemente nummeriert. Ausserdem stellt sie die Anzahl Protonen und Elektronen im Atom dar. Dies ist logisch, da Elemente neutral sind d.h. es müssen gleichviele Protonen wie Elektronen vorhanden sein. | ||
| Zeile 70: | Zeile 70: | ||
| − | Periodensystem der Elemente I Teil 1 I (musstewissen Chemie) https://youtu.be/J2KJRRH0E3Y?list=PLMRuqWRlK1n3A6xzvZmCt2BKu2kqdmK_j | + | ''Periodensystem der Elemente I Teil 1 I (musstewissen Chemie) https://youtu.be/J2KJRRH0E3Y?list=PLMRuqWRlK1n3A6xzvZmCt2BKu2kqdmK_j'' |
Dieses Video ist rundum den Aufbau des Periodensystems. Es beschäftigt sich mit folgenden Themen: Wie sind Atome aufgebaut? Worin unterscheiden sich Atome? Wie Werden die Atome angeordnet? Warum heisst es Periodensystem? | Dieses Video ist rundum den Aufbau des Periodensystems. Es beschäftigt sich mit folgenden Themen: Wie sind Atome aufgebaut? Worin unterscheiden sich Atome? Wie Werden die Atome angeordnet? Warum heisst es Periodensystem? | ||
Version vom 11. Juni 2020, 21:52 Uhr
Ein Text vor dem ersten Titel wird oberhalb des Inhaltsverzichnisses angezeigt
Inhaltsverzeichnis
Historisches
Der Russe Dimitri Mendelejew (1834-1907) und der Deutsche Lothar Meyer (1830-1895) erkannten, dass das Atomgewicht der Schlüssel zur Ordnung der Elemente ist.
Das PSE nach Meyer und Mendelejew
https://www.youtube.com/watch?v=XR0DR4XjF7U
In diesem Video erfahren wir über das Vorgehen Mendelejews bis er auf die Anordnung der Elemente gekommen ist. Es ist besonders interessant zu wissen, dass Mendelejew die Eigenschaften von noch nicht entdeckten Elementen vorhersagen konnte. Diese Vorhersagen wurde später auch bestätigt als man eines dieser Elemente gefunden hatte.
Interessante Ausschnitte:
Minute 1:10 - Mendelejews vorgehen ; Minute 2:25 - Lothar Meyers Rolle in der Entdeckung des PSE ; Minute 2:59 - Bestätigung von Mendelejews Vorhersagen ;
1864 entwickelten Dimitri Iwanowitsch Mendelejew (Russland) und Lothar Meyer (Deutschland) unabhängig von einander das Periodensystem. Vom Atombau wusste man zu dieser Zeit noch nicht viel. Sie kannten dafür die Eigenschaften von Atomen und konnten deren Masse bestimmen.
Sie ordneten die Elemente so an, dass die Masse von links nach rechts steigt. Elemente mit ähnlichen Eigenschaften setzten sie untereinander.
Später (~1913) behauptete Henry Moseley, Mendelejew und Meyer hätten die Elemente nach einem falschen Kriterium angeordnet. Es käme nicht auf die Masse sondern die Ordnungszahl an. Heute wissen wir, dass das bis auf ein paar Ausnahmen keinen Unterschied macht.
Dmitri Mendeleev: Great Minds
https://www.youtube.com/watch?v=IgA37CNa7Ow
Video auf Englisch mit interessanten Fakten über Mendelejews Leben und die Entdeckung des Periodensystems. Man erfährt über seine Kindheit, seine Liebesleben und sogar seinen Einfluss auf die Vodkaproduktion. Sein Vorgehen wird auch hier erneut beschrieben und mit Bilder veranschaulicht, wie Mendelejew sich die Elemente damals notiert hat und wie daraus die heutige Darstellung des Periodensystem zu erkennen ist.
Interessante Ausschnitte:
Minute 0:38-1:00 : Kindheit (Familie, Krankheit, Schule) ; Minute 1:15-2:30 : Seine Überlegung zum PSE ; Minute 2:33-3:00 : Liebesleben (Scheidung, grösste Liebe) ; Minute 3:05-3:10 : Einfluss auf die Vodkaproduktion ; Minute 3:20-3:38 : Nobelpreis (Verweigerung des Preises) ; Minute 3:45-3:58 : Neues Element nach Mendelejew bezeichnet ;
Ausnahmen:
Co – Ni
Te – I
Th – Pa
U - Np
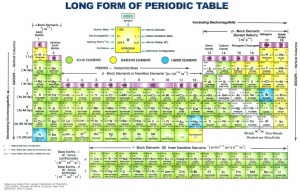
Ein Element im PSE
Eine Zelle im Periodensystem stellt jeweils ein Element dar. Sie werden mit Abkürzungen ihrer lateinischen Namen gekennzeichnet. Oben auf der linken Seite findet man die Ordnungszahl. Anhand der Ordnungszahl sind die Elemente nummeriert. Ausserdem stellt sie die Anzahl Protonen und Elektronen im Atom dar. Dies ist logisch, da Elemente neutral sind d.h. es müssen gleichviele Protonen wie Elektronen vorhanden sein.
Rechts-oben oder direkt unter der Elementbezeichnung in der Zelle befindet sich die Atommasse auch Massenzahl genannt. Die Massenzahl gibt zwei Sachen an: Die Atommasse und die Molmasse. Anhand der Massenzahl lässt sich auch berechnen, was die Anzahl Neutronen im Kern ist.
Die Wichtigsten Infos in einer Zelle des Periodensystems sind: Das Element, die Ordnungszahl und die Massenzahl.
Das Periodensystem - einfach erklärt (Simpleclub)
https://www.youtube.com/watch?v=lsVL6Bg4Y9U
Wichtige Stellen:
Minute 0:30 - Bedeutung einer Zelle im PSE
Periodensystem der Elemente I Teil 1 I (musstewissen Chemie) https://youtu.be/J2KJRRH0E3Y?list=PLMRuqWRlK1n3A6xzvZmCt2BKu2kqdmK_j
Dieses Video ist rundum den Aufbau des Periodensystems. Es beschäftigt sich mit folgenden Themen: Wie sind Atome aufgebaut? Worin unterscheiden sich Atome? Wie Werden die Atome angeordnet? Warum heisst es Periodensystem?
Wichtige Stellen:
Minute 2:24-3:35 - Beschreibung einer Zelle im PSE
Minute 3:53-5:40 - Berechnen der Neutronen im Kern
Gruppen und Perioden
Das Periodensystem ist in Gruppen und Perioden eingeteilt. Die Spalten sind die Gruppen und die Zeilen die Perioden, daher der Name Periodensystem. Mendelejew definierte dies anhand der periodischen Wiederholung der Eigenschaften der Elemente.
Gruppen
Es gibt acht Hauptgruppen und mehrere Nebengruppen. Die Elemente einer Gruppe enthalten alle gleich viele Valenzelektronen und haben ähnliche chemische Eigenschaften. Die Hauptgruppennummer gibt an, wie viele Valenzelektronen deren Elemente haben. Also haben zum Beispiel alle Elemente der 1. Hauptgruppe 1 Valenzelektron. Die Anzahl Valenzelektronen legt aber nicht die Eigenschaften eines Element fest, denn es gibt Hauptgruppen die nicht einheitlich sind. Einige Hauptgruppen weisen metallische aber auch nichtmetallische Elemente auf.
Namen der Hauptgruppen:
Hauptgruppe 1: Alkalimetalle
Hauptgruppe 2: Erdalkalimetalle
Hauptgruppe 3: Borgruppe
Hauptgruppe 4: Kohlenstoffgruppe
Hauptgruppe 5: Stickstoffgruppe
Hauptgruppe 6: Chalkogene
Hauptgruppe 7: Halogene
Hauptgruppe 8: Edelgase
Perioden
Es gibt sieben Perioden. In einer Periode haben die Elemente jeweils die gleiche Valenzschale. Die Periodenzahl entspricht der Anzahl Schalen im Schalenmodell. In jeder Periode befinden sich 8 Hauptgruppenelemente (Ausnahme: Periode 1 hat nur zwei Elemente, H und He).
Das Periodensystem - einfach erklärt (Simpleclub)
https://www.youtube.com/watch?v=lsVL6Bg4Y9U
Wichtige Stellen zu diesen Themen:
Minute 4:26 - Hauptgruppen
Minute 5:14 - Nebengruppen
Minute 6:37 - Perioden
Struktur der Elektronenhülle und Eigenschaften der Elemente
Unter de Elektronenhülle versteht man den Teil des Atoms, der aus Elektronen besteht. Wie viele Elektronen sich in der Hülle befinden, hängt von der Anzahl Protonen im Kern ab. In der Elektronenhülle befinden sich gleichviele negativ geladene Elektronen wie positiv geladene Protonen im Kern. Es ist der Aufenthaltsraum von Elektronen, der Anhand von Schalen und Orbitalen visualisiert werden kann. Die Struktur der Elektronenhülle bestimmt die physikalischen und chemischen Eigenschaften eines Atoms.
Die Elektronen weisen nicht alle die gleiche Energie auf. Man teilt sie auf verschieden Energieniveaus auf. Diese Energieniveaus nennt man Schalen (nach Bohrs Schalenmodell). In einer Schale können sich mehrere Elektronen aufhalten. Die Elektronen der äussersten Schale nennt man Valenzelektronen. Die Valenzelektronen haben den höchsten Energiegehalt und kommen als erstes in Kontakt mit anderen Atomen. Daher sind sie an Bindungen massgeblich beteiligt und für deren Bindungseigenschaften von grosser Bedeutung. Der Durchmesser der Elektronenhülle hängt davon ab wie viele Schalen dieses Elektron hat.
Jede Schale wird dann weiter in Unterschalen geteilt. Diese nennt man s, p, d und f-Unterschale. Pro Unterschale passen immer gleichviele Elektronen rein. Dann gibt es noch Orbitale. Orbitale sind Bereiche, wo eine grosse Wahrscheinlichkeit besteht, dort Elektronen anzutreffen. Die Orbitale werden immer mit 2 Elektronen besetzt, die einen unterschiedlichen Spinn haben müssen.
Bei der Besetzung der Elektronenschale kommt es zu einer kleinen Unregelmässigkeit beim wechsel von der 3. auf die 4. Schale. Dort ist es nämlich so, dass die 3d-Unterschale energiereicher ist als die 4s-Unterschale. Dies liegt daran, dass es auch abstossende Coulombkräfte gibt und diese führen zu einer Anhebung der Energiegehalts. Da die dritte Schale schon viele Elektronen enthält, wirken auch die 3d-Elektronen stärkere Abstossungskräfte als auf die 4s-Elektronen.Somit ist die 3d-Unterschale energiereicher, dies obwohl sie näher beim kern liegt.
https://www.youtube.com/watch?v=BaN5ZEoon_E
Anhand dieses Videos lässt sich besser verstehen, wie diese Aufteilung in Schalen, Unterschalen und Orbitalen gemacht wird. Es wird auch erklärt, weshalb die Elektronen in den Orbitalen einen unterschiedlichen Spinn haben. Ebenfalls wird das Energieniveau-Schema ziemlich übersichtlich und leicht erklärt. Am Ende ist klar was in der Elektronenhülle geschieht.
Periodensystem der Elemente I Teil 2 I (musstewissen Chemie) https://youtu.be/f5-W87IGLFY?list=PLMRuqWRlK1n3A6xzvZmCt2BKu2kqdmK_j
In diesem Video erfährt man mehr über das Periodensystem und folgende Themen werden erklärt:Atomaufbau und Elektronenschalen-Modell, verschiedene Grössen von Atomen und die Aussenelektronen. All diese Themen sind auch mit der Elektronenhülle verbunden.
Wichtige Stellen:
Minute 2:20-5:14 - Grösse von Atomen
Minute 5:16-8:38 - Aussenelektronen
Metalle und Nichtmetalle
Metalle
Nichtmetalle
Quellen
- Chemieunterlagen
- Wikipedia
- Zusätzliche Unterlagen von R.Deuber
Weblinks
- Swisseduc – Unterrichtsserver für Chemie
- Mediawiki Hilfeseite – So kann der Link näher beschrieben werden
- [2]
- [3]
- [4]