Säure/Base-Puffer: Unterschied zwischen den Versionen
(→Grafische Darstellung) |
|||
| (16 dazwischenliegende Versionen von 2 Benutzern werden nicht angezeigt) | |||
| Zeile 3: | Zeile 3: | ||
== Zusammensetzung == | == Zusammensetzung == | ||
| − | [[Bild: | + | [[Bild:Saeure-Base-Puffer.jpg|thumb|]] |
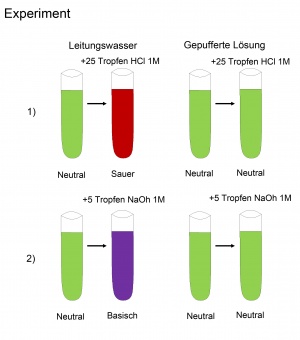
Ein Puffer muss so zusammengesetzt sein, dass er die Reaktion einer zugegebenen Säure bzw. Base mit Wasser abschwächt. | Ein Puffer muss so zusammengesetzt sein, dass er die Reaktion einer zugegebenen Säure bzw. Base mit Wasser abschwächt. | ||
| − | Wird zu der Lösung eine Säure hinzugegeben, muss eine Base vorhanden sein, die an Stelle von Wasser das H+ aufnimmt. Folglich muss das H+ von der Base stärker gebunden werden als von Wasser. Die Base darf jedoch nicht zu stark sein, da sich der pH-Wert sonst erhöht. Analog dazu muss bei Zugabe einer Base eine Säure vorhanden sein, welche an Stelle des Wassers das H+ spendet. Entsprechend gilt, dass das H+ der Säure eher abgegeben wird als das von Wasser. Auch die Säure darf nicht zu stark sein, da ansonsten der pH-Wert verringert wird. | + | Wird zu der Lösung eine Säure hinzugegeben, muss eine Base vorhanden sein, die an Stelle von Wasser das H<sup>+</sup> aufnimmt. Folglich muss das H<sup>+</sup> von der Base stärker gebunden werden als von Wasser. Die Base darf jedoch nicht zu stark sein, da sich der pH-Wert sonst erhöht. Analog dazu muss bei Zugabe einer Base eine Säure vorhanden sein, welche an Stelle des Wassers das H<sup>+</sup> spendet. Entsprechend gilt, dass das H<sup>+</sup> der Säure eher abgegeben wird als das von Wasser. Auch die Säure darf nicht zu stark sein, da ansonsten der pH-Wert verringert wird. |
Also verwendet man für den Puffer eine schwache Säure und ihre konjugierte Base. Man beachte, dass die Pufferwirkung eines Säure/Base-Paars im pH-Bereich um dessen pKs-Wert am besten ist. Dies bedeutet, dass die Säure und Base in gleicher Konzentration vorliegen. Wäre mehr Säure vorhanden, ist die Pufferwirkung bei der Zugabe von Säure schwächer. Folglich wäre bei höherer Basenkonzentration die Pufferwirkung bei der Zugabe von Base schwächer. | Also verwendet man für den Puffer eine schwache Säure und ihre konjugierte Base. Man beachte, dass die Pufferwirkung eines Säure/Base-Paars im pH-Bereich um dessen pKs-Wert am besten ist. Dies bedeutet, dass die Säure und Base in gleicher Konzentration vorliegen. Wäre mehr Säure vorhanden, ist die Pufferwirkung bei der Zugabe von Säure schwächer. Folglich wäre bei höherer Basenkonzentration die Pufferwirkung bei der Zugabe von Base schwächer. | ||
| Zeile 22: | Zeile 22: | ||
=== Grafische Darstellung === | === Grafische Darstellung === | ||
[[Bild:Pufferkurve.jpg|thumb|]] | [[Bild:Pufferkurve.jpg|thumb|]] | ||
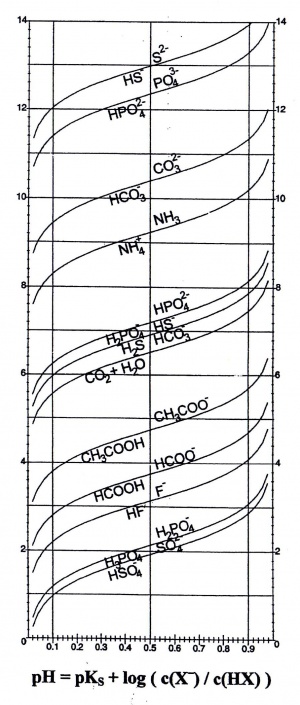
| − | Die Grafik zeigt, wie der Puffer wirkt. Die Wirkung hat bei relativ grossen Konzentrationsschwankungen eine kleine pH-Wert Veränderung zur Folge. Aus der Grafik kann man erkennen, dass das ideale Verhältnis dann herrscht, wenn der pH-Wert gleich dem pKs-Wert ist, sprich wenn das Verhältnis genau 1 entspricht. | + | Die Grafik zeigt, wie der Puffer wirkt. Die Wirkung hat bei relativ grossen Konzentrationsschwankungen eine kleine pH-Wert Veränderung zur Folge. Aus der Grafik kann man erkennen, dass das ideale Verhältnis dann herrscht, wenn der pH-Wert gleich dem pKs-Wert ist, sprich wenn das Verhältnis genau 1 entspricht.Die Grafik stellt unteranderem den Existenzbereich für Essigsäure(CH<sub>3</sub>COOH)/Acetat(CH<sub>3</sub>COO<sup>-</sup>) dar. Bei pH = 4 sind ca. 90 % Essigäure und 10 % Acetat vorhanden. Bei pH = 3 wurden praktisch alle Acetationen in Essigsäure umgesetzt. |
=== Anwendungsbeispiel === | === Anwendungsbeispiel === | ||
| Zeile 38: | Zeile 38: | ||
b) [[Bild:b.jpg]] | b) [[Bild:b.jpg]] | ||
| + | |||
| + | == Zusammenfassung: Video von the Simple Chemics == | ||
| + | === Puffergleichung/Henderson-Hasselbach Gleichung === | ||
| + | |||
| + | Link: [https://www.youtube.com/watch?v=Hi_O8oNUrUM&list=PLlxOW5VSfflNe3lzbGYNywU2WI0xzTgtF&index=10 Puffergleichung/ Henderson-Hasselbach Gleichung] | ||
| + | |||
| + | Zuerst zeigt das Video, wie die Puffergleichung hergeleitet wird. Anhand zweier Beispiele zeigen sie, wie man die Gleichung benutzt. Am Schluss vergleichen sie noch die pH-Werte einer Pufferlösung und Wasser, wenn man 1mol HCl hinzufügt. | ||
| + | |||
| + | Zu beachten: | ||
| + | * Eine gute Grundlage für das Video ist dieses Video: [https://www.youtube.com/watch?v=qYM6FW0Y9B0&list=PLlxOW5VSfflNe3lzbGYNywU2WI0xzTgtF&index=9 Puffer - was machen die]. Dort wird der Begriff Puffer definiert und erklärt, wozu sie gut sind. | ||
| + | * Bei der Herleitung der Gleichung wird wieder das Massenwirkungsgesetz benutzt, der Begriff wird aber nie erwähnt. Das Massenwirkungsgesetz ist allgemein definiert als Konzentration der Produkte geteilt durch die Konzentration der Edukte. | ||
| + | * Im Video wird die Gleichung nur anhand vom Essigsäure-Acetat Puffer erwähnt und benutzt. Natürlich gibt es auch noch viele andere Puffer. Immer ein konjugiertes Säure-Base-Paar kann als Puffer dienen. | ||
| + | * Zusätzlich dazu, dass man damit den pH-Wert einer Lösung berechnen kann, kann man die Puffergleichung auch dazu benutzen, selbst einen Puffer herzustellen. | ||
| + | * Möchte man einen Puffer selbst herstellen, muss man zuerst ein S/B-Paar auswählen, dessen pH-Wert möglichst nahe am erwünschten pH-Wert liegt. Dann muss man die chemischen Eigenschaften der Stoffe überprüfen und schlussendlich die Stoffe in das richtige Verhältnis setzen, so dass der pH-Wert der Lösung dem erwünschten Wert entspricht. | ||
| + | |||
| + | Besonders nützlich: | ||
| + | Das Video zeigt die Herleitung der Puffergleichung Schritt für Schritt und zeigt anhand des Beispiels, wie man damit rechnet. | ||
== Quellen == | == Quellen == | ||
| Zeile 43: | Zeile 60: | ||
Unterricht von R. Deuber | Unterricht von R. Deuber | ||
Wikipedia | Wikipedia | ||
| + | |||
| + | Video: [https://www.youtube.com/user/TheSimpleChemics The Simple Club] | ||
Aktuelle Version vom 18. Mai 2020, 20:12 Uhr
Ein Säure/Base-Puffer ist ein Stoffgemisch, welches in der Lage ist, den pH-Wert einer Lösung trotz Zugabe von Säuren oder Basen annähernd konstant zu halten. Das bedeutet, dass eine grössere Zugabe von Säure oder Base nur eine kleine Änderung des pH-Werts bewirkt.
Inhaltsverzeichnis
Zusammensetzung
Ein Puffer muss so zusammengesetzt sein, dass er die Reaktion einer zugegebenen Säure bzw. Base mit Wasser abschwächt. Wird zu der Lösung eine Säure hinzugegeben, muss eine Base vorhanden sein, die an Stelle von Wasser das H+ aufnimmt. Folglich muss das H+ von der Base stärker gebunden werden als von Wasser. Die Base darf jedoch nicht zu stark sein, da sich der pH-Wert sonst erhöht. Analog dazu muss bei Zugabe einer Base eine Säure vorhanden sein, welche an Stelle des Wassers das H+ spendet. Entsprechend gilt, dass das H+ der Säure eher abgegeben wird als das von Wasser. Auch die Säure darf nicht zu stark sein, da ansonsten der pH-Wert verringert wird.
Also verwendet man für den Puffer eine schwache Säure und ihre konjugierte Base. Man beachte, dass die Pufferwirkung eines Säure/Base-Paars im pH-Bereich um dessen pKs-Wert am besten ist. Dies bedeutet, dass die Säure und Base in gleicher Konzentration vorliegen. Wäre mehr Säure vorhanden, ist die Pufferwirkung bei der Zugabe von Säure schwächer. Folglich wäre bei höherer Basenkonzentration die Pufferwirkung bei der Zugabe von Base schwächer.
Puffergleichung von Henderson-Hasselbach
Oft braucht man die Puffergleichung von Henderson-Hasselbach zur Berechnung des pH-Wertes von Pufferlösungen. Dadurch lässt sich auch eine Grafik erstellen, in welcher der pH-Wert in Abhängigkeit zum Verhältnis zwischen der korrespondierenden Base und ihrer Säure dargestellt wird.
Herleitung
Grafische Darstellung
Die Grafik zeigt, wie der Puffer wirkt. Die Wirkung hat bei relativ grossen Konzentrationsschwankungen eine kleine pH-Wert Veränderung zur Folge. Aus der Grafik kann man erkennen, dass das ideale Verhältnis dann herrscht, wenn der pH-Wert gleich dem pKs-Wert ist, sprich wenn das Verhältnis genau 1 entspricht.Die Grafik stellt unteranderem den Existenzbereich für Essigsäure(CH3COOH)/Acetat(CH3COO-) dar. Bei pH = 4 sind ca. 90 % Essigäure und 10 % Acetat vorhanden. Bei pH = 3 wurden praktisch alle Acetationen in Essigsäure umgesetzt.
Anwendungsbeispiel
Gegeben: pKs Salzsäure (HCl) : 4.8
Wie ist das Verhältnis, wenn der pH-Wert
a) eine Einheit oberhalb des pKs-Wertes
b) eine Einheit unterhalb des pKs-Wertes liegt?
Zusammenfassung: Video von the Simple Chemics
Puffergleichung/Henderson-Hasselbach Gleichung
Link: Puffergleichung/ Henderson-Hasselbach Gleichung
Zuerst zeigt das Video, wie die Puffergleichung hergeleitet wird. Anhand zweier Beispiele zeigen sie, wie man die Gleichung benutzt. Am Schluss vergleichen sie noch die pH-Werte einer Pufferlösung und Wasser, wenn man 1mol HCl hinzufügt.
Zu beachten:
- Eine gute Grundlage für das Video ist dieses Video: Puffer - was machen die. Dort wird der Begriff Puffer definiert und erklärt, wozu sie gut sind.
- Bei der Herleitung der Gleichung wird wieder das Massenwirkungsgesetz benutzt, der Begriff wird aber nie erwähnt. Das Massenwirkungsgesetz ist allgemein definiert als Konzentration der Produkte geteilt durch die Konzentration der Edukte.
- Im Video wird die Gleichung nur anhand vom Essigsäure-Acetat Puffer erwähnt und benutzt. Natürlich gibt es auch noch viele andere Puffer. Immer ein konjugiertes Säure-Base-Paar kann als Puffer dienen.
- Zusätzlich dazu, dass man damit den pH-Wert einer Lösung berechnen kann, kann man die Puffergleichung auch dazu benutzen, selbst einen Puffer herzustellen.
- Möchte man einen Puffer selbst herstellen, muss man zuerst ein S/B-Paar auswählen, dessen pH-Wert möglichst nahe am erwünschten pH-Wert liegt. Dann muss man die chemischen Eigenschaften der Stoffe überprüfen und schlussendlich die Stoffe in das richtige Verhältnis setzen, so dass der pH-Wert der Lösung dem erwünschten Wert entspricht.
Besonders nützlich: Das Video zeigt die Herleitung der Puffergleichung Schritt für Schritt und zeigt anhand des Beispiels, wie man damit rechnet.
Quellen
Unterricht von R. Deuber Wikipedia
Video: The Simple Club