Fällungsreaktionen: Unterschied zwischen den Versionen
| (99 dazwischenliegende Versionen von 2 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
| − | Eine Fällungsreaktion ist eine chemische Reaktion, bei | + | Eine Fällungsreaktion ist eine chemische Reaktion, bei welcher verschiedene gut lösliche Salze in eine Flüssigkeit gegeben werden, in welcher sie sich auflösen. Die Ionen der gelösten Salze (Edukte) bilden jetzt untereinander mindestens ein Salz, dessen Löslichkeit so gering ist, dass sie ein festes Ionengitter bilden und ein Salz im festen Zustand entsteht. Bei der Neubildung des Salzes müssen nicht alle gelösten Ionen beteiligt sein. Das neue schwerlösliche Salz fällt aus, und es entsteht ein Niederschlag, der durch eine Trübung erkennbar ist. |
| − | + | == Einstiegsexperiment == | |
| − | + | Bleinitrat und Kaliumiodid werden in destilliertem Wasser gelöst. Destilliertes Wasser ist notwendig, da im Leitungswasser noch Spuren von Natriumchlorid, Kalk, Magnesium, Chlor und weiteren Salze enthalten sind. | |
| − | Pb | + | Pb(NO<sub>3</sub>)<sub>2</sub> → Pb<sup>2+</sup><sub>(aq)</sub> + 2NO<sub>3</sub><sup>-</sup><sub>(aq)</sub> |
| + | KI → K<sup>+</sup><sub>(aq)</sub> I<sup>-</sup><sub>(aq)</sub> | ||
| − | |||
| − | === | + | Die gelösten Blei- und Iodionen bilden jetzt das neue Salz Bleiiodid, welches schlecht löslich ist und deshalb als Fällung erscheint. |
| + | |||
| + | Pb<sup>2+</sup><sub>(aq)</sub> + 2NO<sub>3</sub><sup>-</sup><sub>(aq)</sub> + 2K<sup>+</sup><sub>(aq)</sub> + 2I<sup>-</sup><sub>(aq)</sub> → '''<FONT COLOR="red">{PbI<sub>2</sub>}<sub>(s)</sub></FONT>''' + 2K<sup>+</sup><sub>(aq)</sub> + 2NO<sub>3</sub><sup>-</sup><sub>(aq)</sub> | ||
| + | |||
| + | |||
| + | Zum Ausdrücken von Fällungsreaktionen gibt es auch noch eine kurze chemische Gleichung, die wäre für dieses Beispiel wie folgt: | ||
| + | |||
| + | |||
| + | Pb(NO<sub>3</sub>)<sub>2</sub><sub>(aq)</sub> + 2KI<sub>(aq)</sub> → '''<FONT COLOR="red">{PbI<sub>2</sub>}<sub>(s)</sub></FONT>''' + 2K<sup></sup>(NO<sub>3</sub>)<sub>(aq)</sub> | ||
| + | |||
| + | |||
| + | [[Bild:Faellungsreaktion.png|thumb|left| Links befindet sich das Bleinitrat, welches noch nicht ganz aufgelöst ist, und auf der rechten Seite ist das vollständig aufgelöste Kaliumiodid. Der gelbliche Streifen ist das neu entstandene Salz: Bleiiodid.]] | ||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
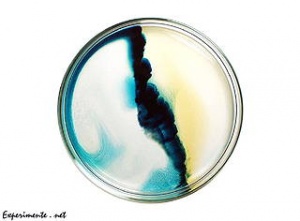
| + | Beim Experiment wurden beide Ausgangssalze gleichzeitig in die Petrischale gegeben. Wie das Bild zeigt, [[Diffusion|diffundiert]] Kaliumiodid schneller als Bleinitrat. Dies liegt daran, dass es gegenüber von Bleinitrat eine kleinere [[Masse und Grösse der Atome|Masse]] hat. | ||
| + | |||
| + | [http://www.youtube.com/watch?v=3xx4AUcT-D4] - Ein englisches Video auf YouTube, welches genau diese Reaktion demonstriert. | ||
| + | |||
| + | ==Anwendungen== | ||
| + | |||
| + | ===Nachweis von Ionen=== | ||
Wir haben ein Ion x<sup>-</sup> und wollen wissen, ob dies in einer Lösung enthalten ist. Dabei nehmen wir an, dass das x<sup>-</sup> - Ion mit einem y<sup>+</sup>-Ion ein Salz bildet. | Wir haben ein Ion x<sup>-</sup> und wollen wissen, ob dies in einer Lösung enthalten ist. Dabei nehmen wir an, dass das x<sup>-</sup> - Ion mit einem y<sup>+</sup>-Ion ein Salz bildet. | ||
| + | |||
Vorgehen: | Vorgehen: | ||
| − | + | #Ein y<sup>+</sup> - Ion suchen, das mit dem Ion x<sup>-</sup> ein schlecht lösliches Salz bildet. Aber dieses Ion y<sup>+</sup> muss in einem gut löslichen Salz enthalten sein. | |
| + | #Man gibt das Salz dazu, welches diese Bedingungen erfüllt. Wenn es eine Fällung gibt, respektive eine Trübung, ist das gesuchte Salz x<sup>-</sup> vorhanden und es entsteht ein Niederschlag. | ||
| + | |||
| + | Beispiel: | ||
| + | |||
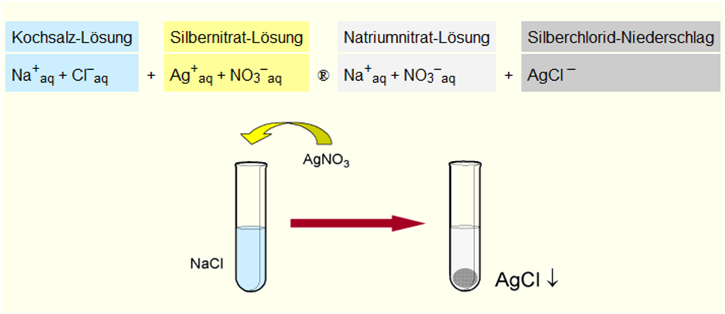
| + | Wir wollen wissen, ob in einer Lösung Chlorid-Ionen enthalten sind. Chlorid-Ionen kann man anhand von Silbernitrat nachweisen. Wenn es eine Fällung gibt, hat es folglich Chlorid-Ionen in der Lösung. | ||
| + | |||
| + | [[Bild:Nachweis von Chloridionen.png]] | ||
| + | |||
| + | |||
| + | === Kläranlage === | ||
| + | |||
| + | In Kläranlagen gibt es einen Reinigungsprozess, in welchen das Wasser in drei verschiedenen Stufen gereinigt wird: | ||
| + | |||
| + | #Mechanische Reinigung (Rechen filtern den Dreck heraus) | ||
| + | #Biologische Reinigung (Mikroorganismen fressen Dreck) | ||
| + | #Chemische Reinigung (Ausfällen von Phosphaten) | ||
| + | |||
| + | Mit dem Abwasser (u. a. Rückstände von Wasch- und Reinigungsmitteln, Fäkalien) und Abschwemmungen landwirtschaftlicher Flächen (Düngung) können große Mengen Nähstoffe (vor allem Phosphate und Nitrate) in die Gewässer gelangen und das Wachstum der Wasserpflanzen beschleunigen. Wenn Bäche, Flüsse und Seen mit Nährstoffen wie Phosphor- und Stickstoffverbindungen überbelastet werden, spricht man von Eutrophierung (Überdüngung). | ||
| + | In der chemischen Reinigung werden unter anderem diese Phosphat-Ionen ausgefällt, um eine solche Eutrophierung zu verhindern. | ||
| + | Gelöste Phosphate können mit Hilfe geeigneter Fällungsmittel in ungelöste Phosphate umgewandelt und als Feststoff aus dem Abwasser entfernt werden. Solch ein Fällungsmittel, welches heute verwendet wird, ist das Eisenchlorid FeCl, dessen Eisen-Ion mit Phosphat ein schlecht lösliches Salz, genannt Eisen(III)-phosphat, bildet. [[Bild:Eutrophierung3.JPG|thumb|right|Eutrophierung]] | ||
| + | |||
| + | |||
| + | |||
| + | Na<sup>+</sup><sub>3</sub>Po<sub>4</sub><sup>3-</sup> + Fe<sup>3+</sup>Cl<sup>-</sup><sub>3</sub> → '''<FONT COLOR="brown">Fe<sup>3+</sup>PO<sub>4</sub><sup>3-</sup><sub>(s)</sub></FONT>''' + 3Na<sup>+</sup>Cl<sup>-</sup><sub>(aq)</sub> | ||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | === Herstellung von Berliner Blau === | ||
| + | |||
| + | |||
| + | [[Bild:Berliner Blau.png|thumb|left]] | ||
| + | [[Bild:Bildung von Berliner Blau.JPG|thumb|left]] | ||
| + | Berliner Blau ist ein Name für eine blaue Eisenverbindung. Es wird in erster Linie als dunkelblaues Farbpigment verwendet und ist in der Fachliteratur unter verschiedensten Namen, wie beispielsweise Pariser Blau, Preussisch Blau, Turnbulls Blau oder auch Eisencyanblau zu finden. Besonders seit dem 18. Jahrhundert zählt es in der Malerei zu den am häufigsten verwendeten blauen Pigmenten. Des weiteren nutzt man es heute beispielsweise auch als Anstrichmittel oder zur Herstellung von Tinten. | ||
| − | + | Berliner Blau wird in einer Fällungsreaktion hergestellt, wobei Eisenchlorid (FeCl) und Kaliumhexacyanidoferrat (K<sub>4</sub>[Fe(CN)<sub>6</sub>]) in Wasser gelöst werden. Hexacyanoferrat bzw. Fe(CN)<sub>6</sub> ist ein Komplexsalz und wird deshalb nicht weiter zerlegt, wie in der untenstehenden chemieschen Gleichung zu erkennen ist. | |
| − | |||
| − | + | Fe<sup>3+</sup>Cl<sup>-</sup><sub>3</sub><sub>(aq)</sub> + K<sup>+</sup><sub>4</sub>[Fe<sup>2+</sup>(CN<sup>-</sup>)<sub>6</sub>]<sup>4-</sup><sub>(aq)</sub> → '''<FONT COLOR="blue">K<sup>+</sup>Fe<sup>3+</sup>[Fe<sup>2+</sup>(CN<sup>-</sup>)<sub>6</sub>]<sup>4-</sup><sub>(s)</sub></FONT>''' + 3K<sup>+</sup> + 3Cl<sup>-</sup> | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
== Quellen == | == Quellen == | ||
| − | * | + | * Durchführung des "Einstiegsexperiments" an der Kantonsschule Baden |
| − | + | * Eigene Fotografie und Schema (Einstiegsexperiment) | |
| + | * Chemienotizen vom Unterricht von Herrn R.Deuber an der Kantonsschule Baden | ||
| + | * Microsoft Encarta Lernen und Wissen 2006 | ||
| + | * [http://www.seilnacht.com/Download/Abblaupi.doc] - Dokument von seilnacht.com | ||
| + | * [http://www.seilnacht.com/Lexikon/Berliner.htm] - Abbildung und Informationen von seilnacht.com | ||
| + | * [http://www.uni-protokolle.de/Lexikon/F%E4llung.html] - Fällungsreaktion | ||
== Weblinks == | == Weblinks == | ||
| − | * [http://www. | + | * [http://www.youtube.com/watch?v=3xx4AUcT-D4] - Fällungsreaktion |
| − | * [http://www. | + | * [http://www.seilnacht.com/Lexikon/Berliner.htm] - Berliner Blau |
[[Kategorie:Chemie]] | [[Kategorie:Chemie]] | ||
Aktuelle Version vom 18. Mai 2020, 20:38 Uhr
Eine Fällungsreaktion ist eine chemische Reaktion, bei welcher verschiedene gut lösliche Salze in eine Flüssigkeit gegeben werden, in welcher sie sich auflösen. Die Ionen der gelösten Salze (Edukte) bilden jetzt untereinander mindestens ein Salz, dessen Löslichkeit so gering ist, dass sie ein festes Ionengitter bilden und ein Salz im festen Zustand entsteht. Bei der Neubildung des Salzes müssen nicht alle gelösten Ionen beteiligt sein. Das neue schwerlösliche Salz fällt aus, und es entsteht ein Niederschlag, der durch eine Trübung erkennbar ist.
Inhaltsverzeichnis
Einstiegsexperiment
Bleinitrat und Kaliumiodid werden in destilliertem Wasser gelöst. Destilliertes Wasser ist notwendig, da im Leitungswasser noch Spuren von Natriumchlorid, Kalk, Magnesium, Chlor und weiteren Salze enthalten sind.
Pb(NO3)2 → Pb2+(aq) + 2NO3-(aq)
KI → K+(aq) I-(aq)
Die gelösten Blei- und Iodionen bilden jetzt das neue Salz Bleiiodid, welches schlecht löslich ist und deshalb als Fällung erscheint.
Pb2+(aq) + 2NO3-(aq) + 2K+(aq) + 2I-(aq) → {PbI2}(s) + 2K+(aq) + 2NO3-(aq)
Zum Ausdrücken von Fällungsreaktionen gibt es auch noch eine kurze chemische Gleichung, die wäre für dieses Beispiel wie folgt:
Pb(NO3)2(aq) + 2KI(aq) → {PbI2}(s) + 2K(NO3)(aq)
Beim Experiment wurden beide Ausgangssalze gleichzeitig in die Petrischale gegeben. Wie das Bild zeigt, diffundiert Kaliumiodid schneller als Bleinitrat. Dies liegt daran, dass es gegenüber von Bleinitrat eine kleinere Masse hat.
[1] - Ein englisches Video auf YouTube, welches genau diese Reaktion demonstriert.
Anwendungen
Nachweis von Ionen
Wir haben ein Ion x- und wollen wissen, ob dies in einer Lösung enthalten ist. Dabei nehmen wir an, dass das x- - Ion mit einem y+-Ion ein Salz bildet.
Vorgehen:
- Ein y+ - Ion suchen, das mit dem Ion x- ein schlecht lösliches Salz bildet. Aber dieses Ion y+ muss in einem gut löslichen Salz enthalten sein.
- Man gibt das Salz dazu, welches diese Bedingungen erfüllt. Wenn es eine Fällung gibt, respektive eine Trübung, ist das gesuchte Salz x- vorhanden und es entsteht ein Niederschlag.
Beispiel:
Wir wollen wissen, ob in einer Lösung Chlorid-Ionen enthalten sind. Chlorid-Ionen kann man anhand von Silbernitrat nachweisen. Wenn es eine Fällung gibt, hat es folglich Chlorid-Ionen in der Lösung.
Kläranlage
In Kläranlagen gibt es einen Reinigungsprozess, in welchen das Wasser in drei verschiedenen Stufen gereinigt wird:
- Mechanische Reinigung (Rechen filtern den Dreck heraus)
- Biologische Reinigung (Mikroorganismen fressen Dreck)
- Chemische Reinigung (Ausfällen von Phosphaten)
Mit dem Abwasser (u. a. Rückstände von Wasch- und Reinigungsmitteln, Fäkalien) und Abschwemmungen landwirtschaftlicher Flächen (Düngung) können große Mengen Nähstoffe (vor allem Phosphate und Nitrate) in die Gewässer gelangen und das Wachstum der Wasserpflanzen beschleunigen. Wenn Bäche, Flüsse und Seen mit Nährstoffen wie Phosphor- und Stickstoffverbindungen überbelastet werden, spricht man von Eutrophierung (Überdüngung). In der chemischen Reinigung werden unter anderem diese Phosphat-Ionen ausgefällt, um eine solche Eutrophierung zu verhindern.
Gelöste Phosphate können mit Hilfe geeigneter Fällungsmittel in ungelöste Phosphate umgewandelt und als Feststoff aus dem Abwasser entfernt werden. Solch ein Fällungsmittel, welches heute verwendet wird, ist das Eisenchlorid FeCl, dessen Eisen-Ion mit Phosphat ein schlecht lösliches Salz, genannt Eisen(III)-phosphat, bildet.
Na+3Po43- + Fe3+Cl-3 → Fe3+PO43-(s) + 3Na+Cl-(aq)
Herstellung von Berliner Blau
Berliner Blau ist ein Name für eine blaue Eisenverbindung. Es wird in erster Linie als dunkelblaues Farbpigment verwendet und ist in der Fachliteratur unter verschiedensten Namen, wie beispielsweise Pariser Blau, Preussisch Blau, Turnbulls Blau oder auch Eisencyanblau zu finden. Besonders seit dem 18. Jahrhundert zählt es in der Malerei zu den am häufigsten verwendeten blauen Pigmenten. Des weiteren nutzt man es heute beispielsweise auch als Anstrichmittel oder zur Herstellung von Tinten.
Berliner Blau wird in einer Fällungsreaktion hergestellt, wobei Eisenchlorid (FeCl) und Kaliumhexacyanidoferrat (K4[Fe(CN)6]) in Wasser gelöst werden. Hexacyanoferrat bzw. Fe(CN)6 ist ein Komplexsalz und wird deshalb nicht weiter zerlegt, wie in der untenstehenden chemieschen Gleichung zu erkennen ist.
Fe3+Cl-3(aq) + K+4[Fe2+(CN-)6]4-(aq) → K+Fe3+[Fe2+(CN-)6]4-(s) + 3K+ + 3Cl-
Quellen
- Durchführung des "Einstiegsexperiments" an der Kantonsschule Baden
- Eigene Fotografie und Schema (Einstiegsexperiment)
- Chemienotizen vom Unterricht von Herrn R.Deuber an der Kantonsschule Baden
- Microsoft Encarta Lernen und Wissen 2006
- [2] - Dokument von seilnacht.com
- [3] - Abbildung und Informationen von seilnacht.com
- [4] - Fällungsreaktion