Die Beeinflussung der Reaktionsgeschwindigkeit: Unterschied zwischen den Versionen
K |
|||
| (130 dazwischenliegende Versionen von 2 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
| − | + | '''Unter Reaktionsgeschwindigkeit (RG) versteht man die sich ändernde Konzentration (Δc) pro Zeiteinheit (Δt).''' Oder anders formuliert: | |
| − | + | '''Unter RG versteht man die Abnahme der Eduktkonzentration bzw. Zunahme der Produktkonzentration pro Zeiteinheit.''' | |
| + | |||
| + | • '''RG = Δc / Δt''' | ||
| + | |||
| + | Die Reaktionsgeschwindigkeit gibt also an, wie schnell Edukte zu Produkte reagieren. Oder anderst gesagt, die Reaktionsgeschwindigkeit gibt an, wie viele Teilchen pro Zeit in einer chemischen Reaktion umgesetzt werden. Auf der Teilchenebene betrachtet kann die Reaktionsgeschwindigkeit durch drei Arten erhöht werden: | ||
| + | |||
| + | • Die Anzahl der Zusammenstösse der Teilchen wird erhöht (die Erfolgsquote bleibt gleich). | ||
| + | |||
| + | • Die Erfolgsquote wird erhöht (die Anzahl Zusammenstösse bleibt gleich). | ||
| + | |||
| + | • Die Anzahl Zusammenstösse und die Erfolgsquote werden erhöht. | ||
| + | |||
| + | Unter ''Erfolgsquote'' versteht man die Stärke der Zusammenstösse der Teilchen. Teilchen reagieren miteinander erst, wenn die Kollision genug stark ist, d.h. wenn sie die Aktivierungsenergie besitzen. Die Teilchen brauchen also eine höhere kinetische Energie um stärkere Zusammenstösse zu erzeugen. | ||
| + | |||
| + | Die Reaktionsgeschwindigkeit hängt von mehreren Faktoren ab. Diese Faktoren sind '''Zerteilgrad''', '''Konzentration''', '''Temperatur''', '''Druck''' und '''Katalysator'''. | ||
| + | |||
| + | Reaktionen enstehen oft nur dann, wenn Teilchen erfolgreich zusammenstossen. | ||
| + | Für einen erfolgreichen Zusammenstoss müssen nun zwei Bedingungen erfüllt sein: | ||
| + | |||
| + | • Der Zusammenstoss muss stark genug sein, um eine Reaktion auszulösen. Die Teilchen müssen also eine gewissen Mindestenergie (eine gewissene Erfolgsquote) aufweisen. | ||
| + | |||
| + | • Der Zusammenstass muss in der richtigen räumlichen Orientierung der Teilchen erfolgen. | ||
| + | |||
| + | [[Datei:Energiediagramm.jpg|200px|thumb|right|Energiediagramm]] | ||
| + | |||
| + | Je mehr Zusammenstösse es gibt, desto grösser ist die Reaktionsgeschwindigkeit. | ||
| + | Bei Zunahme jedes obengennanten Faktors werden diese Zusammenstösse der Teilchen erhöht und somit führt dies zu einem schnelleren Verlauf der Reaktion. | ||
| + | |||
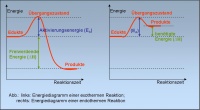
| + | Die Aktivierungsenergie ist das Mass für die Reaktionsgeschwindigkeit. Je grösser die Aktivierungsenergie, desto kleiner ist Reaktionsgeschwindigkeit. Dies ist so, weil es weniger Teilchen hat, welche die Aktivierungsenergie haben und somit hat es weniger Teilchen, die miteinander reagieren. Zum Beispiel verläuft eine Reaktion, in der ein Katalysator beteiligt ist, viel schneller, da der Katalysator die Aktivierungsenergie heruntersetzt (siehe: ''5. Katalysator'' [http://www.rdeuber.ch/chemiewiki/index.php?title=Die_Beeinflussung_der_Reaktionsgeschwindigkeit#Katalysator)]). Die Aktivierungsenergie ist diejenige Energie, die gebraucht wird, um die alten Bindungen der Edukte zu lockern, damit die neuen Bindungen der Produkte gebildet werden können. | ||
__TOC__ | __TOC__ | ||
| − | == | + | == Zerteilungsgrad == |
| + | Teilchen können nur an ihren Grenzflächen miteinander kollidieren und reagieren. Je grösser nun diese Grenzflächen sind, desto mehr Zusammenstösse sind möglich (jedoch bleibt die Erfolgsquote gleich). Je grösser also der Zerteilungsgrad oder die Oberfläche der Teilchen ist, desto höher ist die Reaktionsgeschwindigkeit. Es gibt unterschiedliche Möglichkeiten zur Oberflächenvergrösserung von Feststoffen: | ||
| + | |||
| + | - Zerkleinerung | ||
| + | |||
| + | - Schmelzen, Verdampfen | ||
| + | |||
| + | - Auflösen in einem Lösungsmittel | ||
| + | |||
| + | |||
| + | === Beispiele: Biologie/Feuerspeien/Stahlwolle === | ||
| + | Unser Körper profitiert von der Reaktionsgeschwindigkeitserhöhung durch die Oberflächenvergrösserung. So finden wir in der Lunge 300 Millionen Lungenblässchen mit einer Gesamtgrösse von 100m<sup>2</sup>), was den Gasaustausch von Sauerstoff und Kohlendioxid ermöglicht. Die Resorption der Nährstoffe vom Darm ins Blut wird erst durch die Darmoberfläche von 180m<sup>2</sup>), welche von den Darmzotten ensteht, ermöglicht. | ||
| + | Das Prinzip der Oberflächenvergrösserung ist auch die Grundlage beim Feuerspeien. Das Brandmittel (z.B. Kerosin), welches im Anfangszustand schwerer entzündlich ist, wird beim Herauspusten fein zerstäubt, wodurch die Angriffsoberfläche für das Feuer vergrössert und dadurch leichter entzündbar wird. | ||
| + | |||
| + | Könnt ihr euch Vorstellung, dass Stahl brennt? In der Tat ist dies möglich. Aber nur wenn auch hier das Prinzip der Oberflächenvergrösserung angewendet wird. Ein solides Stahlstück würde erst ab einigen hundert Grad anfangen zu brennen. Wenn die Oberfläche aber genug stark vergrössert wird, was bei Stahlwolle der Fall ist, kann man die Stahlwolle ohne Probleme mit einem Feuerzeug zum Brennen zu bringen. | ||
| + | |||
| + | == Weblinks == | ||
| + | * [https://www.youtube.com/watch?v=fqp3hGWTho0/ Feuerspucken] – Video zum Feuerspucken als Erhöhung des Zerteilgrades (Simpleclub) | ||
| − | |||
== Konzentration == | == Konzentration == | ||
| + | |||
| + | Je höher die Konzentration ist, desto mehr Teilchen sind in einem bestimmten Volumen vorhanden. Dies führt zu einer höheren Zusammenstosswahrscheinlichkeit der Reaktionspartnern. Die Erfolgsquote wird dabei aber nicht erhöht, denn es gibt zwar mehr Zusammenstösse aber die Stärke der Zusammenstösse steigt nicht, da die kinetische Energie der Teilchen gleich bleibt. | ||
| + | |||
| + | Bei einer Reaktion reagieren zwei Stoffe A und B (Edukte/Ausgangsstoffe) vollständig zum Stoff AB (Produkt/Endstoff). | ||
| + | |||
| + | A + B → AB | ||
| + | |||
| + | Bei dieser Reaktion wird die Konzentrationsänderung der Edukte nicht linear sinken und die Konzentrationsänderung der Produkte nicht linear steigen. Denn man muss hier wieder auf der Teilchenebene argumentieren. Wie wir bereits wissen, ist die Reaktionsgeschwindigkeit abhängig von der Konzentration. Anfangs ist die Konzentration der Ausgangsstoffe ([A] und [B]) maximal und die Konzentration des Endstoffes ([AB]) minimal bzw. gleich 0, da ja noch keine Edukte miteinander reagiert haben. Nun beginnt die Reaktion und die Edukte verbinden sich zum Produkt. Dabei fällt die Konzentration der Edukte bzw. dabei steigt die Konzentration der Produkte. Die Reaktionsgeschwindigkeit ist anfangs hoch, und wird langsamer je mehr Teilchen bereits reagierten haben, da die Anzahl der Zusammenstösse vermindert wird. Die Konzentration der Edukte nimmt also exponentiell ab. Da die Konzentration des Endstoffes direkt abhängig ist von der Konzentration der Ausgangsstoffe ist, muss die Konzentration des Endstoffes umgekehrt exponentiall steigen. | ||
| + | |||
| + | Zusammenfassend kann man also sagen, die Reaktionsgeschwindigkeit ist von der momentanen Konzentration der Edukte abhängig. | ||
| + | |||
| + | === Experimentelle Bestimmung der Reaktionsgeschwindigkeitskonstante k === | ||
| + | |||
| + | [[Datei:Reaktionsgeschwindigkeitskonstante.PNG|200px|thumb|right|Reaktionsgeschwindigkeitskonstante]] | ||
| + | |||
| + | Die Reaktionsgeschwindigkeit ist proportional zur Anzahl Zusammenstösse. Dadurch ist die Reaktionsgeschwindigkeit auch proportional zur Konzentration, wenn die Ausgangsstoffe gleichermassen erhöht wird. Daraus ergibt sich: | ||
| + | |||
| + | '''RG = Δc / Δt = k * [A] * [B]''' | ||
| + | |||
| + | Die Sekantensteigung = Δc / Δt | ||
| + | |||
| + | Δc = [B] - [A] | ||
| + | |||
| + | Δt = B - A | ||
| + | |||
| + | Wenn man nun die Differenzen von A und B (Δc und Δt) zu 0 streben lässt erhält man die Tangentensteigung. Die Tangentensteigung ist die Reaktionsgeschwindigkeit. | ||
| + | |||
| + | ''Beispiele:'' | ||
| + | |||
| + | 1) A → B ≙ RG = k * [A] | ||
| + | |||
| + | 2) A + B → C ≙ RG = k * [A] * [B] | ||
| + | |||
| + | 3) 2A → B ≙ RG = k * [A] * [A] = k * [A]<sup>2</sup> | ||
| + | |||
| + | ''Weiteres Beispiel anhand der Zellatmung:'' Sauerstoff und Glucose reagiert zu Wasser und Kohlendioxid: | ||
| + | |||
| + | 6 O<sub>2</sub> + C<sub>6</sub>H<sub>12</sub>O<sub>6</sub> → 6 H<sub>2</sub>O + 6 CO<sub>2</sub> | ||
| + | |||
| + | RG = k * [O<sub>2</sub>]<sup>6</sup> * [C<sub>6</sub>H<sub>12</sub>O<sub>6</sub>] | ||
| + | |||
| + | === Die Landolt-Reaktion === | ||
| + | |||
| + | [[Datei:Landolt-Reaktion.PNG|200px|thumb|right|Landolt-Reaktion]] | ||
| + | |||
| + | Die Landolt-Reaktion beschreibt, dass die Geschwindigkeit einer chemischen Reaktion von der Konzentration ihrer Edukte und der Temperatur abhängt. | ||
| + | |||
| + | Bei Zugabe von Stärke führt das entstehende Iod zu einem blauem Farbumschlag. In Abhängigkeit von Temperatur und Konzentration der Lösungen kann auf einige Sekunden genau vorausbestimmt werden, wann der Farbumschlag auftreten soll. | ||
| + | |||
| + | In diesem Video wird die Reaktionsgeschwindigkeit sehr schön illustriert: [http://www.youtube.com/watch?v=x62N7KNFLMc] | ||
| + | |||
| − | |||
| + | . | ||
== Temperatur == | == Temperatur == | ||
| + | Je höher die Temperatur ist, desto höher ist die kinetische Energie (Bewegungsenergie) der Teilchen. Dies führt einerseits zu mehr Zusammenstössen und somit zu einem schnelleren Reaktionsverlauf. Andererseits wird die Erfolgsquote (die Anzahl Teilchen, welche die AE aufweisen und reagieren können) erhöht, was wiederum zu einem schnelleren Reaktionsverlauf führt, da durch die höhere kinetische Energie der Teilchen die Zusammenstösse stärker sind. | ||
| + | Vorraussetzung in einem chemischen System, damit eine Reaktion abläuft, ist, dass ein bestimmter Energiebetrag erreicht oder überschritten werden muss. Es muss also eine Aktivierungsenergie (AE) hinzugefügt werden, damit diese Schwelle erreicht oder überschritten werden kann. Diese zusätzliche Energie ist notwendig damit vorhandene Bindungen gelöst werden können. | ||
| + | |||
| + | === RGT-Regel === | ||
| + | Die Reaktionsgeschwindigkeits-Temperatur-Regel (RGT-Regel), sagt aus, dass eine Erhöhung der Temperatur um 10°C meist eine Verdoppelung der Reaktionsgeschwindigkeit bewirkt. | ||
| + | |||
| + | Wohingegen eine Verdoppelung der Konzentration eines Edukts auch zu einer Verdoppellung der Reaktionsgeschwindigkeit führt. | ||
=== Dampfkochtopf === | === Dampfkochtopf === | ||
| + | [[Datei:Dampfkochtopf.gif|170px|thumb|right|Dampfkochtopf]] | ||
| − | + | Eine gute Veranschaulichung der RGT-Regel sieht man am Prinzip des Dampfkochtopfs. | |
| − | + | Durch die Erhöhung der Wassertemperatur auf 100°C beginnt das Wasser vom flüssigen in den gasförmigen Zustand zu verdampfen. Da das Wasser, bei gleicher Anzahl Teilchen, im gasförmigen Zustand ein grösseres Volumen einnimmt als im flüssigen Zustand und es nicht durch den Dampfkochtopf entweichen kann, erhöht sich der Druck. Bei höherem Druck steigt der Siedepunkt von Wasser. Im Falle des Dampfkochtopfs auf 120°C. Die Temperaturdifferenz von 20°C, die sich dadurch ergibt, führt zu einer Vervierfachung der Reaktionsgeschwindigkeit. Das heisst die Kochzeit mit Benützung eines Dampfkochtopfs wird viermal schneller. | |
| − | |||
| − | |||
| − | + | Den genauen gegenteiligen Effekt erlebt man beim Bergsteigen. Je höher über Meer man sich befindet, desto tiefer ist der Druck. Dies führt dazu, dass der Siedepunkt von Wasser tiefer wird. | |
| − | |||
| − | |||
| − | + | Vergleicht man aber die Zunahme der kinetischen Energie der Teilchen, bei einer Temperaturerhöhung von 100°C auf 120°C, mit der Reaktionsgeschwindigkeit, so stellt man fest, dass die kinetische Energie nur um etwa 5% steigt. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | 100°C ≙ 373 Kelvin | |
| − | + | 120°C ≙ 393 Kelvin | |
| − | |||
| − | == | + | (393 K - 373 K) / 373 K = ~0.05 = 5% |
| − | + | Wie kann eine 5%tige Erhöhung der kinetischen Energie der Teilchen eine 4 mal schnellere Reaktionsgeschwindigkeit verursachen? | |
| − | + | Eine Antwort darauf liefert die ''Boltzmann-Verteilung'' (siehe: 3.3 Boltzmann-Verteilung [http://www.rdeuber.ch/chemiewiki/index.php?title=Die_Beeinflussung_der_Reaktionsgeschwindigkeit#Boltzmann-Verteilung]) | |
| + | === Boltzmann-Verteilung === | ||
| + | [[Datei:Boltzmann Verteilung.PNG|225px|thumb|right|Boltzmann-Verteilung]] | ||
| − | + | Damit eine Reaktion ensteht müssen die Teilchen eine Aktivierungsenergie erreichen oder überwinden. Die Aktivierungsenergie ist diejenige Energie, die gebraucht wird, um die alten Bindungen der Edukte zu lockern, damit die neuen Bindungen der Produkte gebildet werden können. Die Boltzmann-Verteilung ist eine Verteilung der Wahrscheinlichkeit der Geschwindigkeit der Teilchen bei einer bestimmten Temperatur. Ist die Temperatur tiefer, so ist auch die kinetische Energie der Teilchen tiefer. Je höher die Temperatur ist, desto grösser ist das Spektrum der Geschwindigkeit, welche die Teilchen einnehmen können. Dadurch ist die Wahrscheinlichkeit höher, dass es mehr Teilchen gibt, welche die Mindestenergie besitzen. Dem Maximum einer Kurve entspricht die wahrscheinlichste Geschwindigkeit. Bei höherer Temperatur besitzt ein grösserer Anteil der Teilchen die für eine bestimmte Reaktion nötige Mindestenergie, so dass sich in einem bestimmten Zeitintervall mehr Teilchen umsetzen können und die betreffende Reaktion mit größerer Geschwindigkeit abläuft. | |
| + | Die grau schraffierte Flache in der Grafik der Boltzmann-Verteilung wiederspiegelt die Anzahl reagierfähigen Teilchen. Wie man nun sieht, Vergrössert sich diese Fläche überproportional im Vergleich zum Temperaturanstieg. | ||
| − | + | Auf den Dampftopf angewandt, bedeutet dies nun, dass die Flachengrösse (Anzahl reagierfähiger Teilchen) bei 120° 4 mal grösser ist (obwohl der Temperunterschied nur 5% beträgt), als bei 100°C. | |
| − | ( | ||
| + | Die mittlere kinetische Energie ist proportional zur Temperatur. Die Reaktionsgeschwindigkeit ist proportional zum Anteil Teilchen, welche mindestens die Aktivierungsenergie aufweisen. Sie ist aber nicht proportional zur mittleren kinetischen Energie. | ||
| − | |||
| − | + | ''Wieso trocknet nasse Wäsche an der Luft?'' | |
| − | + | Bei 100°C verdampft Wasser. Die Wasserteilchen gehen in den gasförmigen Zustand über. Dies geschieht ebenfalls bei der nassen Wäsche, nur dass die Wasserteilchen nicht verdampfen sondern verdunsten. Laut Boltzmann-Verteilung gibt es auch bei tiefer Temperatur immer noch eine Wahrscheinlichkeit, auch wenn diese noch so klein ist, dass einzelne Teilchen die Schwelle der Aktivierungsenergie erreichen. So können sich also ein paar wenige Wasserteilchen von den übrigen Wasserteilchen der Wäsche loslösen. Sie verdampfen. Dies führt wiederum zu einer Abkühlung der Wäsche, weil sich ja die Teilchen, welche die Aktivierungsenergie erreichten, loslösten. Nun nimmt aber die Wäsche wieder die Umgebungstemperatur auf, d.h. sie erwärmt sich leicht. Steigt die Temperatur, bedeutet das, dass die Kurve der Boltzmann-Verteilung sich nach rechts verschiebt. Der Anteil der Teilchen, welche nun wieder die Aktivierungsenergie besitzen steigt. Der Zyklus beginnt wieder von vorne und wird so oft wiederholt, bis es keine Teilchen mehr hat, die verdunsten können bzw. bis die Wäsche trocken ist. Da aber immer nur sehr wenige Teilchen die benötigende Aktivierungsenergie besitzen, dauert es sehr lange bis alle Wasserteilchen verdampfen und die Wäsche wieder trocken ist. | |
| + | == Druck == | ||
| + | Bei Erhöhung des Druckes, wird das Volumen des gasförmigen Reaktionspartners verringert, was zu einer Konzentrationserhöhung der Teilchen und zu einer höheren Zusammenstosswahrscheinlichkeit führt. Man kann den Druck durch zwei Arten erhöhen. Entweder man drückt in einen bestimmten Raum zusätzliche Gasteilchen hinein oder man verkleiner den Raum, in dem sich die besthenden Gasmoleküle befinden. | ||
| + | Die Druckerhöhung beschleunigt nur Reaktion, bei denen mindestens ein gasförmiger Reaktionspartner beteiligt ist. | ||
| + | == Katalysator == | ||
| + | Ein Katalysator ist ein Reaktionsbeschleuniger. Er geht eine Bindung mit einem Reaktionspartner ein und senkt dadurch die Aktivierungsenergie, was die Reaktionsgeschwindigkeit immens erhöht, und löst sich danach wieder. Der Katalysator geht also nicht in die Reaktionsgleichung ein und er wird nie verbraucht. | ||
| + | Genauere Informationen zum Thema ''Katalysator'' siehe: [[http://www.rdeuber.ch/chemiewiki/index.php?title=Katalyse]] | ||
== Quellen == | == Quellen == | ||
* Chemieunterlagen | * Chemieunterlagen | ||
| + | * Schwerpunktfach Biologieunterlagen, Autor: Andreas Meier | ||
| + | * http://www.leifiphysik.de/web_ph09/umwelt_technik/07dampfdruck/dampftopf.gif | ||
| + | * http://de.wikipedia.org/wiki/Landolt-Reaktion | ||
| + | * http://de.wikipedia.org/wiki/Maxwell-Boltzmann-Verteilung | ||
| + | * Chemie macchiato: Cartoonkurs für Schüler und Studenten, Autor: Kurt Haim / Johanna Lederer-Gamberger / Klaus Müller | ||
| + | * http://de.wikipedia.org/wiki/Kinetik_%28Chemie%29 | ||
| + | * http://de.wikibooks.org/wiki/Datei:Reaktionsgeschwindigkeit-Temperatur.png | ||
| + | * http://lpmfs.lpm.uni-sb.de/chemie/begleitmaterial/RG_Gleichgewicht.pdf | ||
| + | * http://upload.wikimedia.org/wikipedia/commons/7/70/Ableitung.png | ||
| + | * http://de.wikipedia.org/wiki/Landolt-Reaktion | ||
== Weblinks == | == Weblinks == | ||
* [http://swisseduc.ch/chemie/ Swisseduc] – Unterrichtsserver für Chemie | * [http://swisseduc.ch/chemie/ Swisseduc] – Unterrichtsserver für Chemie | ||
| − | * [http://meta.wikimedia.org/wiki/Help:Contents#For_editors Mediawiki Hilfeseite] – So kann der Link näher beschrieben werden | + | * [http://meta.wikimedia.org/wiki/Help:Contents#For_editors Mediawiki Hilfeseite] – So kann der Link näher beschrieben werden |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
Aktuelle Version vom 4. Mai 2020, 19:00 Uhr
Unter Reaktionsgeschwindigkeit (RG) versteht man die sich ändernde Konzentration (Δc) pro Zeiteinheit (Δt). Oder anders formuliert:
Unter RG versteht man die Abnahme der Eduktkonzentration bzw. Zunahme der Produktkonzentration pro Zeiteinheit.
• RG = Δc / Δt
Die Reaktionsgeschwindigkeit gibt also an, wie schnell Edukte zu Produkte reagieren. Oder anderst gesagt, die Reaktionsgeschwindigkeit gibt an, wie viele Teilchen pro Zeit in einer chemischen Reaktion umgesetzt werden. Auf der Teilchenebene betrachtet kann die Reaktionsgeschwindigkeit durch drei Arten erhöht werden:
• Die Anzahl der Zusammenstösse der Teilchen wird erhöht (die Erfolgsquote bleibt gleich).
• Die Erfolgsquote wird erhöht (die Anzahl Zusammenstösse bleibt gleich).
• Die Anzahl Zusammenstösse und die Erfolgsquote werden erhöht.
Unter Erfolgsquote versteht man die Stärke der Zusammenstösse der Teilchen. Teilchen reagieren miteinander erst, wenn die Kollision genug stark ist, d.h. wenn sie die Aktivierungsenergie besitzen. Die Teilchen brauchen also eine höhere kinetische Energie um stärkere Zusammenstösse zu erzeugen.
Die Reaktionsgeschwindigkeit hängt von mehreren Faktoren ab. Diese Faktoren sind Zerteilgrad, Konzentration, Temperatur, Druck und Katalysator.
Reaktionen enstehen oft nur dann, wenn Teilchen erfolgreich zusammenstossen. Für einen erfolgreichen Zusammenstoss müssen nun zwei Bedingungen erfüllt sein:
• Der Zusammenstoss muss stark genug sein, um eine Reaktion auszulösen. Die Teilchen müssen also eine gewissen Mindestenergie (eine gewissene Erfolgsquote) aufweisen.
• Der Zusammenstass muss in der richtigen räumlichen Orientierung der Teilchen erfolgen.
Je mehr Zusammenstösse es gibt, desto grösser ist die Reaktionsgeschwindigkeit. Bei Zunahme jedes obengennanten Faktors werden diese Zusammenstösse der Teilchen erhöht und somit führt dies zu einem schnelleren Verlauf der Reaktion.
Die Aktivierungsenergie ist das Mass für die Reaktionsgeschwindigkeit. Je grösser die Aktivierungsenergie, desto kleiner ist Reaktionsgeschwindigkeit. Dies ist so, weil es weniger Teilchen hat, welche die Aktivierungsenergie haben und somit hat es weniger Teilchen, die miteinander reagieren. Zum Beispiel verläuft eine Reaktion, in der ein Katalysator beteiligt ist, viel schneller, da der Katalysator die Aktivierungsenergie heruntersetzt (siehe: 5. Katalysator [1]). Die Aktivierungsenergie ist diejenige Energie, die gebraucht wird, um die alten Bindungen der Edukte zu lockern, damit die neuen Bindungen der Produkte gebildet werden können.
Inhaltsverzeichnis
Zerteilungsgrad
Teilchen können nur an ihren Grenzflächen miteinander kollidieren und reagieren. Je grösser nun diese Grenzflächen sind, desto mehr Zusammenstösse sind möglich (jedoch bleibt die Erfolgsquote gleich). Je grösser also der Zerteilungsgrad oder die Oberfläche der Teilchen ist, desto höher ist die Reaktionsgeschwindigkeit. Es gibt unterschiedliche Möglichkeiten zur Oberflächenvergrösserung von Feststoffen:
- Zerkleinerung
- Schmelzen, Verdampfen
- Auflösen in einem Lösungsmittel
Beispiele: Biologie/Feuerspeien/Stahlwolle
Unser Körper profitiert von der Reaktionsgeschwindigkeitserhöhung durch die Oberflächenvergrösserung. So finden wir in der Lunge 300 Millionen Lungenblässchen mit einer Gesamtgrösse von 100m2), was den Gasaustausch von Sauerstoff und Kohlendioxid ermöglicht. Die Resorption der Nährstoffe vom Darm ins Blut wird erst durch die Darmoberfläche von 180m2), welche von den Darmzotten ensteht, ermöglicht.
Das Prinzip der Oberflächenvergrösserung ist auch die Grundlage beim Feuerspeien. Das Brandmittel (z.B. Kerosin), welches im Anfangszustand schwerer entzündlich ist, wird beim Herauspusten fein zerstäubt, wodurch die Angriffsoberfläche für das Feuer vergrössert und dadurch leichter entzündbar wird.
Könnt ihr euch Vorstellung, dass Stahl brennt? In der Tat ist dies möglich. Aber nur wenn auch hier das Prinzip der Oberflächenvergrösserung angewendet wird. Ein solides Stahlstück würde erst ab einigen hundert Grad anfangen zu brennen. Wenn die Oberfläche aber genug stark vergrössert wird, was bei Stahlwolle der Fall ist, kann man die Stahlwolle ohne Probleme mit einem Feuerzeug zum Brennen zu bringen.
Weblinks
- Feuerspucken – Video zum Feuerspucken als Erhöhung des Zerteilgrades (Simpleclub)
Konzentration
Je höher die Konzentration ist, desto mehr Teilchen sind in einem bestimmten Volumen vorhanden. Dies führt zu einer höheren Zusammenstosswahrscheinlichkeit der Reaktionspartnern. Die Erfolgsquote wird dabei aber nicht erhöht, denn es gibt zwar mehr Zusammenstösse aber die Stärke der Zusammenstösse steigt nicht, da die kinetische Energie der Teilchen gleich bleibt.
Bei einer Reaktion reagieren zwei Stoffe A und B (Edukte/Ausgangsstoffe) vollständig zum Stoff AB (Produkt/Endstoff).
A + B → AB
Bei dieser Reaktion wird die Konzentrationsänderung der Edukte nicht linear sinken und die Konzentrationsänderung der Produkte nicht linear steigen. Denn man muss hier wieder auf der Teilchenebene argumentieren. Wie wir bereits wissen, ist die Reaktionsgeschwindigkeit abhängig von der Konzentration. Anfangs ist die Konzentration der Ausgangsstoffe ([A] und [B]) maximal und die Konzentration des Endstoffes ([AB]) minimal bzw. gleich 0, da ja noch keine Edukte miteinander reagiert haben. Nun beginnt die Reaktion und die Edukte verbinden sich zum Produkt. Dabei fällt die Konzentration der Edukte bzw. dabei steigt die Konzentration der Produkte. Die Reaktionsgeschwindigkeit ist anfangs hoch, und wird langsamer je mehr Teilchen bereits reagierten haben, da die Anzahl der Zusammenstösse vermindert wird. Die Konzentration der Edukte nimmt also exponentiell ab. Da die Konzentration des Endstoffes direkt abhängig ist von der Konzentration der Ausgangsstoffe ist, muss die Konzentration des Endstoffes umgekehrt exponentiall steigen.
Zusammenfassend kann man also sagen, die Reaktionsgeschwindigkeit ist von der momentanen Konzentration der Edukte abhängig.
Experimentelle Bestimmung der Reaktionsgeschwindigkeitskonstante k
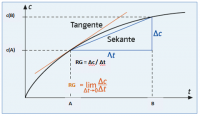
Die Reaktionsgeschwindigkeit ist proportional zur Anzahl Zusammenstösse. Dadurch ist die Reaktionsgeschwindigkeit auch proportional zur Konzentration, wenn die Ausgangsstoffe gleichermassen erhöht wird. Daraus ergibt sich:
RG = Δc / Δt = k * [A] * [B]
Die Sekantensteigung = Δc / Δt
Δc = [B] - [A]
Δt = B - A
Wenn man nun die Differenzen von A und B (Δc und Δt) zu 0 streben lässt erhält man die Tangentensteigung. Die Tangentensteigung ist die Reaktionsgeschwindigkeit.
Beispiele:
1) A → B ≙ RG = k * [A]
2) A + B → C ≙ RG = k * [A] * [B]
3) 2A → B ≙ RG = k * [A] * [A] = k * [A]2
Weiteres Beispiel anhand der Zellatmung: Sauerstoff und Glucose reagiert zu Wasser und Kohlendioxid:
6 O2 + C6H12O6 → 6 H2O + 6 CO2
RG = k * [O2]6 * [C6H12O6]
Die Landolt-Reaktion
Die Landolt-Reaktion beschreibt, dass die Geschwindigkeit einer chemischen Reaktion von der Konzentration ihrer Edukte und der Temperatur abhängt.
Bei Zugabe von Stärke führt das entstehende Iod zu einem blauem Farbumschlag. In Abhängigkeit von Temperatur und Konzentration der Lösungen kann auf einige Sekunden genau vorausbestimmt werden, wann der Farbumschlag auftreten soll.
In diesem Video wird die Reaktionsgeschwindigkeit sehr schön illustriert: [2]
.
Temperatur
Je höher die Temperatur ist, desto höher ist die kinetische Energie (Bewegungsenergie) der Teilchen. Dies führt einerseits zu mehr Zusammenstössen und somit zu einem schnelleren Reaktionsverlauf. Andererseits wird die Erfolgsquote (die Anzahl Teilchen, welche die AE aufweisen und reagieren können) erhöht, was wiederum zu einem schnelleren Reaktionsverlauf führt, da durch die höhere kinetische Energie der Teilchen die Zusammenstösse stärker sind. Vorraussetzung in einem chemischen System, damit eine Reaktion abläuft, ist, dass ein bestimmter Energiebetrag erreicht oder überschritten werden muss. Es muss also eine Aktivierungsenergie (AE) hinzugefügt werden, damit diese Schwelle erreicht oder überschritten werden kann. Diese zusätzliche Energie ist notwendig damit vorhandene Bindungen gelöst werden können.
RGT-Regel
Die Reaktionsgeschwindigkeits-Temperatur-Regel (RGT-Regel), sagt aus, dass eine Erhöhung der Temperatur um 10°C meist eine Verdoppelung der Reaktionsgeschwindigkeit bewirkt.
Wohingegen eine Verdoppelung der Konzentration eines Edukts auch zu einer Verdoppellung der Reaktionsgeschwindigkeit führt.
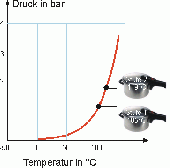
Dampfkochtopf
Eine gute Veranschaulichung der RGT-Regel sieht man am Prinzip des Dampfkochtopfs. Durch die Erhöhung der Wassertemperatur auf 100°C beginnt das Wasser vom flüssigen in den gasförmigen Zustand zu verdampfen. Da das Wasser, bei gleicher Anzahl Teilchen, im gasförmigen Zustand ein grösseres Volumen einnimmt als im flüssigen Zustand und es nicht durch den Dampfkochtopf entweichen kann, erhöht sich der Druck. Bei höherem Druck steigt der Siedepunkt von Wasser. Im Falle des Dampfkochtopfs auf 120°C. Die Temperaturdifferenz von 20°C, die sich dadurch ergibt, führt zu einer Vervierfachung der Reaktionsgeschwindigkeit. Das heisst die Kochzeit mit Benützung eines Dampfkochtopfs wird viermal schneller.
Den genauen gegenteiligen Effekt erlebt man beim Bergsteigen. Je höher über Meer man sich befindet, desto tiefer ist der Druck. Dies führt dazu, dass der Siedepunkt von Wasser tiefer wird.
Vergleicht man aber die Zunahme der kinetischen Energie der Teilchen, bei einer Temperaturerhöhung von 100°C auf 120°C, mit der Reaktionsgeschwindigkeit, so stellt man fest, dass die kinetische Energie nur um etwa 5% steigt.
100°C ≙ 373 Kelvin
120°C ≙ 393 Kelvin
(393 K - 373 K) / 373 K = ~0.05 = 5%
Wie kann eine 5%tige Erhöhung der kinetischen Energie der Teilchen eine 4 mal schnellere Reaktionsgeschwindigkeit verursachen?
Eine Antwort darauf liefert die Boltzmann-Verteilung (siehe: 3.3 Boltzmann-Verteilung [3])
Boltzmann-Verteilung
Damit eine Reaktion ensteht müssen die Teilchen eine Aktivierungsenergie erreichen oder überwinden. Die Aktivierungsenergie ist diejenige Energie, die gebraucht wird, um die alten Bindungen der Edukte zu lockern, damit die neuen Bindungen der Produkte gebildet werden können. Die Boltzmann-Verteilung ist eine Verteilung der Wahrscheinlichkeit der Geschwindigkeit der Teilchen bei einer bestimmten Temperatur. Ist die Temperatur tiefer, so ist auch die kinetische Energie der Teilchen tiefer. Je höher die Temperatur ist, desto grösser ist das Spektrum der Geschwindigkeit, welche die Teilchen einnehmen können. Dadurch ist die Wahrscheinlichkeit höher, dass es mehr Teilchen gibt, welche die Mindestenergie besitzen. Dem Maximum einer Kurve entspricht die wahrscheinlichste Geschwindigkeit. Bei höherer Temperatur besitzt ein grösserer Anteil der Teilchen die für eine bestimmte Reaktion nötige Mindestenergie, so dass sich in einem bestimmten Zeitintervall mehr Teilchen umsetzen können und die betreffende Reaktion mit größerer Geschwindigkeit abläuft. Die grau schraffierte Flache in der Grafik der Boltzmann-Verteilung wiederspiegelt die Anzahl reagierfähigen Teilchen. Wie man nun sieht, Vergrössert sich diese Fläche überproportional im Vergleich zum Temperaturanstieg.
Auf den Dampftopf angewandt, bedeutet dies nun, dass die Flachengrösse (Anzahl reagierfähiger Teilchen) bei 120° 4 mal grösser ist (obwohl der Temperunterschied nur 5% beträgt), als bei 100°C.
Die mittlere kinetische Energie ist proportional zur Temperatur. Die Reaktionsgeschwindigkeit ist proportional zum Anteil Teilchen, welche mindestens die Aktivierungsenergie aufweisen. Sie ist aber nicht proportional zur mittleren kinetischen Energie.
Wieso trocknet nasse Wäsche an der Luft?
Bei 100°C verdampft Wasser. Die Wasserteilchen gehen in den gasförmigen Zustand über. Dies geschieht ebenfalls bei der nassen Wäsche, nur dass die Wasserteilchen nicht verdampfen sondern verdunsten. Laut Boltzmann-Verteilung gibt es auch bei tiefer Temperatur immer noch eine Wahrscheinlichkeit, auch wenn diese noch so klein ist, dass einzelne Teilchen die Schwelle der Aktivierungsenergie erreichen. So können sich also ein paar wenige Wasserteilchen von den übrigen Wasserteilchen der Wäsche loslösen. Sie verdampfen. Dies führt wiederum zu einer Abkühlung der Wäsche, weil sich ja die Teilchen, welche die Aktivierungsenergie erreichten, loslösten. Nun nimmt aber die Wäsche wieder die Umgebungstemperatur auf, d.h. sie erwärmt sich leicht. Steigt die Temperatur, bedeutet das, dass die Kurve der Boltzmann-Verteilung sich nach rechts verschiebt. Der Anteil der Teilchen, welche nun wieder die Aktivierungsenergie besitzen steigt. Der Zyklus beginnt wieder von vorne und wird so oft wiederholt, bis es keine Teilchen mehr hat, die verdunsten können bzw. bis die Wäsche trocken ist. Da aber immer nur sehr wenige Teilchen die benötigende Aktivierungsenergie besitzen, dauert es sehr lange bis alle Wasserteilchen verdampfen und die Wäsche wieder trocken ist.
Druck
Bei Erhöhung des Druckes, wird das Volumen des gasförmigen Reaktionspartners verringert, was zu einer Konzentrationserhöhung der Teilchen und zu einer höheren Zusammenstosswahrscheinlichkeit führt. Man kann den Druck durch zwei Arten erhöhen. Entweder man drückt in einen bestimmten Raum zusätzliche Gasteilchen hinein oder man verkleiner den Raum, in dem sich die besthenden Gasmoleküle befinden. Die Druckerhöhung beschleunigt nur Reaktion, bei denen mindestens ein gasförmiger Reaktionspartner beteiligt ist.
Katalysator
Ein Katalysator ist ein Reaktionsbeschleuniger. Er geht eine Bindung mit einem Reaktionspartner ein und senkt dadurch die Aktivierungsenergie, was die Reaktionsgeschwindigkeit immens erhöht, und löst sich danach wieder. Der Katalysator geht also nicht in die Reaktionsgleichung ein und er wird nie verbraucht.
Genauere Informationen zum Thema Katalysator siehe: [[4]]
Quellen
- Chemieunterlagen
- Schwerpunktfach Biologieunterlagen, Autor: Andreas Meier
- http://www.leifiphysik.de/web_ph09/umwelt_technik/07dampfdruck/dampftopf.gif
- http://de.wikipedia.org/wiki/Landolt-Reaktion
- http://de.wikipedia.org/wiki/Maxwell-Boltzmann-Verteilung
- Chemie macchiato: Cartoonkurs für Schüler und Studenten, Autor: Kurt Haim / Johanna Lederer-Gamberger / Klaus Müller
- http://de.wikipedia.org/wiki/Kinetik_%28Chemie%29
- http://de.wikibooks.org/wiki/Datei:Reaktionsgeschwindigkeit-Temperatur.png
- http://lpmfs.lpm.uni-sb.de/chemie/begleitmaterial/RG_Gleichgewicht.pdf
- http://upload.wikimedia.org/wikipedia/commons/7/70/Ableitung.png
- http://de.wikipedia.org/wiki/Landolt-Reaktion
Weblinks
- Swisseduc – Unterrichtsserver für Chemie
- Mediawiki Hilfeseite – So kann der Link näher beschrieben werden