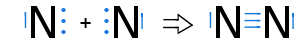Einfache Moleküle: Unterschied zwischen den Versionen
(→Das Sauerstoffmolkül O2) |
K |
||
| (17 dazwischenliegende Versionen von 2 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
| − | Als einfache Moleküle verstehen wir eine durch Elektronenpaarbindung ([[A Elektronepaarbindung]]) entstande Bindung zwischen zwei gleichen Nichtmetallen (siehe [[Wichtige Nichtmetall-Elemente]]). Durch die Bildung gemeinsamer Elektronenpaare (eines oder mehrere) wird die gegenseitige Abstossung der positiv geladenen Atomkerne | + | Als einfache Moleküle verstehen wir eine durch Elektronenpaarbindung ([[A Elektronepaarbindung]]) entstande Bindung zwischen zwei gleichen Nichtmetallen (siehe [[Wichtige Nichtmetall-Elemente]]). Durch die Bildung gemeinsamer Elektronenpaare (eines oder mehrere) wird die gegenseitige Abstossung der positiv geladenen Atomkerne kompensiert. Das gemeinsame Elektronenpaar gehört beiden Bindungspartnern und verteilt sich symmetrisch auf einer gedachten Achse zwischen den Atomkernen. Dadurch erfüllen die an der |
Bindung beteiligten Atome die Oktettregel, erreichen also den Zustand eines Edelgases. Energetisch erreichen beide Bindungspartner einen niedrigeren Energiezustand als jeder Partner alleine mit einem ungepaarten Elektron. | Bindung beteiligten Atome die Oktettregel, erreichen also den Zustand eines Edelgases. Energetisch erreichen beide Bindungspartner einen niedrigeren Energiezustand als jeder Partner alleine mit einem ungepaarten Elektron. | ||
=Voraussetzungen= | =Voraussetzungen= | ||
| + | Folgende Punkte müssen auf die potentiellen Bindungspartner zutreffen, damit eine Atombindung enstehen kann: | ||
- Zwei Nichtmetalle mit der gleichen Elektronegativität | - Zwei Nichtmetalle mit der gleichen Elektronegativität | ||
| Zeile 13: | Zeile 14: | ||
=Beispiele= | =Beispiele= | ||
| + | Die wichtigsten Atombindungen anhand von Beispielen erklärt. | ||
==Das Wasserstoffmolekül H<SUB>2</SUB>== | ==Das Wasserstoffmolekül H<SUB>2</SUB>== | ||
| Zeile 44: | Zeile 46: | ||
===Energiediagramm bei Wasserstoffmolekülbildung=== | ===Energiediagramm bei Wasserstoffmolekülbildung=== | ||
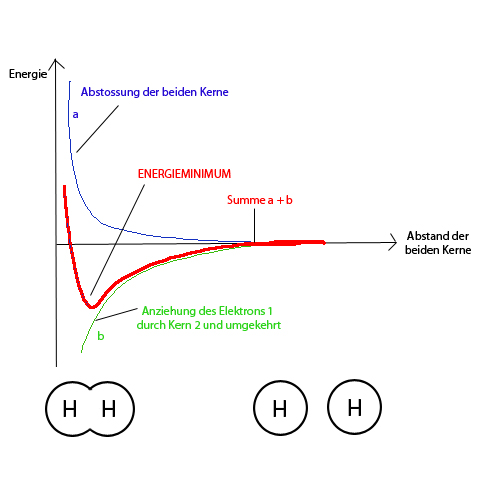
| − | Zu Beginn überwiegen die Anziehungskräfte, die Teilchen nähern sich an, die potentielle Energie sinkt (es wird Energie frei). | + | Zu Beginn überwiegen die Anziehungskräfte, die Teilchen nähern sich an, die potentielle Energie sinkt (es wird Energie frei). Sobald am unteren Ende die Kurve wieder ansteigt, überwiegen die Abstossungskräfte, insbesondere die der Kerne. Von nun an müsste man Energie aufwenden für eine weitere Annäherung. Deshalb pendelt sich der Abstand zwischen den beiden Atomen bei eben diesem Tiefpunkt der potentiellen Energie ein (bei 74 picometer Abstand). |
[[Bild:Atombindungsmodell.jpg]] | [[Bild:Atombindungsmodell.jpg]] | ||
| − | |||
===Interpretation gemäss Kugelwolkenmodell=== | ===Interpretation gemäss Kugelwolkenmodell=== | ||
| Zeile 56: | Zeile 57: | ||
==Das Fluormolekül F<SUB>2</SUB>== | ==Das Fluormolekül F<SUB>2</SUB>== | ||
| + | [[Bild:Einfachbindung_fluor.gif|right|]] | ||
[[Bild:Das_Fluormolekuel.JPG]] | [[Bild:Das_Fluormolekuel.JPG]] | ||
| Zeile 63: | Zeile 65: | ||
→ Einfachbindung | → Einfachbindung | ||
| + | |||
| + | → Sp<SUP>3</SUP>-Hybridisierung | ||
==Das Sauerstoffmolkül O<SUB>2</SUB>== | ==Das Sauerstoffmolkül O<SUB>2</SUB>== | ||
| − | [[Bild:Sauerstoffmolekül- | + | [[Bild:Doppelbindung_sauerstoff.gif|right|]] |
| + | [[Bild:Sauerstoffmolekül-Lewis2.png]] | ||
Zum Erreichen der Edelgaskonfiguration fehlen dem Sauerstoffatom 2e<sup>-</sup> | Zum Erreichen der Edelgaskonfiguration fehlen dem Sauerstoffatom 2e<sup>-</sup> | ||
| Zeile 72: | Zeile 77: | ||
→ Zweifachbindung / Doppelbindung | → Zweifachbindung / Doppelbindung | ||
| + | |||
| + | → Sp<SUP>2</SUP>-Hybridisierung (ein schwaches P-Orbital, deshalb sind Doppelbindungen reaktionsfreudiger) | ||
==Das Stickstoffmolekül N<SUB>2</SUB>== | ==Das Stickstoffmolekül N<SUB>2</SUB>== | ||
| − | [[Bild: | + | [[Bild:Dreifachbindung_stickstoff.gif|right|]] |
| − | [[Bild:Stickstoff- | + | [[Bild:Stickstoff-Dreifachbindung2.png ]] |
Es fehlen zum Erreichen der Edelgaskonfiguration 3 e<sup>-</sup> | Es fehlen zum Erreichen der Edelgaskonfiguration 3 e<sup>-</sup> | ||
| Zeile 83: | Zeile 90: | ||
→ es liegt eine 3fach Bindung zwischen den Atomen vor, von denen jedes je ein freies Elektronenpaar hat | → es liegt eine 3fach Bindung zwischen den Atomen vor, von denen jedes je ein freies Elektronenpaar hat | ||
| − | + | → Sp-Hybridisierung (zwei schwache P-Orbitale → sehr reaktionsfreudig, instabil) | |
| − | |||
==Kohlenstoff== | ==Kohlenstoff== | ||
| Zeile 103: | Zeile 109: | ||
==Quellen== | ==Quellen== | ||
| − | + | * Chemie-Unterricht Notizen | |
| − | + | * Graphics made by Urs Wegmann / Philipp Pauli | |
| − | + | * Chemsketch (animierte GIFs) | |
| − | + | * Buch: "Elemente"; Roderich Magyar, Wolfgang Lieebhart, Gabriela Jelinek; öbvhpt Verlagsgmbh & Co. KG; Wien 2006 | |
Aktuelle Version vom 23. März 2016, 19:16 Uhr
Als einfache Moleküle verstehen wir eine durch Elektronenpaarbindung (A Elektronepaarbindung) entstande Bindung zwischen zwei gleichen Nichtmetallen (siehe Wichtige Nichtmetall-Elemente). Durch die Bildung gemeinsamer Elektronenpaare (eines oder mehrere) wird die gegenseitige Abstossung der positiv geladenen Atomkerne kompensiert. Das gemeinsame Elektronenpaar gehört beiden Bindungspartnern und verteilt sich symmetrisch auf einer gedachten Achse zwischen den Atomkernen. Dadurch erfüllen die an der Bindung beteiligten Atome die Oktettregel, erreichen also den Zustand eines Edelgases. Energetisch erreichen beide Bindungspartner einen niedrigeren Energiezustand als jeder Partner alleine mit einem ungepaarten Elektron.
Inhaltsverzeichnis
Voraussetzungen
Folgende Punkte müssen auf die potentiellen Bindungspartner zutreffen, damit eine Atombindung enstehen kann:
- Zwei Nichtmetalle mit der gleichen Elektronegativität
- verschiedene Spins der Elektronen
- Anziehungskräfte durch Coulombkräfte
- gemeinsame, bindende Elektronenwolke
Beispiele
Die wichtigsten Atombindungen anhand von Beispielen erklärt.
Das Wasserstoffmolekül H2
Kräfte zwischen den H-Atomen
1) Magnetische Kräfte (Spin) ↑↓:
Anziehung ↑↓ Abstossung ↑↑ ↓↓
2) Anziehende Coulombkräfte:
Kern1 - Hülle2
Kern2 - Hülle1
3) Abstossende Coulombkräfte:
Hülle1 - Hülle2 Kern1 - Kern2
Energiediagramm bei Wasserstoffmolekülbildung
Zu Beginn überwiegen die Anziehungskräfte, die Teilchen nähern sich an, die potentielle Energie sinkt (es wird Energie frei). Sobald am unteren Ende die Kurve wieder ansteigt, überwiegen die Abstossungskräfte, insbesondere die der Kerne. Von nun an müsste man Energie aufwenden für eine weitere Annäherung. Deshalb pendelt sich der Abstand zwischen den beiden Atomen bei eben diesem Tiefpunkt der potentiellen Energie ein (bei 74 picometer Abstand).
Interpretation gemäss Kugelwolkenmodell
Eine Kugelwolke, welche mit zwei Elektronen besetzt ist, ist stabiler, als eine welche nur mit einem Elektron besetzt ist. Einfach besetzte Kugelwolken eines Atoms haben deshalb auch die Tendenz sich mit anderen einfach besetzten Kugelwolken zu verbinden. Die daraus entstandene doppelt besetzte Kugelwolke wird als Bindungswolke bezeichnet.
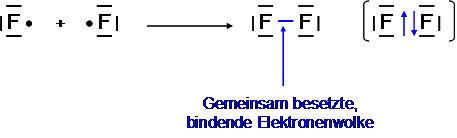
Das Fluormolekül F2
Zum Erreichen der Edelgaskonfiguration fehlt dem Fluoratom 1e-
→ Jedes Fluoratom stellt 1 Bindungselektronen zur Verfügung
→ Einfachbindung
→ Sp3-Hybridisierung
Das Sauerstoffmolkül O2
Zum Erreichen der Edelgaskonfiguration fehlen dem Sauerstoffatom 2e-
→ Jedes Sauerstoffatom stellt 2 Bindungselektronen zur Verfügung
→ Zweifachbindung / Doppelbindung
→ Sp2-Hybridisierung (ein schwaches P-Orbital, deshalb sind Doppelbindungen reaktionsfreudiger)
Das Stickstoffmolekül N2
Es fehlen zum Erreichen der Edelgaskonfiguration 3 e-
→ Jedes Stickstoffatom stellt 3 Bindungselektronen zur Verfügung
→ es liegt eine 3fach Bindung zwischen den Atomen vor, von denen jedes je ein freies Elektronenpaar hat
→ Sp-Hybridisierung (zwei schwache P-Orbitale → sehr reaktionsfreudig, instabil)
Kohlenstoff
Je nachdem wieviele Nachbarschaftsatome der Kohlenstoff hat, wird er unterschiedlich hybridisiert und geht unterschiedliche Bindungen ein. Insgesamt kennt er drei Bindungstypen.
→ Die Einfachbindung ist als einzige in sich selbst drehbar. sp3-Hybrdisierung
→ In der Doppelbindung überlappen sich jeweils ein p-Oribtal des einen sp2-hybridisierten C-Atoms mit dem anderen. Dee Bindung ist nicht mehr drehbar.
→ In der Dreifachbindung überlappen sich schließlich zwei p-Oribtale auf jeder Seite. Die Dreifachbindung ist verständlicherweise auch nicht drehbar.
→ Eine Vierfachbindung ist aufgrund der räumlichen Struktur nicht möglich. Da die Orbitale tetraederförmig sind, und die Atome für eine solche Bindung genau übereinander liegen müssten, würden sich die Kerne der C-Atome gegenseitig abstossen.
Quellen
- Chemie-Unterricht Notizen
- Graphics made by Urs Wegmann / Philipp Pauli
- Chemsketch (animierte GIFs)
- Buch: "Elemente"; Roderich Magyar, Wolfgang Lieebhart, Gabriela Jelinek; öbvhpt Verlagsgmbh & Co. KG; Wien 2006