D Die Fünf Stoffklassen: Unterschied zwischen den Versionen
K |
(→Eine Übersicht) |
||
| (5 dazwischenliegende Versionen von 2 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
| + | Stoffe bestehen aus Teilchen, welche wiederum aus miteinander verbundenen Atomen bestehen. Deshalb unterscheidet man die drei | ||
| + | Bindungstypen Elektronenpaarbindung, Ionenbindung und Metallbindung. Diese betrachtet man auf der Teilchenebene. Hingegen | ||
| + | werden in diesem Kapitel hier die Stoffe an sich angeschaut, sie werden gemäss ihren Stoffeigenschaften auf der stofflichen Ebene | ||
| + | unterschieden. Dabei teilt man die verschiedenen Stoffe in fünf verschiedene Klassen ein... | ||
| + | |||
== Die fünf Stoffklassen == | == Die fünf Stoffklassen == | ||
| Zeile 23: | Zeile 28: | ||
*Damit ein Stoff elektrisch leitfähig ist, müssen zwei Voraussetzungen erfüllt werden: | *Damit ein Stoff elektrisch leitfähig ist, müssen zwei Voraussetzungen erfüllt werden: | ||
| − | [[Bild:O^2.jpg|thumb|right|Sauerstoff ( | + | [[Bild:O^2.jpg|thumb|right|Sauerstoff (Blasen im Wasser)]] |
# es müssen elektrisch geladene Teilchen vorhanden sein | # es müssen elektrisch geladene Teilchen vorhanden sein | ||
# diese Teilchen müssen frei beweglich sein | # diese Teilchen müssen frei beweglich sein | ||
| − | + | Bei Elektronenpaarbindungen sind jedoch die Valenzelektronen "fest versorgt" und können sich also nicht frei bewegen. Somit sind sie elektrisch nicht leitend. | |
| Zeile 38: | Zeile 43: | ||
Die zweite "Unterabteilung" der flüchtigen Stoffe sind jene mit polaren Teilchen und somit [[Die polare Bindung|polaren Bindungen]]. | Die zweite "Unterabteilung" der flüchtigen Stoffe sind jene mit polaren Teilchen und somit [[Die polare Bindung|polaren Bindungen]]. | ||
| − | *Die [[Zwischenmolekulare Kräfte|ZMK]] sind stark, denn es gibt zwischen den Teilchen | + | *Die [[Zwischenmolekulare Kräfte|ZMK]] sind stark, denn es gibt zwischen den Teilchen Dipolkräfte und/oder H-Brücken. |
*Der Schmelz- und der Siedepunkt sind infolge der stärkeren [[Zwischenmolekulare Kräfte|ZMK]] höher als bei den [[D Die Fünf Stoffklassen#Die flüchtigen Stoffe (1)|flüchtigen Stoffen (1)]]. | *Der Schmelz- und der Siedepunkt sind infolge der stärkeren [[Zwischenmolekulare Kräfte|ZMK]] höher als bei den [[D Die Fünf Stoffklassen#Die flüchtigen Stoffe (1)|flüchtigen Stoffen (1)]]. | ||
| Zeile 53: | Zeile 58: | ||
=== Die diamantartigen Stoffe === | === Die diamantartigen Stoffe === | ||
[[Bild:Diamant.jpg|thumb|right|Ein Diamant]] | [[Bild:Diamant.jpg|thumb|right|Ein Diamant]] | ||
| − | *Die diamantartigen Stoffe | + | *Die diamantartigen Stoffe enthalten ebenfalls Elektronenpaarbindungen. |
*Diamantartige Stoffe haben "Riesenmoleküle" als kleinste Teilchen. Im Falle von Diamant wären das etliche miteinander verbundene Kohlenstoffatome. | *Diamantartige Stoffe haben "Riesenmoleküle" als kleinste Teilchen. Im Falle von Diamant wären das etliche miteinander verbundene Kohlenstoffatome. | ||
| Zeile 67: | Zeile 72: | ||
| − | *Beispiele für diamantartige Stoffe sind Diamant und Quarz. | + | *Beispiele für diamantartige Stoffe sind Diamant und Quarz (SiO<sub>2</sub>). |
| Zeile 73: | Zeile 78: | ||
[[Bild:PET.jpg|thumb|right|Flaschen, die aus dem Kunststoff PET bestehen]] | [[Bild:PET.jpg|thumb|right|Flaschen, die aus dem Kunststoff PET bestehen]] | ||
| − | *Auch die hochmolekularen Stoffe | + | *Auch die hochmolekularen Stoffe enthalten Elektronenpaarbindungen. |
*Die kleinsten Teilchen dieser Stoffe sind lange, kettenartige Moleküle. | *Die kleinsten Teilchen dieser Stoffe sind lange, kettenartige Moleküle. | ||
| Zeile 91: | Zeile 96: | ||
=== Die salzartigen Stoffe === | === Die salzartigen Stoffe === | ||
| − | [[Bild:Salz. | + | [[Bild:Salz.jpg|thumb|right|Natriumchlorid, alias Kochsalz]] |
*Bei den salzartigen Stoffen ist die Ionenbindung die Bindungsart. (''siehe [[III Bindungslehre|B Ionenbindung]]'') | *Bei den salzartigen Stoffen ist die Ionenbindung die Bindungsart. (''siehe [[III Bindungslehre|B Ionenbindung]]'') | ||
| Zeile 97: | Zeile 102: | ||
*Die kleinsten Teilchen sind deshalb logischerweise die [[Grundlagen der Ionenbindung#Die Ladung eines Ions|Kationen bzw. die Anionen]]. | *Die kleinsten Teilchen sind deshalb logischerweise die [[Grundlagen der Ionenbindung#Die Ladung eines Ions|Kationen bzw. die Anionen]]. | ||
| − | *Zwischen den Teilchen herrschen sehr starke | + | *Zwischen den Teilchen herrschen sehr starke Coulombkräfte. |
*Und wegen diesen starken [[Zwischenmolekulare Kräfte|ZMK]] sind Schmelz- und Siedepunkt sehr hoch. | *Und wegen diesen starken [[Zwischenmolekulare Kräfte|ZMK]] sind Schmelz- und Siedepunkt sehr hoch. | ||
| Zeile 104: | Zeile 109: | ||
*In festem Zustand erfüllen die salzartigen Stoffe die Voraussetzungen für elektrische Leitfähigkeit nur zur Hälfte. Die geladenen Teilchen sind zwar da, aber sie sind nicht frei beweglich. Somit sind sie in festem Zustand nicht leitend. | *In festem Zustand erfüllen die salzartigen Stoffe die Voraussetzungen für elektrische Leitfähigkeit nur zur Hälfte. Die geladenen Teilchen sind zwar da, aber sie sind nicht frei beweglich. Somit sind sie in festem Zustand nicht leitend. | ||
| − | + | In flüssigem bzw. aquatisiertem (=mit Wasser gelöstem) Zustand hingegen sind die elektrisch geladenen Teilchen frei beweglich, somit kann Strom geleitet werden. | |
| Zeile 112: | Zeile 117: | ||
=== Die metallischen Stoffe === | === Die metallischen Stoffe === | ||
| − | [[Bild: | + | [[Bild:Gold.jpg|thumb|right|Goldbarren]] |
| − | *Die metallischen Stoffe | + | *Die metallischen Stoffe enthalten Metallbindungen. (''siehe [[III Bindungslehre|C Metallbindungen]]'') |
*Die kleinsten Teilchen der metallischen Stoffe sind [[Struktur und Eigenschaften der Metalle|Atomrümpfe]] bzw. Elektronengas. | *Die kleinsten Teilchen der metallischen Stoffe sind [[Struktur und Eigenschaften der Metalle|Atomrümpfe]] bzw. Elektronengas. | ||
| − | *Zwischen den Teilchen bestehen | + | *Zwischen den Teilchen bestehen Coulombkräfte. |
| − | *Aufgrund dieser relativ starken | + | *Aufgrund dieser relativ starken Coulombkräfte sind Schmelz- und Siedepunkt meistens hoch. |
*Metallische Stoffe sind nicht löslich. | *Metallische Stoffe sind nicht löslich. | ||
| Zeile 131: | Zeile 136: | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
== Quellen == | == Quellen == | ||
| Zeile 212: | Zeile 143: | ||
== Weblinks == | == Weblinks == | ||
* [http://swisseduc.ch/chemie/ Swisseduc] – Unterrichtsserver für Chemie | * [http://swisseduc.ch/chemie/ Swisseduc] – Unterrichtsserver für Chemie | ||
| − | |||
[[Kategorie:Chemie]] | [[Kategorie:Chemie]] | ||
Aktuelle Version vom 11. Dezember 2014, 12:24 Uhr
Stoffe bestehen aus Teilchen, welche wiederum aus miteinander verbundenen Atomen bestehen. Deshalb unterscheidet man die drei Bindungstypen Elektronenpaarbindung, Ionenbindung und Metallbindung. Diese betrachtet man auf der Teilchenebene. Hingegen werden in diesem Kapitel hier die Stoffe an sich angeschaut, sie werden gemäss ihren Stoffeigenschaften auf der stofflichen Ebene unterschieden. Dabei teilt man die verschiedenen Stoffe in fünf verschiedene Klassen ein...
Inhaltsverzeichnis
Die fünf Stoffklassen
Die flüchtigen Stoffe
- Die Bindungsart bei den flüchtigen Stoffen ist die Elektronenpaarbindung (siehe unter A Elektronenpaarbindung). Die kleinsten Teilchen in der Struktur des Stoffes können entweder polare oder unpolare Moleküle sein. Je nachdem welches von beiden sie sind, ändern sich die Eigenschaften und die weiteren Strukturmerkmale.
Die flüchtigen Stoffe (1)
Die erste "Unterabteilung" der flüchtigen Stoffe sind diejenigen mit unpolaren Molekülen und dementsprechend unpolaren Bindungen.
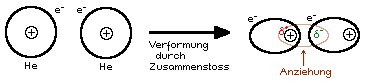
- Wenn die kleinsten Teilchen in der Struktur unpolar sind, dann sind die Kräfte zwischen diesen Molekülen (ZMK) klein, denn es sind nur schwache Van der Waals-Kräfte vorhanden.
Die Van der Waals-Kraft zur Erinnerung kurz erklärt:
2 Atome bewegen sich ⇒ Zusammenstösse ⇒ Verformung/Kernverschiebung ⇒ vorübergehender Dipol
- Wenn die Anziehungskräfte zwischen Molekülen stark sind, dann sind Schmelz- und Siedepunkt hoch. Da die ZMK hier aber sehr klein sind, sind dementsprechend Schmelz- und Siedepunkt tief.
- "Similia similibus solvuntur" = Die Gleichen werden durch die Gleichen gelöst. Ergo können Stoffe mit unpolaren Molekülen nur in unpolaren Lösungsmitteln gelöst werden.
- Damit ein Stoff elektrisch leitfähig ist, müssen zwei Voraussetzungen erfüllt werden:
- es müssen elektrisch geladene Teilchen vorhanden sein
- diese Teilchen müssen frei beweglich sein
Bei Elektronenpaarbindungen sind jedoch die Valenzelektronen "fest versorgt" und können sich also nicht frei bewegen. Somit sind sie elektrisch nicht leitend.
- Beispiele für die flüchtigen Stoffe mit unpolaren Molekülen sind Sauerstoff (O2), Methan (CH4) und Wasserstoff (H2).
Die flüchtigen Stoffe (2)
Die zweite "Unterabteilung" der flüchtigen Stoffe sind jene mit polaren Teilchen und somit polaren Bindungen.
- Die ZMK sind stark, denn es gibt zwischen den Teilchen Dipolkräfte und/oder H-Brücken.
- Der Schmelz- und der Siedepunkt sind infolge der stärkeren ZMK höher als bei den flüchtigen Stoffen (1).
- Ebenfalls aufgrund "similia similibus solvuntur" lassen sich die flüchtigen Stoffe (2) nur in polaren Lösungsmitteln lösen.
- Die elektrische Leitfähigkeit besitzen die flüchtigen Stoffe (2) aus dem gleichen Grund wie die flüchtigen Stoffen (1) nicht.
- Beispiele für die flüchtigen Stoffe (2) sind Wasser (H2O) und Ammoniak (NH3).
Die diamantartigen Stoffe
- Die diamantartigen Stoffe enthalten ebenfalls Elektronenpaarbindungen.
- Diamantartige Stoffe haben "Riesenmoleküle" als kleinste Teilchen. Im Falle von Diamant wären das etliche miteinander verbundene Kohlenstoffatome.
- Dadurch dass zum Beispiel Diamant nur aus Kohlenstoffatomen besteht, gibt es zwischen den Teilchen gar keine Kräfte. Denn diese Kohlenstoffatome unterscheiden sich nicht in den Ladungen oder der Grösse oder ähnlichem.
- Der Schmelz- und Siedepunkt bei diamantartigen Stoffen ist sehr, sehr hoch, da es eben riesige Moleküle sind, deren Bindungen aufgespalten werden müssen.
- Diamantartige Stoffe sind nicht löslich.
- Bei den diamantartigen Stoffen sind die Voraussetzungen für elektrische Leitfähigkeit nicht erfüllt. Somit leiten sie nicht.
- Beispiele für diamantartige Stoffe sind Diamant und Quarz (SiO2).
Die hochmolekularen Stoffe
- Auch die hochmolekularen Stoffe enthalten Elektronenpaarbindungen.
- Die kleinsten Teilchen dieser Stoffe sind lange, kettenartige Moleküle.
- Da die kleinsten Teilchen "Ketten" sind, entstehen starke Van der Waals-Kräfte (siehe Abschnitt Van der Waals-Kräfte).
- Der Schmelzpunkt ist relativ hoch, der Siedepunkt ist auch relativ hoch, viele hochmolekulare Stoffe zersetzen sich jedoch, wenn es zu heiss ist.
- Da die hochmolekularen Stoffe unpolar sind, können sie nur in unpolaren Lösungsmitteln gelöst werden.
- Auch bei den hochmolekularen Stoffen sind die Voraussetzungen für die elektrische Leitfähigkeit nicht erfüllt, ergo leiten auch sie nicht.
- Beispiele für die hochmolekularen Stoffe sind Fett oder Kunststoffe wie Nylon, Latex, PET und PVC.
Die salzartigen Stoffe
- Bei den salzartigen Stoffen ist die Ionenbindung die Bindungsart. (siehe B Ionenbindung)
- Die kleinsten Teilchen sind deshalb logischerweise die Kationen bzw. die Anionen.
- Zwischen den Teilchen herrschen sehr starke Coulombkräfte.
- Und wegen diesen starken ZMK sind Schmelz- und Siedepunkt sehr hoch.
- In polaren Lösungsmitteln sind die salzartigen Stoffe löslich.
- In festem Zustand erfüllen die salzartigen Stoffe die Voraussetzungen für elektrische Leitfähigkeit nur zur Hälfte. Die geladenen Teilchen sind zwar da, aber sie sind nicht frei beweglich. Somit sind sie in festem Zustand nicht leitend.
In flüssigem bzw. aquatisiertem (=mit Wasser gelöstem) Zustand hingegen sind die elektrisch geladenen Teilchen frei beweglich, somit kann Strom geleitet werden.
- Beispiele für salzartige Stoffe sind Kochsalz (Na+Cl-) und Kalk (Ca2+CO32-)
Die metallischen Stoffe
- Die metallischen Stoffe enthalten Metallbindungen. (siehe C Metallbindungen)
- Die kleinsten Teilchen der metallischen Stoffe sind Atomrümpfe bzw. Elektronengas.
- Zwischen den Teilchen bestehen Coulombkräfte.
- Aufgrund dieser relativ starken Coulombkräfte sind Schmelz- und Siedepunkt meistens hoch.
- Metallische Stoffe sind nicht löslich.
- In festem sowie in flüssigem Zustand sind Metalle elektrisch leitend, da sowohl elektrisch geladene Teilchen vorhanden sind als auch diese elektrisch geladenen Teilchen sich frei bewegen können.
- Beispiele für die metallischen Stoffe sind Messing, Stahl, Eisen (Fe) und Gold(Au).
Quellen
- Chemieunterlagen
- Google (für die Bilder)
Weblinks
- Swisseduc – Unterrichtsserver für Chemie