Säure/Base-Puffer: Unterschied zwischen den Versionen
(→Zusammensetzung) |
(→Herleitung) |
||
| Zeile 16: | Zeile 16: | ||
=== Herleitung === | === Herleitung === | ||
| − | Die allgemeine Säure/Base-Reaktion | + | Die allgemeine Säure/Base-Reaktion |
| + | [[Bild:SBR.jpg]] | ||
== Grafische Darstellung == | == Grafische Darstellung == | ||
Version vom 18. Juni 2011, 12:25 Uhr
Ein Säure/Base-Puffer ist ein Stoffgemisch, welches in der Lage ist, den pH-Wert einer Lösung trotz Zugabe von Säuren oder Basen annähernd konstant zu halten.
Inhaltsverzeichnis
Zusammensetzung
Wird zu der Lösung eine Säure hinzugegeben, muss eine Base vorhanden sein, die statt Wasser das H+ aufnimmt. Folglich muss die Base stärker sein als Wasser. Sie darf jedoch nicht zu stark sein, da sich der pH-Wert sonst erhöht. Analog dazu muss bei Zugabe einer Base eine Säure vorhanden sein, um an Stelle des Wassers das H+ zu spenden. Auch hier gilt, dass die Säure stärker als Wasser sein muss, aber nicht zu stark, da ansonsten der pH-Wert verringert wird.
Also verwendet man für den Puffer eine schwache Säure und ihre konjugierte Base. Man beachte, dass der pH-Wert möglichst nahe beim pKs-Wert der schwachen Säure ist.
Puffergleichung von Henderson-Hasselbach
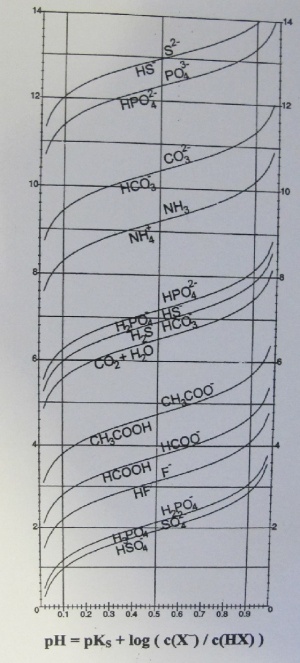
Oft braucht man die Puffergleichung von Henderson-Hasselbach zur Berechnung des pH-Wertes von Pufferlösungen. Dadurch lässt sich eine Grafik erstellen, in welcher der pH-Wert in Abhängigkeit zum Verhältnis der korrespondierenden Base zu ihrer Säure dargestellt wird.
Herleitung
Die allgemeine Säure/Base-Reaktion
![]()
Grafische Darstellung
Die Grafik zeigt, wie der Puffer wirkt. Die Wirkung hat bei relativ grossen Konzentrationsschwankungen eine kleine pH-Wert Veränderung zur Folge.