Grundlagen der Ionenbindung: Unterschied zwischen den Versionen
(→Aufbau eines Ions) |
K |
||
| (6 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 10: | Zeile 10: | ||
Ein Ion besteht aus einem Atom, welches einen Elektronenüberschuss oder Mangel aufweist. Entsteht eine possitive elektrische Ladung bei der Abgabe von einem oder mehreren Elektronen wird es '''[[Grundlagen der Ionenbindung#Die Ladung eines Ions|Kation]]''' genannt. Erhält es eine negative elektrische Ladung bei der Aufnahme von Elektronen nennt man es '''[[Grundlagen der Ionenbindung#Die Ladung eines Ions|Anion]]'''. | Ein Ion besteht aus einem Atom, welches einen Elektronenüberschuss oder Mangel aufweist. Entsteht eine possitive elektrische Ladung bei der Abgabe von einem oder mehreren Elektronen wird es '''[[Grundlagen der Ionenbindung#Die Ladung eines Ions|Kation]]''' genannt. Erhält es eine negative elektrische Ladung bei der Aufnahme von Elektronen nennt man es '''[[Grundlagen der Ionenbindung#Die Ladung eines Ions|Anion]]'''. | ||
| − | Eine Ionenbindung entsteht | + | Eine Ionenbindung entsteht meist zwischen einem Metall und einem Nichtmetall. Das Metall zieht seine Elektronen nur schwach an, das Nichtmetall zieht seine dagegen sehr stark an. Daraus resultiert, dass das Nichtmetall dem Metall seine Elektronen stehlt und somitt seine Elektronenschale auffüllt. Das Metall dagegen verliert seine Valenzelektronen und erreicht die nächste Unterschale. |
Im Gegensatz dazu steht die Elektronenpaarbindung, welche Nichtmetalle mit Nichtmetallen eingehen und dabei ihre Elektronen teilen. | Im Gegensatz dazu steht die Elektronenpaarbindung, welche Nichtmetalle mit Nichtmetallen eingehen und dabei ihre Elektronen teilen. | ||
| Zeile 26: | Zeile 26: | ||
| − | + | == Die Ladung eines Ions == | |
[[image:Kation_Anion.gif|thumb|middle|possitiv geladenes Metall (Kation) und negativ geladenes Nichtmetall (Anion);[http://www.sci.sdsu.edu/classes/biology/bio100/truesdale/Lectures%2005/lec2/Image6.gif]]] | [[image:Kation_Anion.gif|thumb|middle|possitiv geladenes Metall (Kation) und negativ geladenes Nichtmetall (Anion);[http://www.sci.sdsu.edu/classes/biology/bio100/truesdale/Lectures%2005/lec2/Image6.gif]]] | ||
| Zeile 35: | Zeile 35: | ||
Bei dieser Elektronenverschiebung entstehen positiv und negativ geladenen Teilchen, die Ionen: | Bei dieser Elektronenverschiebung entstehen positiv und negativ geladenen Teilchen, die Ionen: | ||
| − | Positiv geladenen Ionen --> Kationen | + | '''Positiv geladenen Ionen --> Kationen''' |
| − | Negativ geladenen Ionen --> Anionen | + | '''Negativ geladenen Ionen --> Anionen |
| − | |||
| + | ''' | ||
Kationen und Anionen sind entweder einfach (Na<sup>+</sup> bzw. Cl<sup>-</sup>), zweifach (Mg<sup>2+</sup> bzw. O<sup>2-</sup>) oder dreifach (Al<sup>3+</sup> bzw. N<sup>3-</sup>) positiv, respektive negativ, geladen. | Kationen und Anionen sind entweder einfach (Na<sup>+</sup> bzw. Cl<sup>-</sup>), zweifach (Mg<sup>2+</sup> bzw. O<sup>2-</sup>) oder dreifach (Al<sup>3+</sup> bzw. N<sup>3-</sup>) positiv, respektive negativ, geladen. | ||
Generell sind Anionen grösser als Kationen, da durch die Elektronenaufnahme die Valenzschale gefüllt wird und somit das Teilchen sich vergrössert. Im Gegensatz dazu, wird das Kation kleiner, da es durch die Elektronenabgabe eine tiefer gelegene volle Valenzschale erreicht. | Generell sind Anionen grösser als Kationen, da durch die Elektronenaufnahme die Valenzschale gefüllt wird und somit das Teilchen sich vergrössert. Im Gegensatz dazu, wird das Kation kleiner, da es durch die Elektronenabgabe eine tiefer gelegene volle Valenzschale erreicht. | ||
| Zeile 53: | Zeile 53: | ||
Die gegenseitige Anziehung der geladenen Ionen wirkt in alle Richtungen gleich stark. Darum umlagern sich positiv und negativ geladene Ionen zu einem geordneten Aufbau in einer Verbindung. Es bildet sich ein Ionengitter (ein Kristall), welches eine Gitterstruktur aufweist. Das Ionengitter ([[Bildung des Ionengitters]]) ist elektrisch neutral, da sich die entgegengesetzten Ladungen gegenseitig aufheben. Voraussetzung ist die korrekte stöchiometrische Zusammensetzung der kleinsten chemischen Einheit. | Die gegenseitige Anziehung der geladenen Ionen wirkt in alle Richtungen gleich stark. Darum umlagern sich positiv und negativ geladene Ionen zu einem geordneten Aufbau in einer Verbindung. Es bildet sich ein Ionengitter (ein Kristall), welches eine Gitterstruktur aufweist. Das Ionengitter ([[Bildung des Ionengitters]]) ist elektrisch neutral, da sich die entgegengesetzten Ladungen gegenseitig aufheben. Voraussetzung ist die korrekte stöchiometrische Zusammensetzung der kleinsten chemischen Einheit. | ||
| + | |||
| + | |||
| + | |||
| + | == Experiment == | ||
| + | [[image:Destilliertes Wasser.jpeg|left|;[(http://www.chemie-master.de/FrameHandler.php?loc=http://www.chemie-master.de/lex/begriffe/l06.html)]]] | ||
| + | |||
| + | [[image:Kochsalzlösung.jpeg|right|;[(http://www.chemie-master.de/FrameHandler.php?loc=http://www.chemie-master.de/lex/begriffe/l06.html)]]] | ||
| + | |||
| + | Warum leitet Wasser Strom? | ||
| + | |||
| + | Diese Frage wird anhand eines Experimentes gelöst. Dazu wird ein Strom durch destilliertes Wasser geleitet, sowie durch eine Kochsalzlösung. | ||
| + | |||
| + | Löst man eine Ionenbindung (z.B. Kochsalz) in Wasser auf, findet eine Trennung der Ionnen (Na<sup>+</sup> - Kationen und Cl<sup>-</sup> - Anionen) statt. Dadurch wird bei einem Stromfluss die Lösung elektrisch leitend. Dies geschieht weil die gelösten Ionen als Kationen zum negativen geladenen Pool und als Anionen zum possitiven geladenen Pool wandern. Somit kann bei gelösten Ionen ein Strom fliessen | ||
| + | |||
| + | Aus diesem Experiment lässt sich erklären, warum Wasser Strom leitet. Unser Trinkwasser muss gelöste Salze enthalten, das es wie die Kochsalzlösung Strom leitet. Im Vergleich dazu findet man keine elektrische Leitfähigkeit bei destillierten Wasser, da dieses rein ist. | ||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| Zeile 62: | Zeile 90: | ||
* http://mypchem.com/myp9/myp9c/myp9c_img/ionic_bonding5.gif | * http://mypchem.com/myp9/myp9c/myp9c_img/ionic_bonding5.gif | ||
* http://facstaff.gpc.edu/~pgore/PhysicalScience/ionic_bond_animation.gif | * http://facstaff.gpc.edu/~pgore/PhysicalScience/ionic_bond_animation.gif | ||
| − | + | * http://www.chemie-master.de/FrameHandler.php?loc=http://www.chemie-master.de/lex/begriffe/l06.html | |
== Weblinks == | == Weblinks == | ||
Aktuelle Version vom 23. Juni 2010, 23:29 Uhr
Die Ionenbindung(siehe auch Bildung des Ionengitters) entsteht durch die Anziehungskraft zweier unterschiedlich geladener Ionen. Wenn Atome Elektronen aufnehmen oder abgeben, entstehen Ionen. Die Ionenbindung tritt zwischen Metallen und Nichtmetallen (siehe Metalle und Nichtmetalle) auf. Alle Feststoffe, die aus Ionen aufgebaut sind, werden als Salze (Eigenschaften von Salzen) bezeichnet.
Inhaltsverzeichnis
Aufbau eines Ions
Ein Ion besteht aus einem Atom, welches einen Elektronenüberschuss oder Mangel aufweist. Entsteht eine possitive elektrische Ladung bei der Abgabe von einem oder mehreren Elektronen wird es Kation genannt. Erhält es eine negative elektrische Ladung bei der Aufnahme von Elektronen nennt man es Anion.
Eine Ionenbindung entsteht meist zwischen einem Metall und einem Nichtmetall. Das Metall zieht seine Elektronen nur schwach an, das Nichtmetall zieht seine dagegen sehr stark an. Daraus resultiert, dass das Nichtmetall dem Metall seine Elektronen stehlt und somitt seine Elektronenschale auffüllt. Das Metall dagegen verliert seine Valenzelektronen und erreicht die nächste Unterschale.
Im Gegensatz dazu steht die Elektronenpaarbindung, welche Nichtmetalle mit Nichtmetallen eingehen und dabei ihre Elektronen teilen.
Erläuterung zum Bild:
Durch das Stehlen eines Elektrons des Natrium-Atoms, kann das Chlor-Atom seine Valenzschale füllen. Das Natrium wiederum erreicht eine tiefere volle Valenzschale durch das Verlieren eines Elektrons.
Die Ladung eines Ions
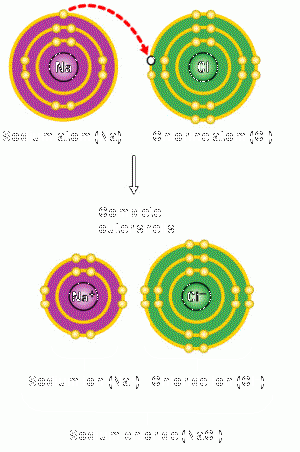
Alle Stoffe haben das Bestreben Edelgaskonfiguration zu erreichen. Bei der Ionenbindung wird dies erzielt indem das Metall Elektronen abgibt und das Nichtmetall diese aufnimmt. Zugrunde dessen liegt, dass Metalle ihre Elektronen nur schwach anziehen und sie somit die Nichtmetalle problemlos stehlen können. Die Edelgaskonfiguration wird also entweder durch die Aufnahme oder die Abgabe von Elektronen aus der Valenzschale erzielt. Achtung: Die Elektronenverschiebung hat eine Ladungsverschiebung zur Folge, die Kernladungszahl ändert sich aber nicht!
Bei dieser Elektronenverschiebung entstehen positiv und negativ geladenen Teilchen, die Ionen:
Positiv geladenen Ionen --> Kationen
Negativ geladenen Ionen --> Anionen
Kationen und Anionen sind entweder einfach (Na+ bzw. Cl-), zweifach (Mg2+ bzw. O2-) oder dreifach (Al3+ bzw. N3-) positiv, respektive negativ, geladen. Generell sind Anionen grösser als Kationen, da durch die Elektronenaufnahme die Valenzschale gefüllt wird und somit das Teilchen sich vergrössert. Im Gegensatz dazu, wird das Kation kleiner, da es durch die Elektronenabgabe eine tiefer gelegene volle Valenzschale erreicht. Durch die unterschiedliche Ladung der beiden Ionen ziehen sich Kation und Anion gegenseitig an und schliessen sich zu einer Verbindung zusammen. Diese Zusammenlagerung nennt man Ionenbindung.
Die Ionenbindung
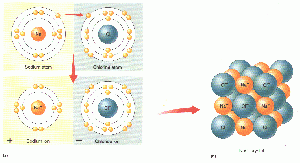
Bei einer Ionenbindung wirken zwischen den entgegengesetzt geladenen Ionen elektrostatische Anziehungskräfte, so genannte Coulomb’sche Kräfte. Nach dem coulomb’schen Gesetz ist die Anziehungskraft zwischen zwei elektrischen Ladungen
1. von der Größe der Ladungen
2. vom Abstand zwischen den Ladungen abhängig.
Die gegenseitige Anziehung der geladenen Ionen wirkt in alle Richtungen gleich stark. Darum umlagern sich positiv und negativ geladene Ionen zu einem geordneten Aufbau in einer Verbindung. Es bildet sich ein Ionengitter (ein Kristall), welches eine Gitterstruktur aufweist. Das Ionengitter (Bildung des Ionengitters) ist elektrisch neutral, da sich die entgegengesetzten Ladungen gegenseitig aufheben. Voraussetzung ist die korrekte stöchiometrische Zusammensetzung der kleinsten chemischen Einheit.
Experiment
Warum leitet Wasser Strom?
Diese Frage wird anhand eines Experimentes gelöst. Dazu wird ein Strom durch destilliertes Wasser geleitet, sowie durch eine Kochsalzlösung.
Löst man eine Ionenbindung (z.B. Kochsalz) in Wasser auf, findet eine Trennung der Ionnen (Na+ - Kationen und Cl- - Anionen) statt. Dadurch wird bei einem Stromfluss die Lösung elektrisch leitend. Dies geschieht weil die gelösten Ionen als Kationen zum negativen geladenen Pool und als Anionen zum possitiven geladenen Pool wandern. Somit kann bei gelösten Ionen ein Strom fliessen
Aus diesem Experiment lässt sich erklären, warum Wasser Strom leitet. Unser Trinkwasser muss gelöste Salze enthalten, das es wie die Kochsalzlösung Strom leitet. Im Vergleich dazu findet man keine elektrische Leitfähigkeit bei destillierten Wasser, da dieses rein ist.
Quellen
- Chemieunterlagen
- http://www.chemieplanet.de/stoffe/index.htm
Bilder
- http://www.sci.sdsu.edu/classes/biology/bio100/truesdale/Lectures%2005/lec2/Image6.gif
- http://mypchem.com/myp9/myp9c/myp9c_img/ionic_bonding5.gif
- http://facstaff.gpc.edu/~pgore/PhysicalScience/ionic_bond_animation.gif
- http://www.chemie-master.de/FrameHandler.php?loc=http://www.chemie-master.de/lex/begriffe/l06.html
Weblinks
- http://www.chemieplanet.de/ - Ionenbindungen und kovalente Bindungen
- http://www.u-helmich.de/che/09/04-ionen/ - Alles über die Ionenbindung
![Entstehung der Ionenbindung;[(http://facstaff.gpc.edu/~pgore/PhysicalScience/ionic_bond_animation.gif)]](/chemiewiki/images/d/de/Ionic_bond_animation.gif)
![;[(http://www.chemie-master.de/FrameHandler.php?loc=http://www.chemie-master.de/lex/begriffe/l06.html)]](/chemiewiki/images/c/c8/Destilliertes_Wasser.jpeg)
![;[(http://www.chemie-master.de/FrameHandler.php?loc=http://www.chemie-master.de/lex/begriffe/l06.html)]](/chemiewiki/images/8/89/Kochsalzl%C3%B6sung.jpeg)