Struktur der Elektronenhülle und Eigenschaften der Elemente: Unterschied zwischen den Versionen
| (26 dazwischenliegende Versionen von 2 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
| − | [[image:PS_GÜ.jpg|right | + | [[image:PS_GÜ.jpg|right]] |
Das Periodensystem ist nicht nur eine Aneinanderreihung von Elementen. Es gibt Gründe, warum die Elemente in dieser Reihenfolge aufgeführt werden. | Das Periodensystem ist nicht nur eine Aneinanderreihung von Elementen. Es gibt Gründe, warum die Elemente in dieser Reihenfolge aufgeführt werden. | ||
| + | |||
| + | Früher kannte man die Atomstruktur noch nicht, man wusste auch nicht, dass man zwischen Elementen und Verbindungen unterscheidet. Über die Reaktionen und die Eigenschaften der Stoffe wusste man aber schon gut Bescheid. Zu dieser Zeit hat aber noch vieles der eigentlichen Chemie gefehlt, da sie eine Wechselwirkung zwischen Struktur der Atome und den daraus folgenden Eigenschaften und Reaktionsverhalten darstellt. Das heisst also dass das heutige Periodensystem sehr stark vom „alten“ abgrenzt. Früher war das Periodensystem wie ein "Bandwurm" zu vergleichen, eine Aneinanderreihung von Elementen. | ||
Das Periodensystem wird in 8 Haupt- und 10 Nebengruppen unterteilt. | Das Periodensystem wird in 8 Haupt- und 10 Nebengruppen unterteilt. | ||
| Zeile 6: | Zeile 8: | ||
| − | == | + | == Die Struktur der Elektronenhülle '''bestimmt''' die Eigenschaften der Elemente == |
| − | Die | + | Die Elemente besitzen verschiedene Elektronenschalen. Sie werden in Perioden unterteilt, welche gleichzeitig auch noch den Unterschied der Schalenanzahl aufzeigen. |
=== Periode === | === Periode === | ||
| Zeile 17: | Zeile 19: | ||
| − | [[image: | + | [[image:Valenzbild.jpg|Bild eines Antikörpers; für eine detailliertere Sicht siehe [http://swisseduc.ch/chemie/molmod/anwendungen/antikoerper/]]] |
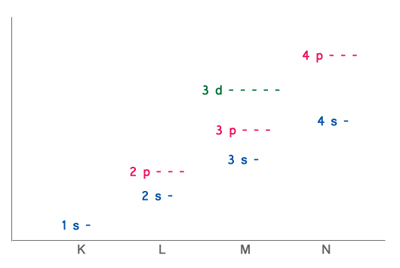
| − | <font color="#0080FF">1-4 s- | + | <font color="#0080FF">1-4 s- Unterschalen</font>, <font color="#FF8000">2-4 p- Unterschalen</font> |
Alle Nebengruppenelemente haben 2 Valenzelektronen. | Alle Nebengruppenelemente haben 2 Valenzelektronen. | ||
| − | [[image: | + | |
| + | [[image:Elektronenbild_Kopie.jpg|middle]] [[image:Wiki roti pfili.png|right]] | ||
| + | |||
| + | |||
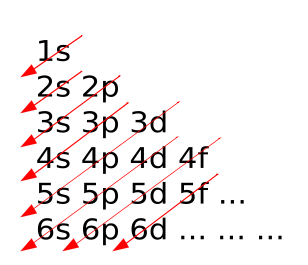
| + | 4s kommt vor 3d: | ||
| + | |||
| + | Das Schachbrettmuster stellt eine praktische Merkhilfe dieser Regel dar. | ||
| + | Die Unterschalen werden nach diesem Schema von unten nach oben und von links nach rechts besetzt. | ||
| + | Die 4s-Orbitale werden also vor den 3d-Orbitalen besetzt, weil sie energetisch tiefer liegen. | ||
| + | Nach dem Aufbauprinzip werden die Elektronen so in die Atome eingefügt, dass zunächst die kernnächsten, | ||
| + | energetisch stabilsten Niveaus mit Elektronen besetzt werden. | ||
| + | Erst danach werden entsprechend der energetischen Reihenfolge der Energieniveaus schrittweise die weiteren Orbitale besetzt. | ||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| Zeile 36: | Zeile 56: | ||
Struktur: Innerhalb einer Gruppe haben alle Elemente die gleiche Anzahl an Valenzelektronen. | Struktur: Innerhalb einer Gruppe haben alle Elemente die gleiche Anzahl an Valenzelektronen. | ||
| + | |||
| + | Es wird zwischen Haupt- und Nebengruppen unterschieden. | ||
| + | |||
| + | |||
| + | Die Nebengruppe mit ihren Übergangsmetallen zeigt Eigenschaften auf, welche sich von den Hauptgruppen unterscheiden; Der Übergang zeigt sich durch die aufeinanderfolgende Zunahme von Elektronen in den d – Schalen entlang jeder Periode. Übergangselemente besitzen entweder eine unvollständige d – Schale oder bilden Ionen mit einer unvollständigen d – Schale aus. Die äusserste Schale ist die d – Schale. Die Nebengruppenelemente zeigen meistens eine höhere Variabilität in den Oxidationszahlen als die Hauptgruppenmetalle, ausserdem unterscheiden sie sich sehr voneinander. | ||
| + | |||
| + | Die Hauptgruppen haben jeweils eine sehr grosse Übereinstimmung in den Gruppen, was mit dem Aufbau der Atome zusammenhängt. Näher beschrieben ist das auch bei den [http://www.rdeuber.ch/chemiewiki/index.php/Wichtige_Hauptgruppen wichtigen Hauptgruppen] . | ||
| + | |||
| + | |||
| + | Ausserdem gibt es noch zwei weitere Ausnahmen, das sind die Lanthanide und die Actinide. | ||
| − | Es | + | Die Lanthanide beginnen mit dem 57. Element. Es ist eine Reihe von Elementen, die mit dem Element Lanthan sehr ähnlich sind. Nach rechts nimmt die chemische Stabilität zu. Bei diesen Elementen werden die 4f – Orbitale der Atome mit Elektronen besetzt. |
| + | |||
| + | Die Actinide beginnen mit dem 89. Element. Diese Elementreihe ist mit dem Element Actinium sehr ähnlich. Die Metalle sind alle hoch toxisch und radioaktiv. Bei diesen Elementen werden die 5f-Orbitale besetzt. | ||
| Zeile 47: | Zeile 79: | ||
| + | <font color="#8A0808">Hauptgruppen</font> | ||
| − | + | <font color="#0B610B">Nebengruppen</font> | |
| − | |||
| − | + | [[image:FüR GRUPPEN.jpg]] | |
| − | |||
| + | Um das noch besser zu visualisieren, hier ein Link zur [http://de.wikipedia.org/wiki/Periodensystem#Darstellung Darstellung des Periodensystems] | ||
== Quellen == | == Quellen == | ||
| − | * | + | * Chemieunterricht |
| − | + | * [http://de.wikipedia.org/wiki/Periodensystem#Aufbau_im_Detail Wikipedia] | |
| + | * [http://www.google.ch/imghp?hl=de&tab=wi Google Bilder] | ||
== Weblinks == | == Weblinks == | ||
* [http://swisseduc.ch/chemie/ Swisseduc] – Unterrichtsserver für Chemie | * [http://swisseduc.ch/chemie/ Swisseduc] – Unterrichtsserver für Chemie | ||
| − | |||
Aktuelle Version vom 23. Juni 2010, 09:01 Uhr
Das Periodensystem ist nicht nur eine Aneinanderreihung von Elementen. Es gibt Gründe, warum die Elemente in dieser Reihenfolge aufgeführt werden.
Früher kannte man die Atomstruktur noch nicht, man wusste auch nicht, dass man zwischen Elementen und Verbindungen unterscheidet. Über die Reaktionen und die Eigenschaften der Stoffe wusste man aber schon gut Bescheid. Zu dieser Zeit hat aber noch vieles der eigentlichen Chemie gefehlt, da sie eine Wechselwirkung zwischen Struktur der Atome und den daraus folgenden Eigenschaften und Reaktionsverhalten darstellt. Das heisst also dass das heutige Periodensystem sehr stark vom „alten“ abgrenzt. Früher war das Periodensystem wie ein "Bandwurm" zu vergleichen, eine Aneinanderreihung von Elementen.
Das Periodensystem wird in 8 Haupt- und 10 Nebengruppen unterteilt. Die Struktur der Elektronenhülle bestimmt die Elemente. Da die Elemente verschiedene Elektronenschalen besitzen, werden sie in Perioden unterteilt, welche gleichzeitig auch noch den Unterschied der Schalenanzahl anzeigen.
Inhaltsverzeichnis
Die Struktur der Elektronenhülle bestimmt die Eigenschaften der Elemente
Die Elemente besitzen verschiedene Elektronenschalen. Sie werden in Perioden unterteilt, welche gleichzeitig auch noch den Unterschied der Schalenanzahl aufzeigen.
Periode
Eigenschaften: In einer Periode ändern sich die Eigenschaften der Elemente kontinuierlich.
Struktur: Eine Periode enthält alle Elemente mit derselben Valenzschale.
1-4 s- Unterschalen, 2-4 p- Unterschalen
Alle Nebengruppenelemente haben 2 Valenzelektronen.
4s kommt vor 3d:
Das Schachbrettmuster stellt eine praktische Merkhilfe dieser Regel dar. Die Unterschalen werden nach diesem Schema von unten nach oben und von links nach rechts besetzt. Die 4s-Orbitale werden also vor den 3d-Orbitalen besetzt, weil sie energetisch tiefer liegen. Nach dem Aufbauprinzip werden die Elektronen so in die Atome eingefügt, dass zunächst die kernnächsten, energetisch stabilsten Niveaus mit Elektronen besetzt werden. Erst danach werden entsprechend der energetischen Reihenfolge der Energieniveaus schrittweise die weiteren Orbitale besetzt.
Gruppe
Eigenschaften: Die Elemente haben zum Teil ähnliche Eigenschaften in den Gruppen
Struktur: Innerhalb einer Gruppe haben alle Elemente die gleiche Anzahl an Valenzelektronen.
Es wird zwischen Haupt- und Nebengruppen unterschieden.
Die Nebengruppe mit ihren Übergangsmetallen zeigt Eigenschaften auf, welche sich von den Hauptgruppen unterscheiden; Der Übergang zeigt sich durch die aufeinanderfolgende Zunahme von Elektronen in den d – Schalen entlang jeder Periode. Übergangselemente besitzen entweder eine unvollständige d – Schale oder bilden Ionen mit einer unvollständigen d – Schale aus. Die äusserste Schale ist die d – Schale. Die Nebengruppenelemente zeigen meistens eine höhere Variabilität in den Oxidationszahlen als die Hauptgruppenmetalle, ausserdem unterscheiden sie sich sehr voneinander.
Die Hauptgruppen haben jeweils eine sehr grosse Übereinstimmung in den Gruppen, was mit dem Aufbau der Atome zusammenhängt. Näher beschrieben ist das auch bei den wichtigen Hauptgruppen .
Ausserdem gibt es noch zwei weitere Ausnahmen, das sind die Lanthanide und die Actinide.
Die Lanthanide beginnen mit dem 57. Element. Es ist eine Reihe von Elementen, die mit dem Element Lanthan sehr ähnlich sind. Nach rechts nimmt die chemische Stabilität zu. Bei diesen Elementen werden die 4f – Orbitale der Atome mit Elektronen besetzt.
Die Actinide beginnen mit dem 89. Element. Diese Elementreihe ist mit dem Element Actinium sehr ähnlich. Die Metalle sind alle hoch toxisch und radioaktiv. Bei diesen Elementen werden die 5f-Orbitale besetzt.
Hauptgruppen: Von einer Hauptgruppe zur nächsten kommt immer ein Valenzelektron dazu.
Nebengruppen: Von Nebengruppe zu Nebengruppe kommt immer zusätzlich ein Elektron in einer d- oder s- Unterschale, was aber kein Valenzelektron ist.
Hauptgruppen
Nebengruppen
Um das noch besser zu visualisieren, hier ein Link zur Darstellung des Periodensystems
Quellen
- Chemieunterricht
- Wikipedia
- Google Bilder
Weblinks
- Swisseduc – Unterrichtsserver für Chemie

![Bild eines Antikörpers; für eine detailliertere Sicht siehe [1]](/chemiewiki/images/2/23/Valenzbild.jpg)