Die polare Bindung: Unterschied zwischen den Versionen
K |
|||
| (50 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 4: | Zeile 4: | ||
Wasser → nicht brennbar : energiearm | Wasser → nicht brennbar : energiearm | ||
| + | |||
| + | Dieses Experiment dient dazu, um die Bedeutung der Frage aufzuzeigen, wann eine Bindung polar ist oder nicht. | ||
| + | |||
| + | Unpolare Bindungen → energiereiche Stoffe, wie Benzin oder Zucker | ||
| + | Polare Bindugen → energiearme Stoffe, wie Wasser | ||
| + | |||
| + | Die Frage der Energieversorgung in Biologie und Technologie ist also mit der Frage der Polarität von Bindungen eng verbunden. | ||
| + | |||
| + | Bei der polaren Atombindung nutzen zwei oder mehrere Elemente ihre Valenzelektronen gemeinsam, um die energetisch günstige Edelgaskonfiguration anzustreben. Das eine Atom zieht die Bindungselektronen stärker zu sich heran, dadurch entsteht im Molekül ein Pol mit einer positiven Partialladung (δ+) und ein Pol mit einer negativen Partialladung (δ-). | ||
| + | |||
| − | |||
==Polare-unpolare Bindung== | ==Polare-unpolare Bindung== | ||
| Zeile 12: | Zeile 21: | ||
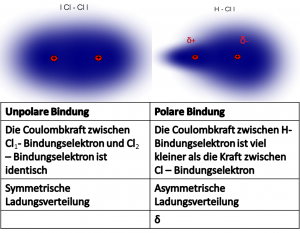
Im Chlormolekül liegen zwei gleiche Atome vor: | Im Chlormolekül liegen zwei gleiche Atome vor: | ||
| − | Sie haben beide die gleiche Kernladung und die gleiche | + | → Sie haben beide die gleiche Kernladung und die gleiche Grösse. |
| − | → | + | → Sie haben dieselbe Elektronegativität (EN). |
| − | → | + | → Die Bindungselektronen sind gleichmässig zwischen den Atomen verteilt. |
| − | → | + | → Die Atombindung ist unpolar. |
Im Chlorwasserstoffmolekül liegen zwei unterschiedliche Atome vor: | Im Chlorwasserstoffmolekül liegen zwei unterschiedliche Atome vor: | ||
| − | Wasserstoff hat eine geringe Kernladung und ist | + | → Wasserstoff hat eine geringe Kernladung und das Atom ist klein → geringe EN (2,2). |
| − | Das Chloratom hat eine höhere Kernladung als Wasserstoff und ist auch | + | → Das Chloratom hat eine höhere Kernladung als Wasserstoff und ist auch grösser → höhere EN (3.2). |
| − | Da Chlor das elektronegativere Atom ist, zieht es die Bindungselektronen | + | → Da Chlor das elektronegativere Atom ist, zieht es die Bindungselektronen näher zu sich. |
| − | → | + | → Die Bindungselektronen sind ungleichmässig verteilt. |
| − | → | + | → Die Atombindung ist polar. |
| + | |||
| + | Moleküle mit solchen polaren Elektronenpaarbindungen sind im Allgemeinen Dipolmoleküle. | ||
| + | |||
| + | Polare Stoffe lösen sich besser in polaren Lösungsmitteln (z.B. Salze in Wasser). Die Löslichkeit ist umso höher, je ähnlicher die Wechselwirkungskräfte zwischen den Teilchen des Lösungsmittels und zwischen denen des gelösten Stoffes sind. (siehe: [[Löslichkeit]]) | ||
==Die Elektronegativität== | ==Die Elektronegativität== | ||
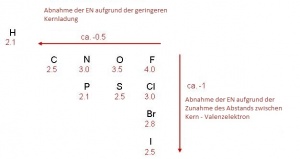
| − | + | Die Elektronegativität (ΔEN) ist ein Mass der Anziehungskraft, die ein Atomkern in einer Molekülbindung auf die Bindungselektronen ausübt. Die Elektronegativität nimmt in einer Periode von links nach rechts zu, weil die Anzahl der Elektronen in der Valenschale steigt. In einer Gruppe nimmt die Elektronegativität von oben nach unten ab, da der Abstand zwischen den Valenzelektronen und dem Atomkern zunimmt. Dieses Konzept wurde von Linus Pauling [http://de.wikipedia.org/wiki/Linus_Carl_Pauling] im Jahr 1932 eingeführt. | |
| − | + | [[image:Die_Elektronegativitaet1.JPG|thumb|right|]] | |
| − | + | → Bei den Edelgasen gibt es keine Elektronegativität, da sie eine volle Valenzschale haben. | |
| − | |||
| − | + | '''Die Differenz der Elektronegativität (ΔEN) wird folgendermassen berechnet:''' | |
| − | & | + | ΔEN = EN<SUB>Atom 1</SUB>- EN<SUB>Atom 2</SUB> |
| − | + | Faustregel: Eine Bindung ist dann polar, wenn ΔEN > 0.5. | |
| + | Erklärung: Die ΔEN ist ein Mass für die Polarität einer Bindung. | ||
| − | + | ==Die Bindungsstärke== | |
| + | Die Bindungsenergie (EB) ist die freiwerdende Energie, wenn ein Mol Bindung gebildet wird, wobei sich die bindenden Atome vom Abstand unendlich bis zum Abstand (E<SUB>pot</SUB>(min)) annähert. | ||
| + | [[image:Bindungsenergie.gif|thumb|right|Vergleiche die Potentialkurfe der H<SUB>2</SUB>-Bindung.]] | ||
| − | + | Es braucht sehr viel Energie, um dem elektronegativeren Atom das "gestohlene" Elektron wieder wegzunehmen. | |
| + | '''→ Polare Bindungen sind stärker als unpolare.''' | ||
| − | |||
| − | + | '''''Exkurs Photosynthese:''''' | |
| − | + | Sinn der Photosynthese: Aus energiearmen Stoffen mit polaren (starken) Bindungen werden durch Sonnenenergie energiereiche Stoffe mit unpolaren (schwachen) Bindungen gebildet. Diese bilden also eine Art "Energiespeicher", der bei Bedarf wieder durch Reaktion mit Sauerstoff zu den energiearmen CO<SUB>2</SUB> und H<SUB>2</SUB>O reagieren, wobei Energie frei wird, die für andere Vorgänge genutzt wird. | |
| + | |||
| + | Organische Stoffe mit schwächeren Bindungen zerfallen zu anorganischen Stoffen mit stärkeren Bindungen. Dabei wird Energie frei. | ||
| + | |||
| + | Dies ist die Umkehrreaktion der Verbrennung. | ||
| + | |||
| + | '''Zusätzliche Faktoren, welche die Bindungsstärke (Bindungsenergie) beeinflussen:''' | ||
| + | |||
| + | [[image:Tabelle1.png]] | ||
| − | |||
| − | |||
==Quellen== | ==Quellen== | ||
| − | - | + | - Chemieunterlagen aus dem 1. und 2. Jahr der Kantonsschule Baden. |
| + | |||
| + | '''Bilder:''' | ||
| + | |||
| + | Polare Bindung:[http://www.u-helmich.de/che/09/05-molek/Folien/Fo12-14.jpg] | ||
| − | + | Bindungsstärke:[http://science.uwaterloo.ca/~cchieh/cact/c120/bondel.html] | |
Aktuelle Version vom 20. Juni 2010, 19:20 Uhr
Exp:
Pentan → brennbar : energiereich
Wasser → nicht brennbar : energiearm
Dieses Experiment dient dazu, um die Bedeutung der Frage aufzuzeigen, wann eine Bindung polar ist oder nicht.
Unpolare Bindungen → energiereiche Stoffe, wie Benzin oder Zucker Polare Bindugen → energiearme Stoffe, wie Wasser
Die Frage der Energieversorgung in Biologie und Technologie ist also mit der Frage der Polarität von Bindungen eng verbunden.
Bei der polaren Atombindung nutzen zwei oder mehrere Elemente ihre Valenzelektronen gemeinsam, um die energetisch günstige Edelgaskonfiguration anzustreben. Das eine Atom zieht die Bindungselektronen stärker zu sich heran, dadurch entsteht im Molekül ein Pol mit einer positiven Partialladung (δ+) und ein Pol mit einer negativen Partialladung (δ-).
Inhaltsverzeichnis
Polare-unpolare Bindung
Im Chlormolekül liegen zwei gleiche Atome vor:
→ Sie haben beide die gleiche Kernladung und die gleiche Grösse.
→ Sie haben dieselbe Elektronegativität (EN).
→ Die Bindungselektronen sind gleichmässig zwischen den Atomen verteilt.
→ Die Atombindung ist unpolar.
Im Chlorwasserstoffmolekül liegen zwei unterschiedliche Atome vor:
→ Wasserstoff hat eine geringe Kernladung und das Atom ist klein → geringe EN (2,2).
→ Das Chloratom hat eine höhere Kernladung als Wasserstoff und ist auch grösser → höhere EN (3.2).
→ Da Chlor das elektronegativere Atom ist, zieht es die Bindungselektronen näher zu sich.
→ Die Bindungselektronen sind ungleichmässig verteilt.
→ Die Atombindung ist polar.
Moleküle mit solchen polaren Elektronenpaarbindungen sind im Allgemeinen Dipolmoleküle.
Polare Stoffe lösen sich besser in polaren Lösungsmitteln (z.B. Salze in Wasser). Die Löslichkeit ist umso höher, je ähnlicher die Wechselwirkungskräfte zwischen den Teilchen des Lösungsmittels und zwischen denen des gelösten Stoffes sind. (siehe: Löslichkeit)
Die Elektronegativität
Die Elektronegativität (ΔEN) ist ein Mass der Anziehungskraft, die ein Atomkern in einer Molekülbindung auf die Bindungselektronen ausübt. Die Elektronegativität nimmt in einer Periode von links nach rechts zu, weil die Anzahl der Elektronen in der Valenschale steigt. In einer Gruppe nimmt die Elektronegativität von oben nach unten ab, da der Abstand zwischen den Valenzelektronen und dem Atomkern zunimmt. Dieses Konzept wurde von Linus Pauling [1] im Jahr 1932 eingeführt.
→ Bei den Edelgasen gibt es keine Elektronegativität, da sie eine volle Valenzschale haben.
Die Differenz der Elektronegativität (ΔEN) wird folgendermassen berechnet:
ΔEN = ENAtom 1- ENAtom 2
Faustregel: Eine Bindung ist dann polar, wenn ΔEN > 0.5. Erklärung: Die ΔEN ist ein Mass für die Polarität einer Bindung.
Die Bindungsstärke
Die Bindungsenergie (EB) ist die freiwerdende Energie, wenn ein Mol Bindung gebildet wird, wobei sich die bindenden Atome vom Abstand unendlich bis zum Abstand (Epot(min)) annähert.
Es braucht sehr viel Energie, um dem elektronegativeren Atom das "gestohlene" Elektron wieder wegzunehmen.
→ Polare Bindungen sind stärker als unpolare.
Exkurs Photosynthese:
Sinn der Photosynthese: Aus energiearmen Stoffen mit polaren (starken) Bindungen werden durch Sonnenenergie energiereiche Stoffe mit unpolaren (schwachen) Bindungen gebildet. Diese bilden also eine Art "Energiespeicher", der bei Bedarf wieder durch Reaktion mit Sauerstoff zu den energiearmen CO2 und H2O reagieren, wobei Energie frei wird, die für andere Vorgänge genutzt wird.
Organische Stoffe mit schwächeren Bindungen zerfallen zu anorganischen Stoffen mit stärkeren Bindungen. Dabei wird Energie frei.
Dies ist die Umkehrreaktion der Verbrennung.
Zusätzliche Faktoren, welche die Bindungsstärke (Bindungsenergie) beeinflussen:
Quellen
- Chemieunterlagen aus dem 1. und 2. Jahr der Kantonsschule Baden.
Bilder:
Polare Bindung:[2]
Bindungsstärke:[3]