Grundlagen der Ionenbindung: Unterschied zwischen den Versionen
K |
|||
| Zeile 33: | Zeile 33: | ||
| − | Bei dieser Elektronenverschiebung entstehen positiv und negativ geladenen Teilchen, | + | Bei dieser Elektronenverschiebung entstehen positiv und negativ geladenen Teilchen, die Ionen: |
Positiv geladenen Ionen --> Kationen | Positiv geladenen Ionen --> Kationen | ||
Version vom 30. Mai 2010, 21:07 Uhr
Die Ionenbindung(siehe auch Bildung des Ionengitters) entsteht durch die Anziehungskraft zweier unterschiedlich geladener Ionen. Wenn Atome Elektronen aufnehmen oder abgeben, entstehen Ionen. Die Ionenbindung tritt zwischen Metallen und Nichtmetallen (siehe Metalle und Nichtmetalle) auf. Alle Feststoffe, die aus Ionen aufgebaut sind, werden als Salze (Eigenschaften von Salzen) bezeichnet.
Inhaltsverzeichnis
Aufbau eines Ions
Ein Ion besteht aus einem Atom, welches einen Elektronenüberschuss oder Mangel aufweist. Entsteht eine possitive elektrische Ladung bei der Abgabe von einem oder mehreren Elektronen wird es Kation genannt. Erhält es eine negative elektrische Ladung bei der Aufnahme von Elektronen nennt man es Anion.
Eine Ionenbindung entsteht immer zwischen einem Metall und einem Nichtmetall. Das Metall zieht seine Elektronen nur schwach an, das Nichtmetall zieht seine dagegen sehr stark an. Daraus resultiert, dass das Nichtmetall dem Metall seine Elektronen stehlt und somitt seine Elektronenschale auffüllt. Das Metall dagegen verliert seine Valenzelektronen und erreicht die nächste Unterschale.
Im Gegensatz dazu steht die Elektronenpaarbindung, welche Nichtmetalle mit Nichtmetallen eingehen und dabei ihre Elektronen teilen.
Erläuterung zum Bild:
Durch das Stehlen eines Elektrons des Natrium-Atoms, kann das Chlor-Atom seine Valenzschale füllen. Das Natrium wiederum erreicht eine tiefere volle Valenzschale durch das Verlieren eines Elektrons.
Die Ladung eines Ions
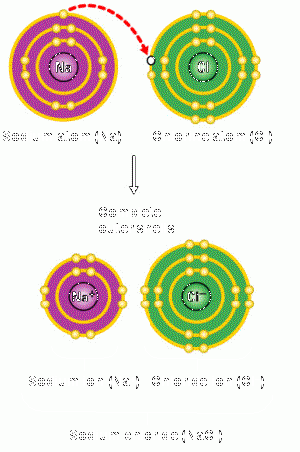
Alle Stoffe haben das Bestreben Edelgaskonfiguration zu erreichen. Bei der Ionenbindung wird dies erzielt indem das Metall Elektronen abgibt und das Nichtmetall diese aufnimmt. Zugrunde dessen liegt, dass Metalle ihre Elektronen nur schwach anziehen und sie somit die Nichtmetalle problemlos stehlen können. Die Edelgaskonfiguration wird also entweder durch die Aufnahme oder die Abgabe von Elektronen aus der Valenzschale erzielt. Achtung: Die Elektronenverschiebung hat eine Ladungsverschiebung zur Folge, die Kernladungszahl ändert sich aber nicht!
Bei dieser Elektronenverschiebung entstehen positiv und negativ geladenen Teilchen, die Ionen:
Positiv geladenen Ionen --> Kationen
Negativ geladenen Ionen --> Anionen
Kationen und Anionen sind entweder einfach (Na+ bzw. Cl-), zweifach (Mg2+ bzw. O2-) oder dreifach (Al3+ bzw. N3-) positiv, respektive negativ, geladen.
Generell sind Anionen grösser als Kationen, da durch die Elektronenaufnahme die Valenzschale gefüllt wird und somit das Teilchen sich vergrössert. Im Gegensatz dazu, wird das Kation kleiner, da es durch die Elektronenabgabe eine tiefer gelegene volle Valenzschale erreicht.
Durch die unterschiedliche Ladung der beiden Ionen ziehen sich Kation und Anion gegenseitig an und schliessen sich zu einer Verbindung zusammen.
Diese Zusammenlagerung nennt man Ionenbindung.
Die Ionenbindung
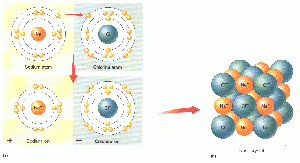
Bei einer Ionenbindung wirken zwischen den entgegengesetzt geladenen Ionen elektrostatische Anziehungskräfte, so genannte Coulomb’sche Kräfte. Nach dem coulomb’schen Gesetz ist die Anziehungskraft zwischen zwei elektrischen Ladungen
1. von der Größe der Ladungen
2. vom Abstand zwischen den Ladungen abhängig.
Die gegenseitige Anziehung der geladenen Ionen wirkt in alle Richtungen gleich stark. Darum umlagern sich positiv und negativ geladene Ionen zu einem geordneten Aufbau in einer Verbindung. Es bildet sich ein Ionengitter (ein Kristall), welches eine Gitterstruktur aufweist. Das Ionengitter (Bildung des Ionengitters) ist elektrisch neutral, da sich die entgegengesetzten Ladungen gegenseitig aufheben. Voraussetzung ist die korrekte stöchiometrische Zusammensetzung der kleinsten chemischen Einheit.
Quellen
- Chemieunterlagen
- http://www.chemieplanet.de/stoffe/index.htm
Bilder
- http://www.sci.sdsu.edu/classes/biology/bio100/truesdale/Lectures%2005/lec2/Image6.gif
- http://mypchem.com/myp9/myp9c/myp9c_img/ionic_bonding5.gif
- http://facstaff.gpc.edu/~pgore/PhysicalScience/ionic_bond_animation.gif
Weblinks
- http://www.chemieplanet.de/ - Ionenbindungen und kovalente Bindungen
- http://www.u-helmich.de/che/09/04-ionen/ - Alles über die Ionenbindung
![Entstehung der Ionenbindung;[(http://facstaff.gpc.edu/~pgore/PhysicalScience/ionic_bond_animation.gif)]](/chemiewiki/images/d/de/Ionic_bond_animation.gif)