Struktur und Eigenschaften der Metalle: Unterschied zwischen den Versionen
Aus Chemiewiki
Zur Navigation springenZur Suche springen (→Eigenschaften) |
|||
| Zeile 12: | Zeile 12: | ||
*Elektrische Leitfähigkeit | *Elektrische Leitfähigkeit | ||
| − | + | **Voraussetzung: frei bewegliche geladene Teilchen. | |
Version vom 30. Mai 2010, 20:35 Uhr
Vorkommen
Metalle haben schwache Anziehungskräfte auf ihre Elektronen, und kommen deshalb in der Natur nicht in elementarer Form vor. Eine Ausnahme hiervon bilden die Edelmetalle, die nicht oder nur sehr langsam reagieren. Metalle können aber aus Erzen hergsteellt werden, indem man ihnen die Ionen zurückgibt. Letztlich werden jedoch alle so hergestellten Metalle über kurz oder lang vom Luftsauerstoff wieder zerstört.
Struktur
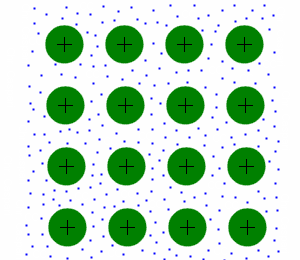
Bei Metallen sind die Atomrümpfe (hier grün dargestellt) in einem Gitter angeordnet. Dieses Gitter ist sehr stabil, aber im Gegensatz zum Ionengitter auch verformbar. Die Elektronen (blau dargestellt) befinden sich frein beweglich (Stichwort "Elektronengas") zwischen den Atomrümpfen
Eigenschaften
- Elektrische Leitfähigkeit
- Voraussetzung: frei bewegliche geladene Teilchen.
- Glanz --> Lichterscheinung --> die Elektronen sind angeregt, das Licht wird absorbiert. Die äusseren Elektronen sind so beweglich, dass sie alle enegetischen Zustände annehmen können. Wenn sie dann wieder in einen kleineren energetischen Zustand zurückfallen, reflektieren sie. Metalle können auch Farben spiegeln (nehmen die Farbe auf und geben sie wieder ab)
Struktur
- Die Atomrümpfe werden von frei beweglichen Elektronen (auch als Elektronengas bezeichnet) umgeben, die wie Kitt fungieren: Wird Druck auf das Gitter ausgeübt, wird es verbogen, ohne dass es zerbricht.
- "Metalle sind Schwächlinge". Der Sauerstoff "klaut" dem Metall die Elektronen.
- Elektronen befinden sich im und um das Metallgitter
Eigenschaften
- Metalle rosten bzw. oxidieren wegen den schwachen Anziehungskräften der Elektronen
- Metalle leiten Wärme: Die Atome liegen nahe beieinander, wenn das eine schwingt, bringt es die nächsten auch ins Schwingen. Die Schwingung wird weitergegeben.