Die polare Bindung: Unterschied zwischen den Versionen
K |
K |
||
| Zeile 43: | Zeile 43: | ||
===Definition=== | ===Definition=== | ||
| − | Die Elektronegativität (ΔEN) ist ein Mass für die Anziehungskraft eines Atomkerns in einer Molekülbinung Elektronenpaare an sich zu . Die | + | Die Elektronegativität (ΔEN) ist ein Mass für die Anziehungskraft eines Atomkerns in einer Molekülbinung Elektronenpaare an sich zu . Die EN nimmt in einer Periode von links nach rechts zu, weil die Anzahl der Protonen im Kern steigt. In einer Gruppe nimmt die EN von oben nach unten ab, da der Abstand zwischen Elektron und Atomkern zunimmt. Dieses Konzept wurde von Linus Pauling [http://de.wikipedia.org/wiki/Linus_Carl_Pauling] im Jahr 1932 ingeführt. |
===Die Eletkronegativität der Nichtmetalle=== | ===Die Eletkronegativität der Nichtmetalle=== | ||
| Zeile 49: | Zeile 49: | ||
(Lässt sich auch im Periodensystem ablesen) | (Lässt sich auch im Periodensystem ablesen) | ||
| − | [[ | + | [[image:Die_Elektronegativitaet1.JPG|thumb|right|]] |
→ die Edelgase haben keine Elektronegativität, weil sie ja bereits volle Schalle haben und deshalb keine weiteren Elektronen anziehen | → die Edelgase haben keine Elektronegativität, weil sie ja bereits volle Schalle haben und deshalb keine weiteren Elektronen anziehen | ||
Version vom 29. Mai 2010, 00:46 Uhr
Exp:
Pentan → brennbar : energiereich
Wasser → nicht brennbar : energiearm
Bei der polaren Atombindung nutzen zwei oder mehrere Nichtmetalle ihre Valenzelektronen gemeinsam, um die energetisch günstige Edelgaskonfiguration anzustreben. Dabei geschieht es, dass die gemeinsamen Bindungselektronen stärker vom Atom mit der höheren Elektronegativität angezogen werden. Dadurch erfährt das Molekül eine Polarisierung.
Polare Stoffe lösen sich besser in polaren Lösungsmittel (z.B. Salze in Wasser). Die Löslichkeit ist umso besser, je ähnlicher die Wechselwirkungskräfte zwischen den Teilchen des Lösungsmittels und zwischen denen des gelösten Stoffes sind. (siehe Löslichkeit)
Inhaltsverzeichnis
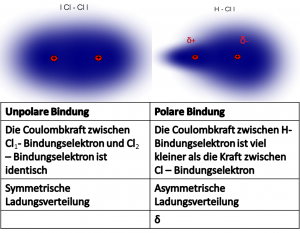
Polare-unpolare Bindung
Im Chlormolekül liegen zwei gleiche Atome vor:
Sie haben beide die gleiche Kernladung und die gleiche Größe.
→ sie haben dieselbe Elektronegativität (EN)
→ die Bindungselektronen sind gleichmässig zwischen den Atomen verteilt
→die Atombindung ist unpolar
Im Chlorwasserstoffmolekül liegen zwei unterschiedliche Atome vor:
Wasserstoff hat eine geringe Kernladung und ist ein kleines Atom → geringe EN (2,2)
Das Chloratom hat eine höhere Kernladung als Wasserstoff und ist auch größer → höhere EN (3.2)
Da Chlor das elektronegativere Atom ist, zieht es die Bindungselektronen etwas näher zu sich.
→ die Bindungselektronen sind ungleichmäßig verteilt.
→ die Atombindung ist polar.
Die Elektronegativität
Definition
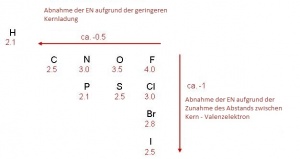
Die Elektronegativität (ΔEN) ist ein Mass für die Anziehungskraft eines Atomkerns in einer Molekülbinung Elektronenpaare an sich zu . Die EN nimmt in einer Periode von links nach rechts zu, weil die Anzahl der Protonen im Kern steigt. In einer Gruppe nimmt die EN von oben nach unten ab, da der Abstand zwischen Elektron und Atomkern zunimmt. Dieses Konzept wurde von Linus Pauling [1] im Jahr 1932 ingeführt.
Die Eletkronegativität der Nichtmetalle
(Lässt sich auch im Periodensystem ablesen)
→ die Edelgase haben keine Elektronegativität, weil sie ja bereits volle Schalle haben und deshalb keine weiteren Elektronen anziehen
Das Mass für Bindungspolarität: ΔEN
ΔEN = ENAtom 1- ENAtom 2
ΔEN > 0.5 → polare Bindung
Die Stärke der polaren Bindung
Die polare Bindung ist die stärkste Elektronenpaarbindung und somit auch die stärkste Bindung zwischen zwei Nichtmetallen.
→ polare Bindungen sind starke Bindungen, da es viel Energie braucht, um dem elektronegativen Atom das Elektron des Bindiungspartners wieder wegzunehmen.
→ polare Bindungen sind leicht zu bilden
→ bei der Bildung der Bindung wird Energie frei
Quellen
-Chemie-Unterricht Notitzen
-Graphics made by Urs Wegmann